Виды теплоемкости в зависимости от температуры
С увеличением температуры значение теплоемкости газа возрастает.
Чем больше температура, тем больше требуется теплоты для нагревания газа на 1 градус.
Различают теплоемкости:
Среднюю – в интервале температур (С m ),
Истинную – для данной температуры Для воздуха k =1,4 для газов k =1,33
Первый закон термодинамики
Любое физическое тело, в частности рабочее тело - газ, обладает внутренней энергией. Количество ее не является постоянным.
При взаимодействии с другими телами или с внешней средой, внутренняя энергия рабочего тела может уменьшаться или увеличиваться.
При механической работе рабочее тело может расширяться, т. е. производить работу за счет своей внутренней энергии, которая при этом будет уменьшаться.
Или рабочее тело будет сжиматься, для чего потребуется совершение работы сжатия внешней средой (внешними силами). При этом внутренняя энергия рабочего тела увеличится.
Работа расширения и сжатия называется работой изменения объема.
Во всех случаях общее количество внутренней энергии всех тел, участвующих во взаимодействии, если они образуют изолированную систему, остается постоянным, что следует из всеобщего закона сохранения и превращения энергии, согласно которому при всех
превращениях энергия не исчезает и не создается, а лишь переходит из одного вида в другой.
Математически этот всеобщий закон выражается уравнением первого начала термодинамики
|
|
|
Q 1,2 = ( U 2 - U 1 ) + L 1,2 где
Q 1,2 - теплота, подводимая или отводимая в процессе 1-2;
U 2 и U 1 - внутренняя энергия в начале и в конце процесса 1-2;
L 1,2 - работа изменения объема в процессе 1-2.
Из этого уравнения видно, что вся подведенная к рабочему телу теплота расходуется на изменение внутренней энергии и на совершение работы изменения объем.
Для рабочего тела массой 1 кг уравнение первого начала термодинамики принимает вид
q 1,2 = ( u 2 - u 1 ) + l 1,2 где
q 1,2 - удельная теплота, подводимая или отводимая в процессе 1-2;
u 2 и u 2 - удельная внутренняя энергия в начале и в конце процесса 1-2;
l 1,2 - удельная работа изменения объема в процессе 1-2.
Уравнение первого начала термодинамики действительно при взаимодействии рабочего тела с внешней средой в общем виде, поэтому величины, входящие в него, являются алгебраическими; в отдельных конкретных случаях их значения могут равняться нулю, быть положительными или отрицательными.
Для определения знака каждой из этих величин руководствуются следующими правилами:
· внешняя теплота Q 1,2 является положительной, если она подводится к рабочему телу, и отрицательной, если отводится от него;
|
|
|
· работа изменения объема L 1,2 будет положительной, если она совершается рабочим телом (т.е. при расширении рабочего тела), и отрицательной, если совершается внешней средой над рабочим телом (т. е. при сжатии рабочего тела);
· изменение внутренней энергии является положительной величиной, если эта энергия D U = ( U 2 - U 1 ) увеличивается. В этом случае в конце процесса 1-2 конечное значение внутренней энергии должно быть больше начального.
Из уравнения первого начала термодинамики следует также, что невозможно создать вечный двигатель ( perpetuum mobile ) первого рода, т.е. двигатель, который производил бы работу без затраты энергии.
Внутренняя энергия является суммой внутренней кинетической энергии движения молекул и потенциальной энергии взаимодействия молекул
U = U к - U п
В идеальных газах взаимодействие между молекулами отсутствует и внутренняя энергия состоит из внутренней кинетической энергии движения молекул U = U к
Так как температура идеального газа определяется внутренней кинетической энергией, то и внутренняя энергия является параметром состояния
Следовательно, изменение внутренней энергии не зависит от вида процесса изменения состояния газа, а только от начального и конечного состояний, определяемых по параметрам
|
|
|
D U = U 2 - U 1, D u = u 2 - u1
D u = cv DТ [Дж/кг] - для 1 кг газа
D U = mcv DТ [Дж] – для массы газа
Работа изменения объема обусловлена изменением объема рабочего тела. Работа расширения – работа против действия внешних сил, работа сжатия – работа внешних сил по сжатию газа.
Определяется графически и аналитически.
Аналитически работа определяется по формуле:
dl = pdv , для 1 кг газа
dL = pdV , для массы газа
Из формулы следует, что давление – это причина обмена энергией в форме работы, а изменение объема – признак.
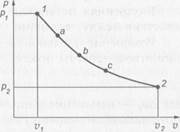
Для графического определения работы используется диаграмма v-р или рабочая диаграмма. Работа определяется как площадь, лежащая под линией процесса.
Работа зависит от характера процесса и является функцией процесса.
Энтропия – это физическая величина, изменение которой является признаком наличия обмена энергией в форме теплоты.Кроме теплообмена никакие воздействия на ТДС не могут изменить энтропию.
При подводе теплоты энтропия - увеличивается, при отводе - уменьшается.
|
|
|
Обозначается: S [ДЖ/К] – для массы газа
s [ДЖ/кг×К] – дл 1кг газа
Теплота в процессе обусловлена изменением энтропии рабочего тела.
Определяется графически и аналитически.
Аналитически работа определяется по формуле:
dq = Tds , для 1 кг газа
dQ = TdS , для массы газа
Из формулы следует, что температура – это причина обмена энергией в форме теплоты, а изменение энтропии – признак.
Для графического определения теплоты используется диаграмма s-T или тепловая диаграмма. Теплота определяется как площадь, лежащая под линией процесса.
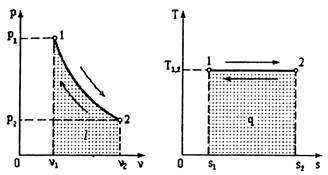
Теплота зависит от характера процесса и является функцией процесса.
Термодинамические процессы
Термодинамический процесс (ТД процесс) – это изменение состояния ТД системы, характеризующееся изменением её параметров.
Графическое исследование ТД процессов проводится с помощью рабочей ( v - р) и тепловой ( s - T ) диаграмм, на которых состояние ТД системы изображается в виде точки, ТД процесс в виде кривой, представляющей последовательность состояний.
Равновесный ТД процесс – последовательность равновесных состояний.
Неравновесный ТД процесс – последовательность состояний, среди которых не все являются равновесными.
Обратимый ТД процесс – это процесс, при котором в прямом и обратном направлении рабочее тело проходит через цепь равновесных состояний , следовательно все обратимые процессы равновесные.
Условия обратимости:
Ø Бесконечно медленное протекание процесса;
Ø Нет потерь энергии
Ø Определение процесса:
Изохорный процесс
Изохорный процесс - процесс изменения состояния термодинамической системы, протекающий при постоянном объёме.
Уравнение процесса: v = const
Графическое изображение процесса в рабочей v – p и тепловой s - T диаграммах
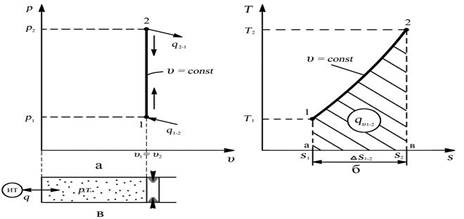
Изохора – линия изохорного процесса в рабочей диаграмме прямая параллельная оси давлений, в тепловой диаграмме логарифмическая кривая
Связь между параметрами в процессе: р1/р2 = Т1/Т2 – закон Шарля,
В изохорном процессе отношение абсолютных давлений пропорционально отношению абсолютных температур.
Уравнение первого закона термодинамики для процесса:
(q =Du + l, т.к. l = 0) q = D u ,
В изохорном процессе вся подведенная к телу теплота расходуется на изменение внутренней энергии.
Изменение внутренней энергии в процессе: D u = cv (Т2 - Т1)
Работа в процессе: l = 0
Теплота в процессе: (qv =D u) qv = cv (Т2 - Т1)
СХЕМА ЭНЕРГООБМЕНА
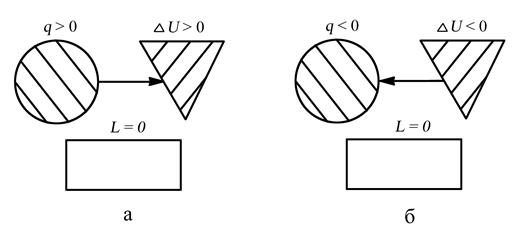
а – процесс подвода теплоты, б – процесс отвода теплоты
Изобарный процесс
Определение процесса:
Изобарный процесс - процесс изменения состояния термодинамической системы, протекающий при постоянном давлении.
Уравнение процесса: р = const
Графическое изображение процесса в рабочей v – p и тепловой s - T диаграммах
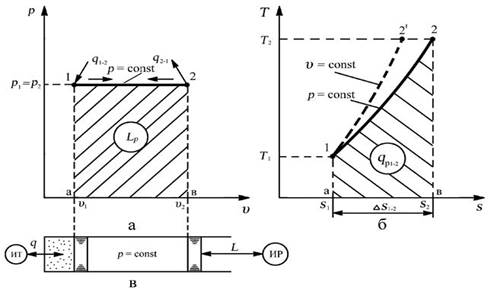
Изобара – линия изобарного процесса в рабочей диаграмме прямая параллельная оси удельных объемов, в тепловой диаграмме логарифмическая кривая (изохора располагается круче)
Связь между параметрами в процессе: v 1 / v 2 = Т1/Т2 – закон Гей-Люссака. В изобарном процессе отношение удельных объемов пропорционально отношению абсолютных температур.
Уравнение первого закона термодинамики для процесса: q = D u + l. В изобарном процессе вся подведенная к телу теплота расходуется на изменение внутренней энергии и совершении работы.
Изменение внутренней энергии в процессе: D u = cv (Т2 - Т1)
Работа в процессе: l = р( v 2 - v 1 ), l = R (Т2 - Т1)
l = рv2 - рv2 = R Т2 - R Т1 = R (Т2 - Т1) R = l /(Т2 - Т1 )
Теплота в процессе: q р =D u + l
qр = cv(Т2 - Т1)+ R (Т2 - Т1 ) = (cv + R) (Т2 - Т1)
q р = c р (Т2 - Т1 )
СХЕМА ЭНЕРГООБМЕНА
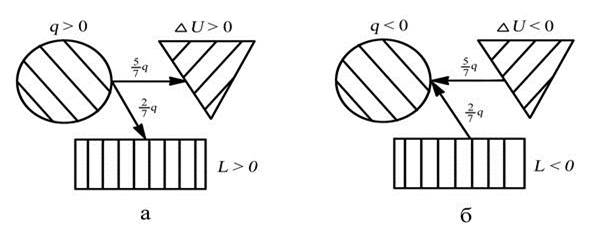
а – процесс подвода теплоты, б – процесс отвода теплоты
Изотермический процесс
Определение процесса:
Изотермический процесс - процесс изменения состояния термодинамической системы, протекающий при постоянной температуре.
Уравнение процесса: р v = со nst ( T = const , р v = RT )
Графическое изображение процесса в рабочей v – p и тепловой s - T диаграммах
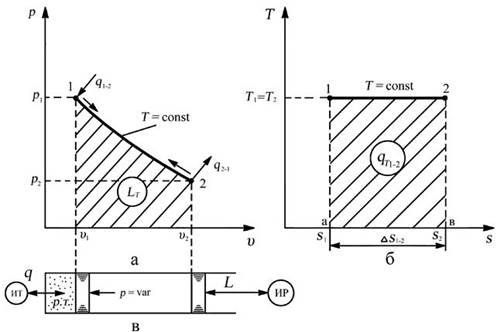
ИЗОТЕРМА – линия изотермического процесса, в рабочей диаграмме - равнобокая гипербола, в тепловой диаграмме прямая, параллельная оси энтропии.
Изотермический процесс – это реально очень медленно протекающий процесс, чтобы температура успевала выровняться.
Связь между параметрами в процессе:
р1 / р2 = v 2 / v 1 - закон Бойля –Мариотта,
В изотермическом процессе отношение абсолютных давлений обратно пропорционально отношению удельных объемов.
Уравнение первого закона термодинамики для процесса: q = l ,
(q =Du + l, т.к. Du = 0, Du = cv (Т2 - Т1)=0, Т2 = Т1
В изотермическом процессе вся подведенная к телу теплота расходуется на совершение работы.
Изменение внутренней энергии в процессе: D u = cv (Т2 - Т1), Т2 = Т1, D u =0
Работа в процессе:
l = ∫ pdv = ∫ RTdv / v ( p = RT / v )
l = RT∫dv/v = RT ln( v2 / v1 ) = RT ln( p1 / p2 )
l = pv ln( v2 / v1 ) = pv ln( p1 / p2 )
Теплота в процессе: (q =D u + l , D u =0) q = l = RT ln ( v 2 / v 1 ) = RT ln ( p 1 / p 2 )
СХЕМА ЭНЕРГООБМЕНА
 |  | ||||||
 |  | ||||||
+ q -q
 | |||
 | |||
 -l
-l
+l
а б
а – процесс подвода теплоты, б – процесс отвода теплоты
Адиабатный процесс
Определение процесса:
Адиабатный процесс - процесс изменения состояния термодинамической системы, протекающий без теплообмена с окружающей средой.
Адиабатные процессы – это реальные процессы протекающие очень быстро и без учета трения.
Уравнение процесса: р vk = со nst , k - показатель адиабаты
Графическое изображение процесса в рабочей v – p и тепловой s - T диаграммах
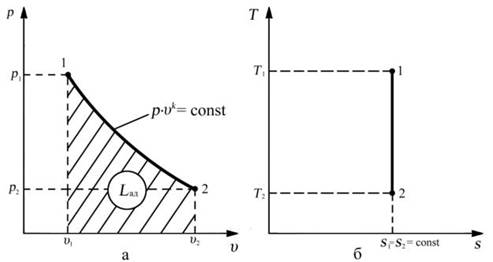


АДИАБАТА – линия адиабатного процесса, в рабочей диаграмме расположена круче изотермы, в тепловой, прямая параллельная оси температуры.
Соотношение между параметрами в процессе
р 1 / р 2 = (v2 / v1)k
T1/ T2 = (v2/ v1)k-1
T 1 / T 2 = (р1/ р2 ) k -1/ k
Уравнение первого закона термодинамики для процесса:
q =Du + l, т.к. q = 0, D u = - l или l = - D u
Изменение внутренней энергии в процессе: D u = cv (Т2 - Т1)
Работа в процессе: l = - cv (Т2 - Т1) = cv (Т1 – Т2)
Выразим cv (изохорную теплоемкость) через k (показатель адиабаты) и R (удельную газовую постоянную) с помощью уравнения Майера, то получим формулу работы: l = R / k -1(Т1 – Т2), раскроем скобки и используем уравнение состояния газа l = R Т1 – R Т2 / k -1= pv 1 – pv 2 / k -1, а если Т1 вынести за скобку и отношение температур заменить на отношение удельных объемов или отношение давлений, то получим следующие формулы работы:
l=R Т 1 (1 – T2/ T1 ) / k-1 = pv1 (1 – T2/ T1 ) / k-1
l=R Т 1 (1 – (v1/ v2)k-1) / k-1= pv1 (1 – (v1/ v2)k-1) / k-1
l=R Т 1 (1 – ( р 2 / р 1 )k-1/k) / k-1 = pv1 (1 – ( р 2 / р 1 )k-1/k) / k-1
Теплота в процессе: q = 0
СХЕМА ЭНЕРГООБМЕНА
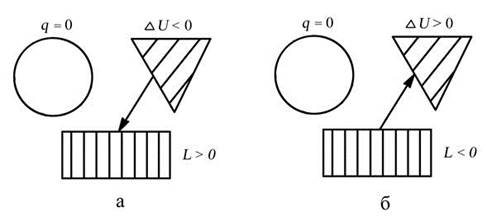
а – процесс подвода теплоты, б – процесс отвода теплоты
Политропные процессы
Определение процесса:
Политропные процессы – это процессы изменения состояния термодинамической системы, при которых доля тепла, идущая на изменение внутренней энергии величина постоянная.
Политропные процессы – это реально существующие в природе процессы
φ = D u / q = const
α = 1- φ ( α = D u / l ), где
φ – доля тепла, идущая на изменение внутренней энергии,
α – доля тепла, идущая на совершение работы.
v = const φ = cv (Т2 – Т1) / cv (Т2 - Т1) = 1, α = 0
р = const φ = cv (Т2 – Т1) / cр (Т2 - Т1) = cv /cр = 5/7, α = 2/7
pv = const φ = 0/ q = 0, α = 1
рvk = соnst φ = Du /0 = ∞, α = 0
Уравнение процесса:
р vn = со nst
n- показатель политропы
v = const n = ∞ (р 1/nv= соnst, р 1/n= 1, n = ∞)
р = const n = 0
pv = const n = 1
рvk = соnst n = k
Для определения показателя политропы в процессе применяется формула:
(р1 v1n = р2 v2n р1/ р2 = (v2 / v1)n )
n= 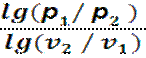
Графическое изображение политропных процессов в рабочей и тепловой диаграммах
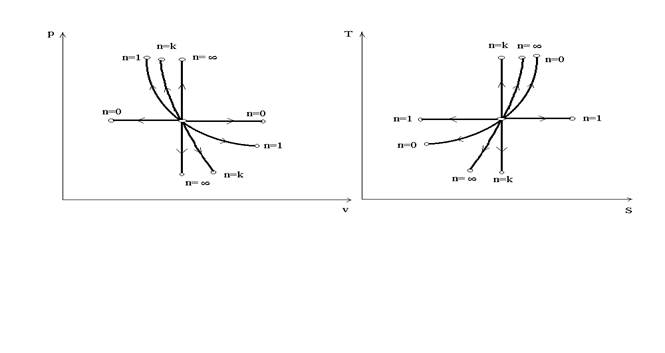
Соотношение между параметрами в процессе
р 1 / р 2 = (v2 / v1)n
T1/ T2 = (v2/ v1)n-1
T 1 / T 2 = (р1/ р2 ) 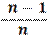
Уравнение первого закона термодинамики для процесса:
q = D u + l
v = const q = D u
р = const q = D u + l
pv = const q = l
рvk = соnst l = - D u
Изменение внутренней энергии в процессе:
D u = cv (Т2 - Т1)
Работа в процессе: l = cv (Т1 – Т2)=
= 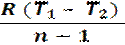 =
= 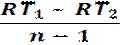
= 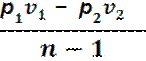 =
= 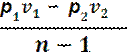 =
= 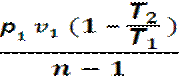
= 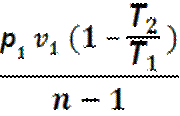 =
= 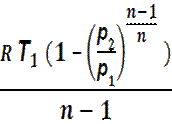
Теплота в процессе: (обозначим теплоемкость в политропном процессе с) в результате преобразований получим формулу для определения теплоемкости в политропном процессе
q = c (Т2 - Т1) = cv ( ( n - k )/ ( n -1)) (Т2 – Т)
Группы политропных процессов
1 группа 0 ‹ n ‹1
2 группа 1 ‹ n ‹ k ( k =1,4)
3 группа k ‹ n ‹ ∞
Второй закон термодинамики
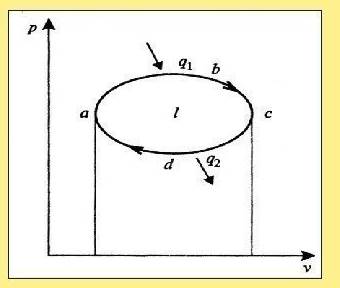
Замкнутым процессом или циклом называется совокупность последовательных процессов, в результате совершения которых, конечное состояние газа одинаково с начальным состоянием.
Циклы осуществляются в тепловых машинах для получения полезной работы.
Для этого необходимо чтобы кривая процесса сжатия находилась ниже линии процесса расширения, то есть работа процесса сжатия был меньше работы процесса расширения.
Это возможно, когда теплота подводится в процессе расширения и отводится при сжатии.
Дата добавления: 2019-02-22; просмотров: 712; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
