Экспериментальные и расчетные данные
Минобрнауки России
федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Санкт-Петербургский государственный технологический институт
(технический университет)»
Отчет по лабораторной работе №1
«Электрохимическое получение пероксодисерной кислоты»
Выполнила
Саморукова Д.В.
Преподаватель
Евреинова Н.В.
Санкт-Петербург
2017
Цель работы: получение пероксодисерной кислоты электролизом. Исследование влияния на выход по току продукта и на удельный расход энергии концентрации электролита, плотности тока, температуры, добавок, продолжительности электролиза.
Методика проведения исследования
1. В прямоугольный электролизер погружаем графитовые блоки-катоды, анодную ячейку.
2. При помощи мерного цилиндра наливаем в катодное и анодное пространство католит и анолит.
3. Погружаем платино-титановый анод-холодильник в анодную ячейку с термометром. Анодное пространство перед началом электролиза необходимо охладить до температуры не менее 10 – 15  .
.
4.  Собираем электрическую схему согласно рисунку 1:
Собираем электрическую схему согласно рисунку 1:
Рисунок 1 Принципиальная схема установки для электролиза:
1 - электролизер; 2 – кулонометр; 3 – катод; 4 – анод; 5, 6 – тумблеры
5. Фиксируем время начала электролиза и включаем ток.
6. Регулярно через 20 минут фиксируем напряжение на электролизере и температуру, а также следим за тем, чтобы ток был постоянен – 9 А.
|
|
|
7. Каждые 30 минут отбираем пробы электролита для определения количества иона персульфата при помощи перманганотометрии. Ход анализа:
- титрование холостой пробы сульфата железа. Для этого в колбу отбираем 15 мл раствора следующего состава:  . Оттитровываем 0,1 М раствором
. Оттитровываем 0,1 М раствором  . Замеряем объем титранта, пошедшего на титрование холостой пробы;
. Замеряем объем титранта, пошедшего на титрование холостой пробы;
- титрование рабочей пробы, содержащую 2 мл электролита и 15 мл раствора  . Также замеряем объем титранта пошедшего на титрование рабочей пробы. Вследствие окисления части
. Также замеряем объем титранта пошедшего на титрование рабочей пробы. Вследствие окисления части  ионами
ионами  на титрование пойдет меньшее количество перманганата:
на титрование пойдет меньшее количество перманганата:

Приборы и материалы
- электролизер с графитовыми катодами и платино-титановыми анодами с рабочей площадью 0,03344  ;
;
- электролит: анолит – 350 мл, католит – 380 мл;
- источник тока;
- реостат;
- амперметр, вольтметр;
- термометр;
- мерные цилиндры;
- бюретка;
- стеклянная колба.
Реакции, протекающие при электролизе
На аноде:  разряд ионов.
разряд ионов.
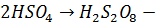 димеризация.
димеризация.

На катоде: 
Суммарная реакция: 
Теоретическая часть
Пероксодисерная кислота - сильный окислитель, являющийся промежуточным продуктом для дальнейшего получения пероксида водорода.
|
|
|
Электрохимическое получение пероксодисерной кислоты возможно только при наличии диафрагмы, которая служит для разделения катодного и анодного пространства электролизера, которое необходимо для того, чтобы охлаждалось до температуры 10 – 15  только анодное пространство. Повышение температуры является одним из тормозящих факторов и снижает выход по току вплоть до 0.
только анодное пространство. Повышение температуры является одним из тормозящих факторов и снижает выход по току вплоть до 0.
Платино-титановый анод обладает двумя штуцерами для пропускания охлаждающей воды, они же являются токоподводами. Таким образом, данная конструкция позволяет увеличить плотность тока при низких температурах. Корпус анода - титановый, но он в процессе не участвует, т.к. электрохимически пассивируется. Рабочая поверхность – платиновая фольга, которая приваривается к поверхности электрода тонкими пластинами в целях экономичности.
Материал катода - графитовые блоки, используются из-за пористой структуры, которая препятствует выделению большого количества водорода.
Условия электролиза:
- высокий положительный потенциал  , при котором происходит окисление
, при котором происходит окисление 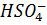 ;
;
- высокая плотность тока, которая в производстве составляет
|
|
|
 ;
;
- проведение электролиза в малых объемах электролита, с целью предотвращения побочных процессов;
- высокие объемные плотности тока  .
.
Состав раствора:
-  , т.к. более концентрированная серная кислота обладает малой электрической проводимостью. Температура подвергаемого электролизу раствора серной кислоты не должна превышать 15 – 17
, т.к. более концентрированная серная кислота обладает малой электрической проводимостью. Температура подвергаемого электролизу раствора серной кислоты не должна превышать 15 – 17  . Повышение температуры вызывает увеличение скорости побочной реакции – гидролиза пероксодисерной кислоты и падение вследствие этого выхода по току продукта.
. Повышение температуры вызывает увеличение скорости побочной реакции – гидролиза пероксодисерной кислоты и падение вследствие этого выхода по току продукта.
- различные добавки, которые увеличивают выход по току пероксодисерной кислоты:  (до
(до  ), которые адсорбируют на аноде и повышают перенапряжение побочной электрохимической реакции выделения кислорода.
), которые адсорбируют на аноде и повышают перенапряжение побочной электрохимической реакции выделения кислорода.
Диафрагма препятствует попаданию продукта электросинтеза на катод и его восстановлению. Материалом для диафрагмы чаще всего служит керамика или пористый винипласт.
В промышленности для получения пероксодисерной кислоты используются каскадные ванны, благодаря которым удается подавить влияние высокой концентрации  на скорость ее гидролиза. В случае каскадного положения анодных ячеек анолит, перетекая из одной ячейки в другую, постепенно обогащается пероксодисерной кислотой. В первой ячейке концентрация персульфат-ионов минимальна, следовательно, скорость гидролиза тоже минимальна. Данный процесс обеспечивает максимальный выход по току продукта.
на скорость ее гидролиза. В случае каскадного положения анодных ячеек анолит, перетекая из одной ячейки в другую, постепенно обогащается пероксодисерной кислотой. В первой ячейке концентрация персульфат-ионов минимальна, следовательно, скорость гидролиза тоже минимальна. Данный процесс обеспечивает максимальный выход по току продукта.
|
|
|
Экспериментальные и расчетные данные
На титрование холостой пробы с 350 мл раствора  пошло 9,5 мл
пошло 9,5 мл  . Далее в таблице 1 представлены результаты титрования рабочих проб.
. Далее в таблице 1 представлены результаты титрования рабочих проб.
Таблица 1 – Экспериментальные данные
| Номер замера | Время, мин | Температура, | Напряжение, В | Результаты титрования | |
| Объем электролита, мл | Объем
 , мл , мл
| ||||
| 1 | 30 | 14,5 | 6,1 | 350 | 5,9 |
| 2 | 60 | 14,5 | 6,0 | 348 | 5,05 |
| 3 | 90 | 14 | 5,9 | 346 | 4,3 |
| 4 | 120 | 14 | 6,0 | 344 | 3,725 |
Массу пероксодисерной кислоты во всем объеме можно рассчитать по формуле:

Где  среднеарифметические результаты титрования,
среднеарифметические результаты титрования, 
 химический эквивалент
химический эквивалент  ;
;  общий объем электролита,
общий объем электролита, 
 молярность
молярность  ;
; 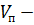 объем электролита в пробе,
объем электролита в пробе,  .
.
Количество электричества рассчитываем по следующей формуле:

Выход по току:

Удельный расход электроэнергии:

Плотность тока:

Таблица 2 – Расчетные данные
| Номер замера | Масса | Концентрация
| Количество электричества, А*ч | Выход по току, % | Удельный расход электроэнергии, Вт*ч/кг | |
| До начала опыта | Прирост за 
| |||||
| 1 | ||||||
| 2 | ||||||
| 3 | ||||||
| 4 | ||||||
Считаем среднеарифметический выход по току:

Средний удельный расход электроэнергии будет равен:

Выводы: в ходе проделанной лабораторной работы, мы получили пероксодисерную кислоту путем электролиза. Исходя из расчетов, можно сказать, что количество пероксодисерной кислоты увеличивается с течением времени, но в то же время, выход по току продукта уменьшается. Это связано с тем, что концентрация кислоты увеличивается, а, следовательно, начинают происходить побочные реакции, в том числе и реакция гидролиза. Низкая температура, наоборот сказывается положительно на протекании реакции электролиза пероксодисерной кислоты. С увеличением концентрации пероксодисерной кислоты с течением времени увеличиваются затраты на электроэнергию, что делает процесс энергозатратным, а значит увеличивает его стоимость.
Список литературы
Прикладная электрохимия. Учеб. для вузов./ Под ред. докт. техн. Наук проф. А. П. Томилова. – 3-е изд., перераб. – М.: Химия, 1984. 520 с., ил.
Практикум по прикладной электрохимии: Учеб. пособие для вузов/ Н.Г. Борисоглебский, Г.К. Буркат и др.; Под ред. В.Н. Варыпаева, В.Н.Кудрявцева. – 3-е изд., перераб. – Л.: Химия, 1990. – 304 с.: ил.
Дата добавления: 2019-02-22; просмотров: 592; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!


