Література для підготовки теоретичного матеріалу
Опрацювати розділи 9, 10 підручника [6] та 3.2 посібника [3].
План вивчення розділу
1 Дисперсні системи: визначення, класифікація, основні
поняття.
2 Механізм розчинення, розчинність та її чинники.
3 Концентрації розчинів.
4 Колігативні властивості розчинів.
5 Електролітична дисоціація:
5.1 теорія електролітичної дисоціації, елементи
теорій Бренстеда і Льюїса;
5.2 елементи теорії сильних електролітів;
5.3 електролітична дисоціація води.
6 Рівновага у розчинах електролітів:
6.1 зміщення рівноваги дисоціації слабких електро-
літів;
6.2 добуток розчинності;
6.3 електролітична дисоціація води;
6.4 гідроліз солей.
7 Приклади розв’язання типових задач і виконання завдань.
8 Завдання для самоперевірки.
Приклади розв’язання типових задач і виконання
Завдань
Приклад 1 Коефіцієнт розчинності CuSO4 при 250С дорівнює 25 г. Скільки грамів солі міститься у 200 г насиченого розчину?
Розв’язання. Маса насиченого розчину складається з маси солі і маси води. Коефіцієнт рочинності CuSO4 показує, що 25 г солі розчиняється у 100 г води, тобто в такому випадку усього насиченого розчину утворюється 125 г. А далі складемо пропорцію:
| 125 г | розчину містить | 25 г 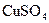 ; ;
|
| 200 г | розчину містить | x г 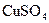 . .
|
Звідси маса 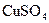 у 200г насиченого розчину
у 200г насиченого розчину
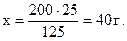
Приклад 2 Натрій гідроксид кількістю речовини 1,5 моль розчинили у 140 г води. Визначити масову частку NaOH у розчині.
|
|
|
Розв’язання. З урахуванням співвідношення

обчислимо масу 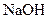 :
:
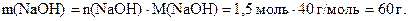 Маса усього розчину складається з маси
Маса усього розчину складається з маси 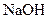 і маси води:
і маси води:
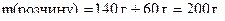
Знайдемо масову частку натрій гідроксиду в розчині:
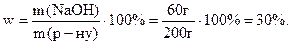
Приклад 3 Розрахуйте: а) молярну концентрацію; б) молярну концентрацію еквівалента; в) мольну частку розчиненої речовини 49% розчину 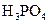 (
( 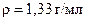 ).
).
Розв’язання: а) для зручності розрахунку беремооб’єм розчину таким, що дорівнює 1л. Розраховуємо масу 1л розчину:

Розраховуємо масу 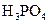 в розчині:
в розчині:

Також розраховуємо масу води у розчині:
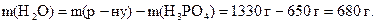
Розраховуємо молярну концентрацію 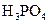 :
:

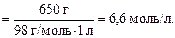
б) розраховуємо молярну концентрацію еквівалента 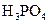 :
:

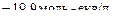
в) для розрахунку мольної частки 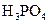 спочатку встановлюємо кількості компонентів розчину:
спочатку встановлюємо кількості компонентів розчину:


Розраховуємо мольну частку 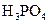 :
:

Приклад 4 У трьох склянках міститься по 100 мл 0,1М розчину 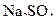 з густиною 1,012 г/мл. До однієї з них додали 60 мл води, до другої – 10 г сухого
з густиною 1,012 г/мл. До однієї з них додали 60 мл води, до другої – 10 г сухого  , а з третьої випарили 20 г води. Як змінилася масова частка у кожному випадку?
, а з третьої випарили 20 г води. Як змінилася масова частка у кожному випадку?
Розв’язання. Для визначення масової частки вихідного розчину 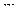 спочатку необхідно обчислити масу розчину
спочатку необхідно обчислити масу розчину
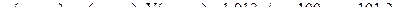
і масу речовини  , враховуючи об’єм
, враховуючи об’єм 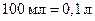 і молярну масу солі
і молярну масу солі 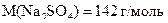 :
:

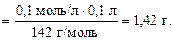
Тоді масова частка вихідного розчину:
|
|
|
 (або
(або  ).
).
Після того як у першу склянку долили воду, маса одержаного розчину збільшилися на масу води:
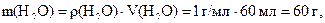
тобто маса першого розчину:
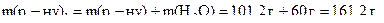
а масова частка 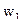 у ньому:
у ньому:
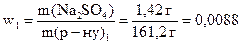 (або
(або  ).
).
Отже, у першій склянці масова частка зменшилась у:
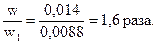
У другій склянці після додавання 10 г 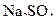 маса розчину становить:
маса розчину становить:
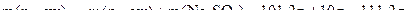 а маса речовини в ньому:
а маса речовини в ньому:
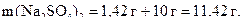
Масова частка у другому розчині:
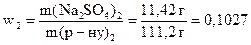 (або
(або 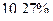 ).
).
Масова частка у другому розчині зросла у:

Маса розчину у третій склянці після випаровування 20 г води дорівнює:
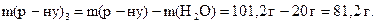
Беручи до уваги, що маса речовини не змінилася, обчислимо масову частку у третьому розчині:
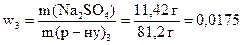 (або
(або 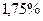 ).
).
Отже, у третьому розчині масова частка теж зросла у:
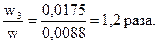
Приклад 5 При температурі 800С у 500 г води можна максимально розчинити 325 г 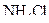 . Визначити коефіцієнт розчинності
. Визначити коефіцієнт розчинності  .
.
Розв’язання. Складемо пропорцію:
| у 500 г | розчиняється | 325 г 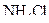 ; ;
|
| у 100 г | розчиняється | x г 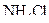 . .
|
Звідки знайдемо коефіцієнт розчинності:

Приклад 6 У 1,2 л розчину міститься 20,5 мг сахарози 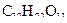 . Розрахуйте осмотичний тиск розчину при 220С.
. Розрахуйте осмотичний тиск розчину при 220С.
Розв’язання.З урахуванням маси сахарози ( 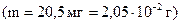 та її молярної маси
та її молярної маси 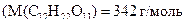 обчислимо молярну концентрацію розчину
обчислимо молярну концентрацію розчину
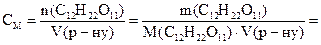

При розв’язуванні задач, пов’язаних із знаходженням осмотичного тиску, слід пам’ятати, що одиницею його вимірювання є 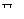 . З іншого боку,
. З іншого боку, 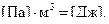
|
|
|
Відповідно до закону Вант-Гоффа осмотичний тиск розчину становить:
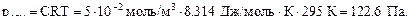 Приклад 7 У 250 мл розчину міститься 17 мг розчиненої речовини. Осмотичний тиск розчину при 270С становить 1,84 кПа. Визначте молярну масу речовини.
Приклад 7 У 250 мл розчину міститься 17 мг розчиненої речовини. Осмотичний тиск розчину при 270С становить 1,84 кПа. Визначте молярну масу речовини.
Розв’язання. Враховуючи, що
 ,
,
розраховуємо молярну масу речовини за формулою
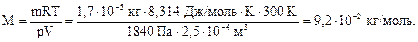 Приклад 8 Розрахуйте тиск пари води над розчином, що містить 45 г глюкози С6Н12О6 в 720г води при 250С. Тиск пари води при 250С становить 3168 Па.
Приклад 8 Розрахуйте тиск пари води над розчином, що містить 45 г глюкози С6Н12О6 в 720г води при 250С. Тиск пари води при 250С становить 3168 Па.
Розв’язання.Для даного випадкузгідно з І (тонометричним) законом Рауля можна розрахувати тиск пари води над розчином за такою формулою:
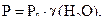
де 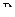 - тиск пари води над розчином при 250С;
- тиск пари води над розчином при 250С;
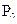 - тиск пари води при 250С;
- тиск пари води при 250С;
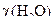 - мольна частка води в розчині.
- мольна частка води в розчині.
Спочатку знайдемо мольну частку води в розчині:
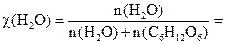



Тепер можна обчислити тиск насиченої пари розчинника над розчином:
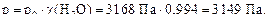
Приклад 9 Розрахуйте молекулярну масу речовини, якщо відомо, що водний розчин, у якому міститься 5,12 г у 100 г води, замерзає при -0,2800С; кріоскопічна стала води 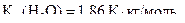
Розв’язання.За наслідком закону Рауля зниження температури кристалізації (або замерзання) розчину порівняно з температурою кристалізації чистого розчинника пропорційно моляльній концентрації розчиненої речовини ( 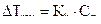 ). Якщо підставити в рівняння Рауля вираз моляльної концентрації, одержимо
). Якщо підставити в рівняння Рауля вираз моляльної концентрації, одержимо
|
|
|
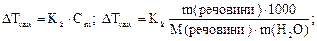
звідки молярна маса речовини становить:
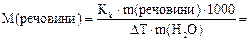
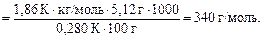
Оскільки відносна молекулярна маса чисельно дорівнює молярній масі, то маємо:
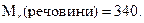
Приклад 10Складіть рівняння електролітичної дисоціації таких речовин: а) хлоридної кислоти; б) ортоарсенатної кислоти; в) купрум(ІІ) гідроксиду; г) ферум(ІІІ) сульфату; д) кальцій дигідрогенортофосфату; е) гідроксокупрум(ІІ) хлориду.
Розв’язання.При виконанні подібних завдань ви маєте змогу перевірити заряди йонів у таблиці розчинності (додаток Д). У рівняннях дисоціації сильних електролітів замість знаку оборотності необхідно зазначати напрямок процесу за допомогою стрілочки.
а) хлоридна кислота – сильний електроліт, отже, дисоціює практично повністю:
 ;
;
б) ортоарсенатна кислота є слабким електролітом, піддається ступеневій дисоціації, причому на кожному ступені дисоціація проходить частково:
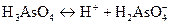 (за першим ступенем),
(за першим ступенем),
 (за другим ступенем),
(за другим ступенем),
 (за третім ступенем);
(за третім ступенем);
в) купрум(ІІ) гідроксид є слабким електролітом, теж дисоціює по всім ступеням неповністю:
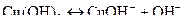 (за першим ступенем),
(за першим ступенем),
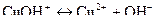 (за другим ступенем),
(за другим ступенем),
г) ферум(ІІІ) сульфат – сильний електроліт, добре розчинна сіль, тому дисоціює в одну стадію повністю:
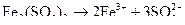 ;
;
д) кальцій дигірогенортофосфат – кисла сіль, яка за першим ступенем дисоціює повністю, а з іншими – ні:
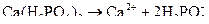 (за першим ступенем),
(за першим ступенем),
 (за другим ступенем),
(за другим ступенем),
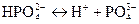 (за третім ступенем);
(за третім ступенем);
е) гідроксокупрум(ІІ) хлорид – основна сіль, яка за першим ступенем дисоціює повністю, а за другим – тільки частково:
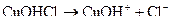 (за першим ступенем),
(за першим ступенем),
 (за другим ступенем).
(за другим ступенем).
Приклад 11 Складіть молекулярні рівняння можливих хімічних реакцій, які відбуваються при зливанні розчинів таких речовин: а) калій сульфіду та хлоридної кислоти; б) аргентум нітрату та калій ортофосфату; в) купрум(ІІ) гідроксиду та нітратної кислоти; г) натрій гідрогенкарбонату та сульфатної кислоти; д) барій гідроксиду та натрій гідроксиду.
Розв’язання.При виконанні подібних завдань дотримуються такого алгоритму:
1 Уявно прогнозують можливі продукти реакції обміну, аналізують їх з урахуванням умов перебігу реакцій йонного обміну до кінця (випадіння осаду, утворення слабкого електроліту, утворення леткої сполуки) і роблять висновок про можливість або неможливість перебігу хімічної реакції.
2 Якщо перебіг реакції можливий, складають її рівняння в молекулярному вигляді.
3 Потім складають рівняння реакції в повному йонному вигляді (формули неелектролітів та слабких електролітів записують у молекулярному вигляді, а формули сильних електролітів – у йонному), встановлюють «йони-спостерігачі» – ті, що не брали участі у реакції.
4 Записують скорочене йонне рівняння реакції, в якому наводять формули лише тих йонів і речовин, які взаємодіють.
а) 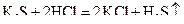 (молекулярне рівняння),
(молекулярне рівняння),

(повне йонне рівняння),
 (скорочене йонне рівняння);
(скорочене йонне рівняння);
б) 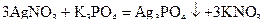 ,
,
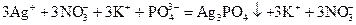 ,
,
 ;
;
в)  ,
,
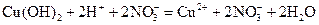 ,
,
 ;
;
г) 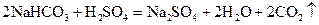 ,
,
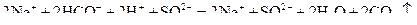
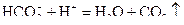 ;
;
д) якщо уявити можливість перебігу реакції між сильними електролітами 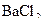 і
і 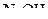 , то можна очікувати утворення продуктів
, то можна очікувати утворення продуктів 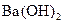 і
і 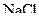 , які теж є сильними електролітами, завдяки чому перебувають в розчинах у вигляді йонів. Оскільки не виконується умова необоротності процесу, тобто не утворюються нерозчинні, леткі чи малодисоційовані сполуки, перебіг реакції між
, які теж є сильними електролітами, завдяки чому перебувають в розчинах у вигляді йонів. Оскільки не виконується умова необоротності процесу, тобто не утворюються нерозчинні, леткі чи малодисоційовані сполуки, перебіг реакції між 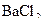 і
і 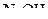 неможливий.
неможливий.
Приклад 12Складіть молекулярні рівняння хімічних реакцій за наведеними скороченими йонними:
а) 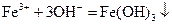 ;
;
б) 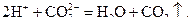
Розв’язання.При виконанні завдань такого типу необхідно спочатку проаналізувати схему реакції, а потім на підставі таблиці розчинності (додаток Д) та відомостей про сильні та слабкі електроліти запропонувати формули реагентів внаслідок дисоціації яких у розчині утворюються наведені йони.
а) очевидно, що катіони 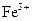 утворюються під час дисоціації розчинних солей Феруму (III), а гідроксид-іони – при дисоціації лугів. Тому наведеному йонному рівнянню реакції може відповідати таке молекулярне:
утворюються під час дисоціації розчинних солей Феруму (III), а гідроксид-іони – при дисоціації лугів. Тому наведеному йонному рівнянню реакції може відповідати таке молекулярне:
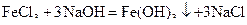 ;
;
б) можна зробити висновок, що катіони Н+ утворюються під час дисоціації розчинних сильних кислот, а карбонат-іони – при дисоціації розчинних карбонатів. Отже, наведеному йонному рівнянню реакції може відповідати таке молекулярне:
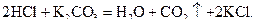
Приклад 13 Визначте 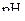 в
в  розчині
розчині 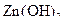 . Відомо, що
. Відомо, що 
Розв’язання. Оскільки 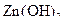 є слабким електролітом, то значенням константи дисоціації за другим ступенем можна знехтувати. За законом розбавлення Оствальда розраховуємо ступінь дисоціації
є слабким електролітом, то значенням константи дисоціації за другим ступенем можна знехтувати. За законом розбавлення Оствальда розраховуємо ступінь дисоціації 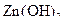 :
:
 .
.
Розраховуємо концентрацію гідроксид-іонів:
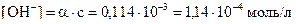 ;
; 

Приклад 14Складіть рівняння гідролізу в йонному та молекулярному вигляді, зазначте реакцію середовища у розчинах таких солей: а)  б)
б)  в)
в) 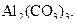
Розв’язання: а) 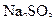 – сіль, утворена катіоном сильної основи
– сіль, утворена катіоном сильної основи 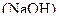 та аніоном слабкої кислоти
та аніоном слабкої кислоти 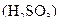 , гідроліз відбувається по аніону за першим ступенем. Унаслідок цього утворюється слабка кислота
, гідроліз відбувається по аніону за першим ступенем. Унаслідок цього утворюється слабка кислота 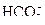 і накопичуються йони
і накопичуються йони  , тому реакція середовища лужна,
, тому реакція середовища лужна,  :
:
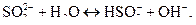

б)  – сіль, утворена катіоном слабкої основи
– сіль, утворена катіоном слабкої основи 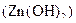 та аніоном сильної кислоти
та аніоном сильної кислоти  , гідроліз відбувається по катіону за першим ступенем. Унаслідок цього утворюється слабка основа
, гідроліз відбувається по катіону за першим ступенем. Унаслідок цього утворюється слабка основа  і накопичуються йони
і накопичуються йони  , тому реакція середовища кисла,
, тому реакція середовища кисла, 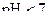 :
:
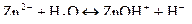
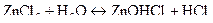
в) 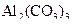 – сіль, утворена катіоном слабкої основи
– сіль, утворена катіоном слабкої основи 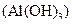 та аніоном слабкої кислоти
та аніоном слабкої кислоти 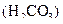 , тому гідролізується одночасно як за катіоном, так і за аніоном. Завдяки зв’язуванню йонів
, тому гідролізується одночасно як за катіоном, так і за аніоном. Завдяки зв’язуванню йонів  і
і  у недисоційовані сполуки (осад і газ) гідроліз солі
у недисоційовані сполуки (осад і газ) гідроліз солі 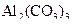 проходить необоротно. Реакція середовища нейтральна,
проходить необоротно. Реакція середовища нейтральна, 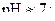
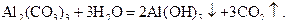
Приклад 15 Чи утвориться осад барій хромату при зливанні 0,02 M розчину 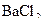 та 0,01 M розчину
та 0,01 M розчину  однакового об`єму? Добуток розчинності
однакового об`єму? Добуток розчинності  дорівнює
дорівнює 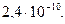
Розв’язання. Осад випадає за умови, що добуток концентрацій йонів перевищує їх добуток розчинності: 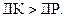
1 Складаємо рівняння реакцій дисоціації реагентів і визначаємо концентрації катіонів Барію та дихромат-іонів у вихідних розчинах.
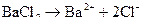 ;
;
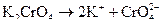 .
.
З рівняння дисоціації 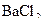 видно, що початкова концентрація катіонів Барію у вихідному розчині дорівнює концентрації барій хлориду:
видно, що початкова концентрація катіонів Барію у вихідному розчині дорівнює концентрації барій хлориду:

У свою чергу, з рівняння дисоціації  випливає, що початкова концентрація дихромат-іонів у вихідному розчині дорівнює концентрації калій дихромату:
випливає, що початкова концентрація дихромат-іонів у вихідному розчині дорівнює концентрації калій дихромату:
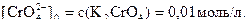
2 При зливанні вихідних розчинів однакового об’єму концентрація йонів зменшується вдвічі і набуває значень:
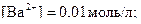
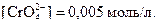
3 Знаходимо добуток концентрацій 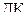 катіонів Барію та дихромат-іонів, враховуючи, що
катіонів Барію та дихромат-іонів, враховуючи, що
 ,
,

4 Порівнюємо значення добутку концентрацій 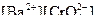 з довідковим значенням добутку розчинності
з довідковим значенням добутку розчинності 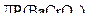 . Встановлюємо, що
. Встановлюємо, що
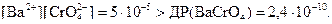
Порівняння згаданих величин доводить, що при зливанні названих розчинів осад випадає.
Завдання для самоперевірки
Дата добавления: 2019-02-13; просмотров: 125; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
