Гидрид натрия газ водород
Quot; F M ЕГЭ"
Гидролиз веществ.
Это обратимое или необратимое разложение веществ водой.
Гидролиз средних солей.
Физический смысл этого процесса в том, что соль, образованная 1 или 2-мя слабыми электролитами ( катионами или анионами) способна смещать естественную обратимую реакцию диссоциации воды:
Н2О « Н++ОН- , связывая ионы Н+ или ОН-. Таким образом, среда будет не нейтральная (концентрация протонов = концентрации гидроксид-анионов), в ней будут преобладать либо протоны ( среда кислая), либо гидроксид-анионы (среда щелочная).
Рассмотрим 4 варианта гидролиза средних солей, представив их как продукт реакции нейтрализации кислоты и основания . (Для работы над этой темой тебе пригодится шпаргалка "сильные и слабые электролиты").
Соль слабого основания и сильной кислоты.
Слабый катион "тяготится быть голым". Он связывает гидроксид-анионы Þидет гидролиз по катионуÞ в растворе остаются протоны Þ среда кислаяÞ рН<7Þ определенная окраска индикаторов.
1) CuSO4(сульфат меди(II)). Эту соль представим полученной из слабого основания Cu(OH)2 и сильной кислоты H2SO4.
Запишем диссоциацию соли:
CuSO4®Cu2++SO42- Идет гидролиз по катиону:
Cu2+ +НОН «CuOH++H+
В растворе избыток протонов Þ среда кислая. Индикаторы имеют окраску: лакмус – красный, метилоранж – розовый, фенолфталеин – бесцветный.
Запишем полное уравнение гидролиза:
2CuSO4+2НОН=(CuOH)2SO4+ H2SO4
|
|
|
Продукты – основная соль сульфат гидроксомеди (II) и серная кислота.
2) NiCl2(хлорид никеля). Эту соль представим полученной из слабого основания Ni(OH)2 и сильной кислоты HCl.
Запишем диссоциацию соли:
NICl2®Ni2++2Cl- Идет гидролиз по катиону:
Ni2+ +НОН «NiОН++H+
В растворе избыток протонов Þ среда кислая. Индикаторы имеют окраску: лакмус – красный, метилоранж – розовый, фенолфталеин – бесцветный.
Запишем полное уравнение гидролиза:
NiCl2+НОН=NiOHCl+ HCl
Продукты – основная соль хлорид гидроксоникеля и соляная кислота.
3)Al(NO3)3(нитрат алюминия). Эту соль представим полученной из слабого основания Al(OH)3 и сильной кислоты HNO3.
Запишем диссоциацию соли:
Al(NO3)3®Al3++3NO3- Идет гидролиз по катиону:
Al3+ +НОН «AlOH2++H+
В растворе избыток протонов Þ среда кислая. Индикаторы имеют окраску: лакмус – красный, метилоранж – розовый, фенолфталеин – бесцветный.
Запишем полное уравнение гидролиза:
Al(NO3)3+НОН=AlOH(NO3)2+ HNO3
Продукты – основная соль нитрат гидроксоалюминия и азотная кислота.
Соль сильного основания и слабой кислоты.
Слабый анион "тяготится быть голым". Он связывает протоны Þидет гидролиз по анионуÞ в растворе остаются гидроксид-анионы Þ среда щелочнаяÞ рН>7Þ определенная окраска индикаторов.
|
|
|
1)Na2SO3(сульфит натрия). Эту соль представим полученной из сильного основания NaOH и слабой кислоты H2SO3.
Запишем диссоциацию соли:
Na2SO3®2Na++SO32- Идет гидролиз по аниону:
SO32- +НОН «HSO3-+OH-
В растворе избыток гидроксид-анионов Þ среда щелочная. Индикаторы имеют окраску: лакмус – синий, метилоранж – желтый, фенолфталеин – малиновый.
Запишем полное уравнение гидролиза:
Na2SO3+НОН=NaHSO3+ NaOH
Продукты – кислая соль гидросульфит натрия и гидроксид натрия.
2)К2СO3(карбонат калия). Эту соль представим полученной из сильного основания КOH и слабой кислоты H2СO3.
Запишем диссоциацию соли:
К2СO3®2К++СO32- Идет гидролиз по аниону:
СO32- +НОН «HСO3-+OH-
В растворе избыток гидроксид-анионов Þ среда щелочная. Индикаторы имеют окраску: лакмус – синий, метилоранж – желтый, фенолфталеин – малиновый.
Запишем полное уравнение гидролиза:
К2СO3+НОН=КHСO3+ КOH
Продукты – кислая соль гидрокарбонат калия и гидроксид калия.
Соль сильного основания и слабой кислоты.
Соль, образованная такими кислотой и основанием, вообще не гидролизуется. Окраска индикаторов такая же, как в нейтральной среде: лакмус – фиолетовый, метилоранж – оранжевый, фенолфталеин – бесцветный.
Примеры таких солей: NaCl , KNO 3 , Li 2 SO 4.
|
|
|
Соль слабого основания и слабой кислоты.
Эти соли имеют "слабый" и катион, и анионÞ идет полный необратимый гидролиз и по катиону, и по аниону . Продукты – основание и кислота ( летучее водородное соединение в случае соли слабой бескислородной кислоты).
1)Al2S3(сульфид алюминия). Эту соль представим полученной из слабого основания Al(OH)3 и слабой кислоты H2S.
Запишем диссоциацию соли:
Al2S3®2Al3++3S2- Идет гидролиз по катиону и аниону:
Al2S3+6Н2О=2Al(OH)3¯+3H2S
В растворе нет избытка протонов или гидроксид-анионов Þ среда нейтральная. Индикаторы имеют окраску: лакмус – фиолетовый, метилоранж – оранжевый, фенолфталеин – бесцветный.
2)Fe2(SO3)3(сульфит железа(III)). Эту соль представим полученной из слабого основания Fe(OH)3 и слабой кислоты H2SO3.
Запишем диссоциацию соли:
Fe2(SO3)3®2Fe3++3SO32- Идет гидролиз по катиону и аниону:
Fe2(SO3)3+6Н2О=2Fe(OH)3¯+3SO2+3H2O
В растворе нет избытка протонов или гидроксид-анионов Þ среда нейтральная. Индикаторы имеют окраску: лакмус – фиолетовый, метилоранж – оранжевый, фенолфталеин – бесцветный.
В таблице растворимости такие соли представлены прочерком Þ они разлагаются водой (полностью гидролизуются).
Гидролиз других неорганических веществ.
|
|
|
Гидролиз соединений металлов и неметаллов главных подгрупп IV и V групп.
Особенно важные среди этих реакций – гидролиз карбида алюминия и карбида кальция, так как это лабораторный способ получения углеводородов.
Гидролиз прочих веществ – способ получения летучих водородных соединений неметаллов, которых нельзя получить прямым синтезом из простых веществ.
1) Al4C3 +12H2O = 4Al(OH)3+3CH4
карбид алюминия метан
2) CaC2+2H2O = Ca(OH)2+C2H2
карбид кальция ацетилен
3) К3Р+3 H 2 O = 3К OH +Р H 3
фосфид калия фосфин
4) Mg2Si+2H2O = 2Mg(OH)2+SiH4
силицид магния силан
5) Mg3As2+6H2O = 3Mg(OH)2+2AsH3
арсенид магния арсин
Гидролиз соединений металлов и водорода (гидридов).
Гидриды металлов – белые кристаллические вещества с ионной связью. Они легко гидролизуются с образованием основания и водорода ( это один из лабораторных способов его получения).
NaH + H2O = NaOH+H2
гидрид натрия газ водород
Гидролиз соединений галогенидов неметаллов.
Рассмотрим в качестве примера гидролиз хлоридов фосфора. Продуктами этой не окислительно-восстановительной реакции будут хлороводород и соответствующая кислородсодержащая кислота фосфора.
1) PCl 3 + 3 H 2 O = H 3 PO 3 + 3 HCl
хлорид фосфора (III) фосфористая кислота
2) PCl 5 + 4 H 2 O = H 3 PO 4 + 5 HCl
хлорид фосфора (V) фосфорная кислота
Особый случай: гидролиз солей висмута и сурьмы.
Особенность солей этих элементов вот в чем. Сурьма (Sb) и висмут (Bi) – элементы главной подгруппы V группы, они в низшей степени окисления (+3) имеют соответствующие слабые плохо растворимые основания – Sb ( OH )3 и Bi ( OH )3.Þ При гидролизе таких солей пойдет гидролиз по катиону (Þ среда будет кислая и продукты – основная соль и кислота). Сначала "все как обычно":
SbCl3 +2H2O=Sb(OH)2Cl+2HCl
хлорид сурьмы(III) хлорид дигидроксосурьмы (III)
Но образующаяся основная соль Sb ( OH )2 Cl неустойчива и разлагается с отщеплением молекулы воды:
Sb ( OH )2 Cl = SbO Cl ¯ +H2O
хлорид антимонила
Аналогичное соединение (среднее между оксидом и солью) образуется при гидролизе солей трехвалентного висмута:
Bi(NO3)3+H2O = BiONO3+2HNO3
нитрат висмута(III) нитрат висмутила
Гидролиз органических веществ.
Гидролиз сложных эфиров.
Здесь надо помнить следующее: в случае водного гидролиза этот процесс обратимый и сместить равновесие в строну гидролиза можно (по принципу Ле Шателье) , удаляя продукты (спирт или кислоту ) из сферы реакции (¯ их концентрацию).

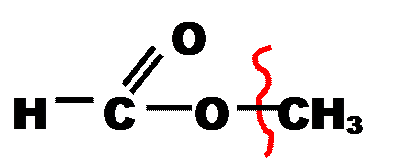
 1)
1)

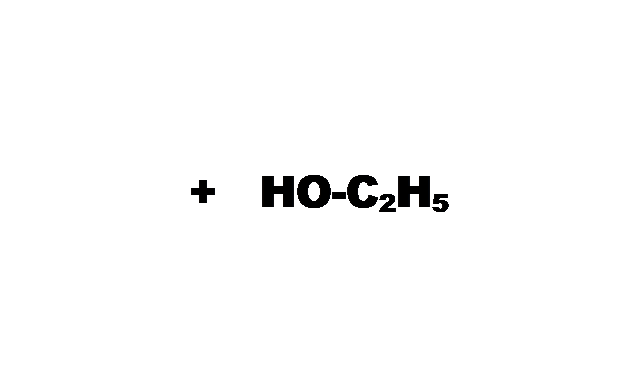 |
этиловый эфир уксусной кислоты
(Этилацетат)

уксусная кислота этанол


 2)
2)
метиловый эфир муравьиной кислоты
(метилформиат)
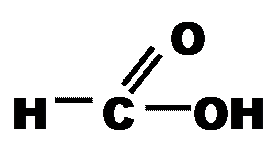 +
+ 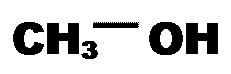
Муравьиная (метановая) кислота Метанол
3)
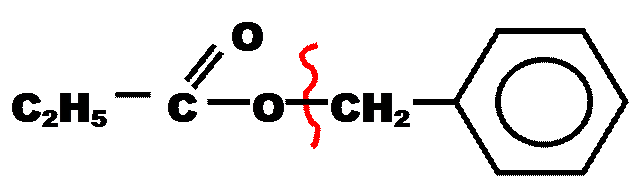
«
бензиловый эфир пропановой кислоты
(бензилпропионат)

+
 пропановая (пропионовая) кислота
пропановая (пропионовая) кислота
бензиловый спирт
Щелочной гидролиз сложных эфиров.
Этот процесс отличается от предыдущего тем, что продуктами будут соль карбоновой кислоты и спирт. Так как продукт гидролиза –кислота - будет химически связываться, гидролиз будет необратимым.

этиловый эфир бензойной кислоты
(этилбензоат)
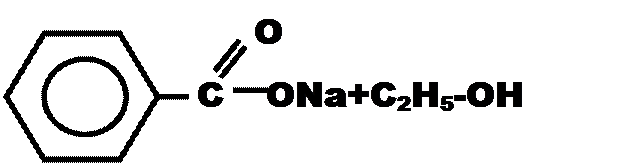
бензоат натрия этанол
Гидролиз жиров.
Надо помнить, что жиры – это природные эфиры трехатомного спирта глицерина и ВЖК (высших жирных кислот). Продуктами обратимого водного гидролиза будут ВЖК (если жир твердый, то ВЖК предельные, а если жир жидкий, то ВЖК непредельные) и глицерин.
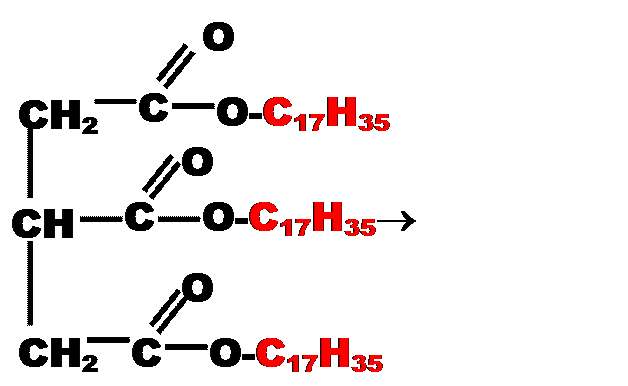
тристеарат (твердый жир)


глицерин стеариновая кислота

триолеат (жидкий жир)
 | |||
 | |||
глицерин олеиновая кислота
Щелочной гидролиз жиров( омыление).
Продуктами необратимого омыления будут соли ВЖК ( натриевые – твердое мыло, а калиевые – жидкое мыло, сами ВЖК – предельные). Получается также глицерин. Этот процесс имеет важное промышленное значение.
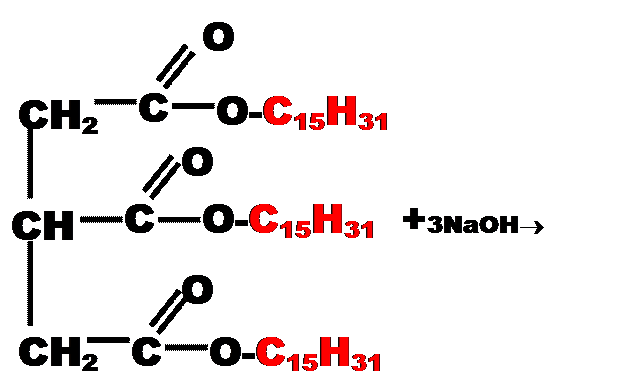
трипальмитат(твердый жир)


глицерин пальмитат натрия (мыло)
Гидролиз солей карбоновых кислот.
Карбоновые кислоты (кроме их галогенпроизводных) – слабые электролиты Þ будет идти гидролиз по аниону Þ среда в растворе будет щелочная Þ соответствующая окраска индикаторов (см. выше):
1)CH3-COONa + H2O =CH3-COOH+NaOH
ацетат натрия (этаноат натрия) этановая (уксусная) кислота
2)H-COO К + H2O =H-COOH+ К OH
Дата добавления: 2019-02-12; просмотров: 514; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
