Применение аффинной хроматографии для выделения ферментов
Министерство образования и науки Российской Федерации
ФГАОУ ВО «УрФУ имени первого Президента России Б.Н. Ельцина»
Химико-технологический институт
Кафедра «Технологии органического синтеза»
Реферат
на тему: «Применение аффинной хроматографии для выделения ферментов».
Студент
группы Х-350007 Т. Е. Краснопольская
Преподаватель
Доцент, к.х.н. В. С. Берсенева
Екатеринбург
2018
Оглавление
Введение. 3
1. Основные понятия. 4
1.1 Хроматография. 4
1.2 Ферменты.. 5
2. Применение аффинной хроматографии для выделения ферментов. 7
2.1. История метода. 7
2.2. Суть метода. 8
2.3. Аппаратура. 10
2.4. Сорбенты, используемые в аффинной хроматографии. 10
Заключение. 11
Список используемой литературы.. 12
Введение
Производство ферментных препаратов занимает одно из ведущих мест в современной биотехнологии. Постоянно увеличивается объем их выпуска и расширяется сфера применения. Ферменты являются высокоактивными нетоксичными биокатализаторами белкового происхождения. Их преимуществом перед химическими катализаторами является действие при нормальном давлении, температуре от 20 до 70 ºС, рН от 4 до 9. Все более широкое применение для выделения и очистки ферментов находит аффинная хроматография, которая открывает новые пути для совершенствования биохимической и химической технологии и создания новых методов биохимического анализа.
|
|
|
1. Основные понятия
Хроматография
Хроматография – физико-химический метод разделения и анализа смесей, основанный на распределении их компонентов между двумя фазами - неподвижной и подвижной, протекающей через неподвижную.
Принципиальным отличием хроматографических методов от других физико-химических методов анализа является возможность разделения близких по свойствам веществ. После разделения компоненты анализируемой смеси можно идентифицировать (установить природу) и количественно определять (массу, концентрацию) любыми химическими, физическими и физико-химическими методами.
Хроматографический метод анализа был впервые применён русским учёным-ботаником Михаилом Семеновичем Цветом в 1900 году. Он использовал колонку, заполненную карбонатом кальция для разделения пигментов растительного происхождения.
Хроматография широко применяется в лабораториях и в промышленности для качественного и количественного анализа многокомпонентных систем, контроля производства, особенно в связи с автоматизацией многих процессов, а также для препаративного (в т. ч. промышленного) выделения индивидуальных веществ (например, благородных металлов), разделения редких и рассеянных элементов.
|
|
|
Основные достоинства хроматографического анализа:
- экспрессность; высокая эффективность; возможность автоматизации и получение объективной информации;
- сочетание с другими физико-химическими методами;
- широкий интервал концентраций соединений;
- возможность изучения физико-химических свойств соединений;
- осуществление проведения качественного и количественного анализа;
- применение для контроля и автоматического регулирования технологических процессов.
В зависимости от природы процесса, обусловливающего распределение сорбатов между подвижной и неподвижной фазами, хроматография классифицируется:
- Адсорбционная хроматография — разделение за счёт адсорбции основано на различии адсорбируемости компонентов смеси на данном адсорбенте;
- Распределительная хроматография — разделение основано на различии в растворимости сорбатов в подвижной и неподвижной фазах или на различии в стабильности образующихся комплексов;
|
|
|
- Ионообменная хроматография — разделение основано на различии констант ионообменного равновесия;
- Осадочная хроматография — разделение основано на различной растворимости осадков в подвижной фазе;
- Аффинная хроматография — основана на биоспецифическом взаимодействии компонентов с аффинным лигандом;
- Эксклюзионная хроматография — разделение основано на различии и проницаемости молекул разделяемых веществ в неподвижную фазу. Компоненты элюируются в порядке уменьшения их молекулярной массы.
Ферменты
Ферменты (энзимы) —сложные молекулы белка, ускоряющие химические реакции в живых системах. Каждый фермент, свернутый в определённую структуру, ускоряет соответствующую химическую реакцию: реагенты в такой реакции называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам: АТФ-аза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу.
По своей функции ферменты являются биологическими катализаторами. Сущность действия ферментов заключается:
|
|
|
• в активации молекул реагирующих веществ,
• в разбиении реакции на несколько стадий, энергетический барьер каждой из которых ниже такового общей реакции.
Однако энергетически невозможные реакции ферменты катализировать не будут, они ускоряют только те реакции, которые могут идти в данных условиях.
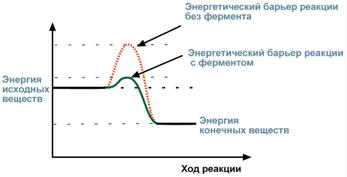
Рис. 1. Величина энергии активации с ферментом и без него.
Давно выяснено, что все ферменты являются белками и обладают всеми свойствами белков. Поэтому подобно белкам ферменты делятся на простые и сложные.
- Простые ферменты состоят только из аминокислот – например, пепсин, трипсин, лизоцим.
- Сложные ферменты имеют в своем составе белковую часть, состоящую из аминокислот – апофермент, и небелковую часть – кофактор. Примером могут быть сукцинатдегидрогеназа (содержит ФАД), аминотрансферазы (содержат пиридоксальфосфат), пероксидаза (содержит гем).
В составе фермента выделяют области, выполняющие различную функцию:
1. Активный центр – комбинация аминокислотных остатков, обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. В активном центре выделяют два участка:
· якорный (контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре,
· каталитический – непосредственно отвечает за осуществление реакции.
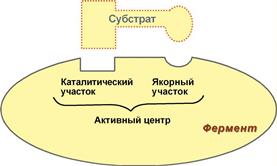
Рис. 2. Схема строения ферментов
У ферментов, имеющих в своем составе несколько мономеров, может быть несколько активных центров по числу субъединиц. Также две и более субъединицы могут формировать один активный центр.
У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора.
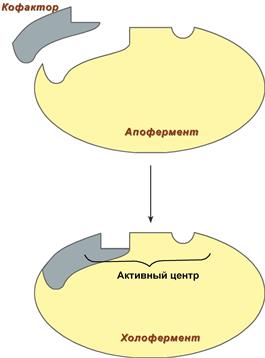
Рис. 3. Схема формирования сложного фермента
2. Аллостерический центр – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы (называемой активатором или ингибитором) вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции.
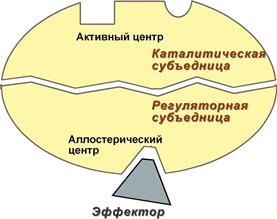
Рис. 4. Схема строения аллостерического фермента
Аллостерические ферменты являются полимерными белками, активный и регуляторный центры находятся в разных субъединицах. В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество.
Применение аффинной хроматографии для выделения ферментов
История метода.
Аффинная хроматография как метод впервые была применена Штаркенштайном в 1910 г. для выделения ά-амилазы с помощью нерастворимого субстрата (крахмала). Кемпбелл и др. были, вероятно, первыми (1951 г.), в чьих работах этот принцип получил практическое приложение для выделения антител на колонке с целлюлозой с ковалентно присоединенным антигеном. Для выделения ферментов аффинная хроматография впервые была применена в 1953 г. Лерманом, который выделил тирозиназу на колонке с целлюлозой, эфирно связанной с остатками резорцина. В последующие годы аффинная хроматография использовалась весьма редко. В 1968 г. Куатреказас в др. успешно применили аффинную хроматографию для выделения нуклеазы, химотрипсина и карбоксипептидазы А и предложили термин «аффинная хроматография». Далее развитие метода шло в основном в направлении его применения для выделения ферментов, их ингибиторов, антител и антигенов, нуклеиновых кислот, белков, гормонов и др. Для разделения изоферментов лактатдегидрогеназы Броделиус и Мосбах использовали сефарозу с присоединенными аналогами AMP; при элюировании растворами с возрастающей концентрацией NADH получены пять пиков изоферментов.
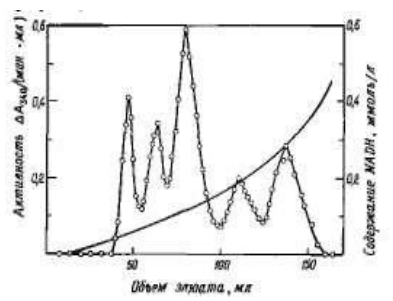
Рис. 5. Элюирование изоферментов лактатдегидрогеназы вогнутым градиентом NADH.
Разделение достигается благодаря различиям в константах диссоциации Кдисс двойного комплекса фермент — NADH. Позднее Броделиус и Мосбах аналогичным образом хроматографировали ряд лактатдегидрогеназ из различных источников, константы которых известны.
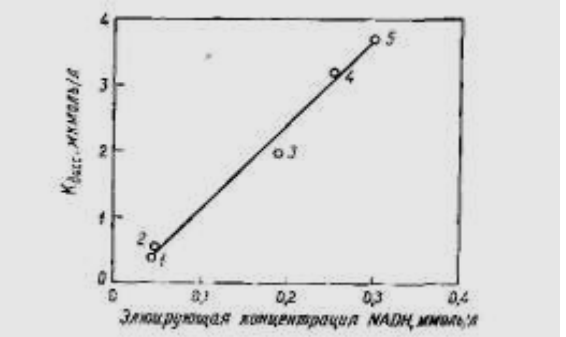
Рис. 6. Зависимость константы диссоциации бинарных комплексов фермент-NADH.
Рис. 6. иллюстрирует прямую пропорциональность Кдисс от элюирующей концентрации NADH. Линейность указывает, что константы диссоциации комплексов фермент-NADH играют более важную роль, чем константы диссоциации комплексов фермента с иммобилизованным аффинным лигандом. Таким образом, появилась возможность определения констант диссоциации двойных комплексов фермента с NADH. He обнаружено различий в величинах Кдисс при использовании как кристаллических, так и неочищенных препаратов ферментов. Это создает огромное преимущество таких определений по сравнению с обычными методами определения констант диссоциации, которые требуют не только чистых ферментов, но также и гомогенных изоферментов. Другим преимуществом является большая быстрота и расход очень небольших количеств фермента для каждого определения. Использование аффинной хроматографии для определения, например, констант ингибирования ферментов весьма перспективно.. Метод аффинной хроматографии открывает новые возможности не только для изучения взаимодействия биологически активных веществ, он перспективен также и для выяснения влияния микроокружения на образование этих комплексов.
Суть метода.
Разделение биологически активных веществ в аффинной хроматографии основано на их специфическом взаимодействии с лигандами, ковалентно связанными с нерастворимым носителем (матрицей). Сорбентом в этом случае служит гель типа агарозы, к которому ковалентно присоединен подходящий лиганд, например субстрат фермента. Когда раствор, содержащий выделяемое вещество (фермент), пропускают через колонку с соответствующим образом приготовленным сорбентом, взаимодействие этого вещества с закрепленным на сорбенте лигандом (т.е. фермента с его субстратом) приводит к его удерживанию и, следовательно, к концентрированию. Поскольку сорбция носит обратный характер, это вещество можно затем элюировать с колонки. Разделение по методу аффинной хроматографии может быть основано на различного рода специфических взаимодействиях, таких как связывание фермента с ингибитором, гормона с рецептором, антигена с антителом, а также гибридизация полинуклеотидов. Этот метод позволяет выделять даже целые клетки.
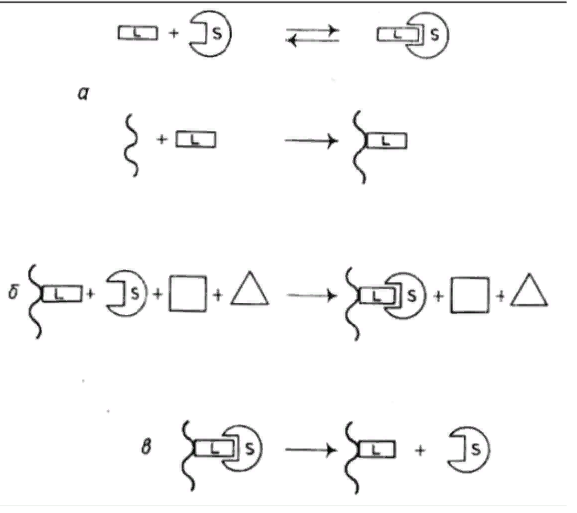
Рис. 7. Механизм разделения веществ в аффинной хроматографии.
а – иммобилизация лиганда; б – связывание целевого вещества и удаления сопутствующих примесей; в – десорбция целевого вещества.
В аффинной хроматографии выделяют две фазы: подвижной фазой (элюентом) служит жидкость, неподвижной фазой может быть твердый сорбент. Главная особенность, которая обусловливает высокую эффективность этого метода, состоит в том, что разделение основано на различии не физико-химических признаков молекулы (заряда, формы и размера), а специфичности функциональных свойств, отличающих данный фермент от множества других биополимеров.
Неподвижная фаза в аффинной хроматографии представляет собой специально получаемый сорбент, построенный обычно по схеме: носитель - соединяющее звено ("ножка") - специфический лиганд. Носителем служит чаще всего сефароза - производное агарозы, имеющее поперечные сшивки. Присоединение к ней лиганда или "ножки", содержащих, как правило, аминогруппу, осуществляется после активации сефарозы бромцианом.
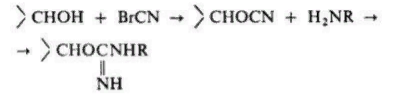
Сефароза, однако, малоустойчива к действию ряда химических веществ и микроорганизмов.
Основные требования к аффинной адсорбции:
1. Лиганд должен быть присоединен к матрице таким образом, чтобы при связывании его с белком не возникало серьезных затруднений.
2. Удлиняющий мостик между матрицей и лигандом должен облегчать доступ белка к лиганду.
3. Неспецифическое взаимодействие не должно быть слишком сильным, чтобы сопутствующие белки не могли связаться с адсорбентом.
4. Связь лиганда с матрицей должна быть стабильна в условиях хроматографии и в процессе регенерации адсорбента.
Лигандами могут служить такие субстраты как крахмал или гликоген, однако их превращение в ходе аффинной хроматографии, катализируемое разделяемым ферментом, постоянно изменяет свойства сорбента. Поэтому, как правило, применяют аналоги субстратов, устойчивые к дальнейшему превращению, т.е. ингибиторы ферментов. Так, для выделения протеиназ используют не расщепляемые ими пептиды D-аминокислот. Эффективны также природные ингибиторы ферментов, например, пепстатин - ингибитор аспартильных протеиназ. Иногда применяют лиганды, связывающие большие группы родственных ферментов (в частности, киназы и дегидрогеназы).
Подвижная фаза аффинной хроматографии должна обладать низкой вязкостью, обеспечивать необходимый уровень селективности, быть дешевой, нетоксичной, инертной, совместимой с методами детектирования. Обычно используют углеводороды (гексан, гептан, изооктан, циклогексан) с добавлением небольших количеств СНСl3, изоС3Н7ОН, диизопропилового эфира.
Аппаратура.
Современный жидкостной хроматограф включает емкости для элюентов, насосы высокого давления, дозатор, хроматографическую колонку, детектор, регистрирующий прибор, систему управления и матической обработки результатов. Элюенты подаются в насос через фильтр, задерживающий пылевые частицы; иногда через элюенты пропускают небольшой ток гелия для удаления растворенного воздуха и предотвращения образования пузырьков в детекторе. Для введения пробы в колонку используют специальные микродозирующие краны. Разработаны дозировочные системы с автоматическим отбором и вводом пробы с помощью микродозирующих кранов или шприцов. Колонки изготовляют чаще всего из нержавеющей стальной полированной трубки длиной 10- 25 см и внутренним диаметром 3-5 мм. Для определения выходящих из колонки разделенных компонентов используют детекторы. Регистрацию хроматограмм и обработку данных проводят с помощью самописца или мини-ЭВМ, которая также рассчитывает количественные характеристики и качественный состав смесей. Микропроцессор обеспечивает автоматический ввод пробы, изменение по заданной программе состава элюента при градиентном элюировании, поддержание температуры колонки
Дата добавления: 2019-01-14; просмотров: 2363; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
