Неметаллические защитные покрытия
МЕТОДЫ ЗАЩИТЫ ОТ КОРРОЗИИ
Под технологией защиты от коррозии понимается ряд последовательно выполняемых мероприятий, конечной целью которых является увеличение срока службы металлов и снижение риска возникновения аварийных ситуаций. К таким мероприятиям относятся:
· рациональное проектирование и выбор коррозионно-стойких конструкционных материалов;
· противокоррозионные мероприятия при сборке и монтаже изделий;
· противокоррозионная защита оборудования и металлоконструкций в период эксплуатации;
· постоянный или периодический контроль состояния эксплуатируемых объектов и среды.
Для правильного выбора способа защиты необходимо знать механизм коррозионного процесса. Электрохимическая коррозия представляет собой ряд последовательных стадий: ионизация металла, перенос освободившихся электронов по металлу, восстановление деполяризатора и перенос заряженных ионов в коррозионной среде. Повышая сопротивление любого из перечисленных процессов, можно добиться уменьшения скорости коррозии и предотвращения разрушения металла.
Современная защита металлов от коррозии базируется на следующих методах:
Повышение химического сопротивления конструкционных материалов,
Изоляция поверхности металла от агрессивной среды,
Понижение агрессивности производственной среды,
Снижение коррозии наложением внешнего тока (электрохимическая защита)
|
|
|
Эти методы можно разделить на две группы (!!!).
Первые два метода обычно реализуются до начала производственной эксплуатации металлоизделия (выбор конструкционных материалов и их сочетаний еще на стадии проектирования и изготовления изделия, нанесения на него гальванических и иных защитных покрытий).
Последние два метода, напротив, могут быть осуществлены только в ходе эксплуатации металлоизделия (пропускание тока для достижения защитного потенциала, введение в технологическую среду специальных добавок-ингибиторов) и не связаны с какой-либо предварительной обработкой до начала использования.
При применении первых двух методов не могут быть изменены состав сталей и природа защитных покрытий данного металлоизделия при непрерывной его работе в условиях меняющейся агрессивности среды. Вторая группа методов позволяет при необходимости создавать новые режимы защиты, обеспечивающие наименьшую коррозию изделия при изменении условий их эксплуатации. Например, на разных участках трубопровода в зависимости от агрессивности почвы можно поддерживать различные плотности катодного тока или для разных сортов нефти, прокачиваемой через трубы данного состава, использовать разные ингибиторы.
|
|
|
Основные принципы электрохимической защиты
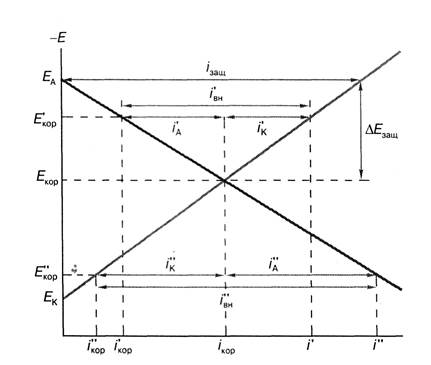
Электрохимическая защита основана на том, что, сдвигая потенциал металла пропусканием внешнего тока, можно изменять скорость его коррозии(!!!). Принцип этого вида защиты иллюстрирует диаграмма.
Проекция точки пересечения кривой ионизации с катодной кривой восстановления деполяризатора на ось абсцисс дает ток коррозии i кор при отсутствии какого-либо внешнего воздействия на эту коррозионную систему, а проекция указанной точки на ось ординат – величину установившегося в этих условиях потенциала коррозии Екор .. При пропускании через корродирующий металл внешнего катодного тока потенциал его сдвигается в отрицательную сторону и принимает новое значение Е’корр. Скорость коррозии металла, определяемая соответствующим током на прямой ионизации металла при этом новом значении потенциала, равна i ’кор.
Катодная защита
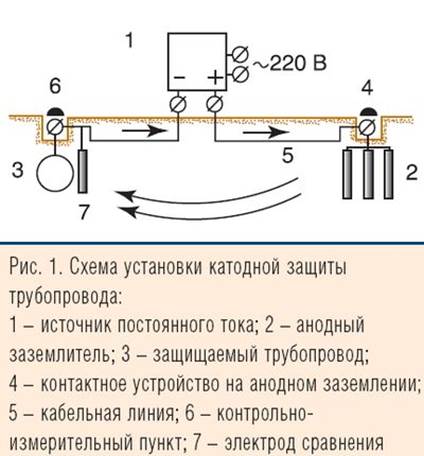
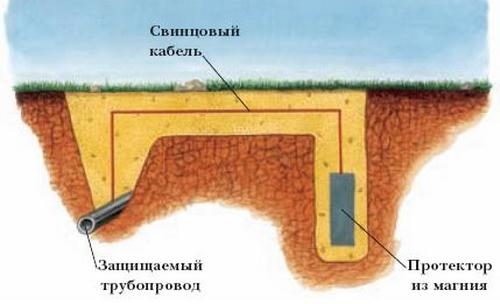
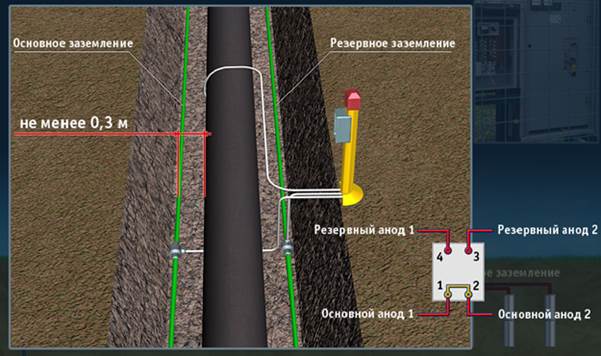
Электрохимическая защита, основанная на наложении катодного тока, носит название катодной. Она реализуется в производственных условиях в двух вариантах. В первом необходимый сдвиг потенциала обеспечивается подключением защищаемого изделия в качестве катода к внешнему источнику тока. В качестве анода используются вспомогательные инертные электроды. Так защищают буровые платформы, сварные металлические основания, подземные трубопроводы. Катодная защита эффективно используется для подавления не только общей коррозии, но и ее различных видов, например для предотвращения питтинговой коррозии нержавеющей стали и алюминия, коррозионного растрескивания под напряжением латуней, магния, межкристаллитной коррозии нержавеющей стали. Другой вариант этого вида защиты - протекторная или гальваническая защита. В этом случае катодная поляризация металлоизделия достигается за счет контакта его с более электроотрицательным металлом. Последний в паре с защищенным металлом выступает в роли анода. Его электрохимическое растворениe обеспечивает протекание катодного тока через защищаемый металл. Сам же анод (обычно это магний, цинк, алюминий и их сплавы) постепенно полностью разрушаются. Этот вид защиты используют для сравнительно небольших конструкций или дополнительно покрытых изоляцией металлообъектов (например, трубопроводы) с низким потреблением тока. Указанная защита эффективна.
|
|
|
|
|
|
Анодная защита
Сдвиг потенциала коррозионной системы в положительную сторону до значения Е’’кор, так же как и в случае наложения катодного тока, приводит к снижению скорости коррозии до величины i ’’кор . Это потребует наложения внешнего анодного тока i ’’вн, часть которого i ’’к пойдет на подавление катодной реакции до величины i ², а другая часть i ²А - на ускорение реакции ионизации металла при Е’’кор . Из рисунка видно, что хотя скорость коррозии и уменьшилась, однако общая скорость растворения металла возросла на величину i ²А. По этим причинам нельзя использовать наложение анодного тока для защиты от коррозии активно растворяющихся металлов (!!!).

Коррозиционная диаграмма пассивирующегося металла при его растворении со скоростью: i - при потенциале Екор без наложения анодного тока и депассиватора, i ’ и i ’’ - при потенциале Е' в условиях наложения анодного тока соответственно при отсутствии и в присутствии депассиватора
Необходимо подчеркнуть, что анодная защита применима для борьбы с коррозией легко пассивирующихся металлов при анодной поляризации ( Fe , Ni , Cr , Mo , Ti , Zr ) и неприменима для таких металлов, как Zn , Cu , Cd , Ag . Очень важно, чтобы в растворе не было веществ-депассиваторов в количествах, способных вывести металл из пассивного состояния, например ионов Cl - , S 2- . Вывод металла из пассивного состояния и дальнейшее его растворение при ранее заданном потенциале анодной защиты Е ² приведут к резкому возрастанию скорости ионизации металла до величины i ² и к быстрому выходу из строя анодно-поляризационного оборудования.
Принцип ингибиторной защиты
Другим важнейшим, широко практикуемым методом защиты от коррозии является введение в агрессивную среду специально подобранных соединений - ингибиторов.
Ингибиторы коррозии – это органические и неорганические вещества, присутствие которых в небольших количествах резко снижает скорость растворения металла и уменьшает его возможные вредные последствия. Метод ингибирования, как правило, отличается высокой экономичностью, легкостью производственного внедрения без изменения ранее принятого технологического режима, обычно не предусматривает для своей реализации специального дополнительного оборудования.
Защита от коррозии с помощью ингибиторов нашла широкое применение во многих отраслях современного промышленного производства и сельского хозяйства: при транспортировании газа и нефти по трубопроводам, для сохранения металлоизделия в межоперационный период, для защиты от коррозии горюче-смазочными веществами, а также в водно-солевых, кислотных, щелочных, водно-органических и органических средах, в пресной, морской воде, при коррозии в атмосферных условиях и почве.
Введение ингибиторов в агрессивную среду вызывает изменение поверхности корродирующего металла, а также влияет на кинетику частных электродных реакций, определяющих процесс его саморастворения. Механизм ингибирующего действия определяется несколькими факторами: природой металла, строением ингибитора, составом агрессивной среды, условиями протекания коррозии (температура и гидродинамическое состояние среды) По механизму действия ингибиторы делятся на адсорбционные и пассивационные.
Ингибитор может тормозить катодную реакцию деполяризации (катодные ингибиторы), анодную (анодные ингибиторы) или обе частные реакции (катодно-анодные ингибиторы). При этом наряду с уменьшением скорости коррозии происходит смещение стационарного потенциала соответственно в сторону отрицательных или положительных значений, что легко показать на коррозионной диаграмме Эванса. В присутствии катодно-анодного ингибитора потенциал практически не изменяется (рис. а – в).
Как правило, в качестве эффективных адсорбционных ингибиторов выступают соединения, имеющие в своем составе гетероатомы N , P , S , O , Si , через которые и осуществляется связь молекул ингибитора с поверхностью металла. К настоящему времени известны десятки тысяч индивидуальных веществ и смесей на их основе как эффективные замедлители коррозии. Они выявлены эмпирическим путем на основе прямых коррозионных испытаний. За последние десятилетия достигнуты значительные успехи в развитии научно обоснованного подбора адсорбционных ингибиторов и понимании механизма их защитного действия. Предложенные теории основываются, в частности, на учете природы металла (переходные или непереходные), заряда металла по отношению к раствору и заряда частиц ингибитора, энергии возбуждения электронов металла и молекул ингибитора, принадлежности металла и ингибитора к классу жестких или мягких кислот и оснований. Эти подходы позволили с достаточной уверенностью утверждать, что наиболее эффективны абсорбционные ингибиторы кислотной коррозии в условиях разного знака заряда металла и частицы ингибитора, при наличии легковозбуждаемых электронов ингибитора, в сочетаниях металл – мягкая кислота с ингибитором – мягким основанием или металл – жесткая кислота с ингибитором – жестким основанием.
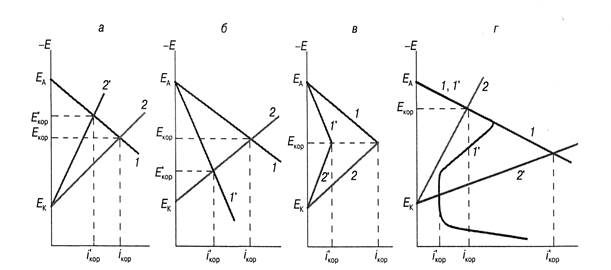
Коррозионные диаграммы, поясняющие защитное действие адсорбционных катодных (а), анодных (б), катодно-анодных (в) и пассивационных (г) ингибиторов: 1,1'- кривые ионизации металла и 2, 2' - восстановления деполяризатора для сред при отсутствии (1, 2) и в присутствии (1', 2') ингибитора
Первичные ингибиторы сами защищают металл и не меняют свою формулу при адсорбции. В случае вторичных ингибиторов на поверхности корродирующего металла присутствуют продукты превращения начального соединения и именно они ответственны за адсорбцию и ингибирование.
Металлические покрытия
Нанесение защитных покрытий – один из самых распространенных методов борьбы с коррозией. Эти покрытия не только защищают от коррозии, но и придают их поверхности ряд физико-химических свойств: твёрдость, износоустойчивость, электропроводность, паяемость, отражательную способность, обеспечивают изделия декоративную отделку и т.д.
По способу защитного действия металлические покрытия делятся на катодные и анодные (!!!).
Катодные покрытия имеют более положительные, а анодные более электроотрицательный потенциалы по сравнению с потенциалов металла, на который они нанесены. Так, например, медь, никель, серебро, золото, осажденные на сталь, являются катодными покрытиями, а цинк и кадмий по отношению к этой же стали – анодными покрытиями.
Необходимо отметить, что вид покрытия зависит не только от природы металлов, но и состава коррозионной среды.
В обычных условиях катодные покрытия защищают металл изделия механически, изолируя его от окружающей среды. Основное требование к катодным покрытиям – беспористость (!!!). В противном случае при погружении изделия в электролит или при конденсации на его поверхности тонкой плёнки влаги обнаженные (в порах или трещинах) участки основного металла становятся анодами, а поверхность покрытия катодом. В местах несплошностей начнется коррозия основного металла, которая может распространяться под покрытие.
Анодные покрытия защищают металл изделия не только механически, но главным образом электрохимически (!!!). В образовавшемся гальваническом элементе металл покрытия становится анодом и подвергается коррозии, а обнаженные (в порах) участки основного металла выполняют роль катода и не разрушаются, пока сохраняется электрический контакт покрытия с защищаемым металлом и через систему проходит достаточный ток. Поэтому степень пористости анодных покрытий в отличие от катодных не играет существенной роли.
Основной способ нанесения защитных металлических покрытий – гальванический. Применяют также термодиффузионный и механотермический методы, металлизацию напылением и напылением в расплав.
Для нанесения металлических защитных покрытий надо выбирать металлы, оксидный слой на поверхности которых делает их пассивными (А1, Zn, Sn, Cr, Pb, Ni), или металлы, пассивные по своим химическим свойствам (Au, Ag, Сu). Кроме того, надо учитывать условия эксплуатации изделия. Методы нанесения металлических защитных слоев на поверхность металлов весьма разнообразны и их можно, разделить условно на «горячие» или высокотемпературные и электрохимические. Покрывающий слой наносят различными методами:· горячее покрытие – кратковременное погружение в ванну с расплавленным металлом; · гальваническое покрытие – электроосаждение из водных растворов электролитов; · металлизация напылением; · диффузионное покрытие – обработка порошками при повышенной температуре в специальном барабане; · плакирование.
Неметаллические защитные покрытия
Органические покрытия
Нанесение на металл органического изолирующего покрытия – наиболее традиционный, а по масштабу применения наиболее широко используемый метод защиты от коррозии. Существует весьма широкий ассортимент изолирующих материалов этого типа, мировое производство которых составляет сотни миллионов тонн.
К этому типу относятся лакокрасочные и пластмассовые покрытия, а также покрытия, составленные на основе каменноугольных пеков и битумов. Как правило, лакокрасочные покрытия не используются для защиты подземных конструкций или трубопроводов. В этом случае более надёжной и эффективной оказывается защита при помощи толстых покрытий из каменноугольного пека и битумов в сочетании с катодной защитой. В последние годы широкое применение находят полиэтиленовые или эпоксидные покрытия. Лакокрасочные покрытия используются обычно для защиты от атмосферной коррозии.
Лакокрасочные материалы представляют собой очень тонкую смесь пигмента и жидкого лака, которые после нанесения на поверхность формируются в твёрдое однородное покрытие.
Дата добавления: 2019-01-14; просмотров: 1062; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
