Объясните, как изменяется восстановительная активность в ряду: HF – HCl – HBr – HI?
Практические задания для экзамена
По дисциплине «Избранные главы по химии элементов»
1 C позиции строения вещества пояснить, в чем различие различие в устойчивости комплексов [Ag(NH3)2]+и [Ag(CN)2]–?
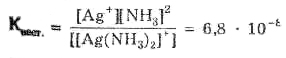
Кнест=[Ag+][CN-]2/[Ag(CN)2-] = 8×10-23
2 Как и почему изменяются: а) восстановительные свойства ионов в ряду Ge2+, Sn2+,Pb2+; б) окислительные свойства в ряду Ge4+, Sn4+, Pb4+? Укажите наиболее слабый восстановитель и наиболее сильный окислитель.
Как осуществить превращения:
а) PbO2 ⇄ Pb2+
б) SnO2 ⇄ [Sn(OH)6]2–
А) ослабевают Pb2+ самый слабый восстановитель
Б) усиливаются Pb4+ самый сильный окислитель
SnO2+2NaOH+2H2O = Na2[Sn(OH)6]
3 В какой среде цинк является более сильным восстановителем (вывод сделайте на основании значений стандартных потенциалов окислительно-восстановительных систем). Как из металлического цинка можно получить хлорид цинка и хлорид тетраамминцинка (II)? Какая из указанных солей в 1н растворе имеет большую степень гидролиза и почему?
1 щелочная среда; 2 кислая среда; 3 нейтральная
| ZnO22- + 4H+ + 2e = Zn + 2H2O | 0,441 |
| ZnS + 2e = Zn + S2- | -1,405 |
| Zn(OH)2 + 2e = Zn + 2OH- | -1,245 |
В нейтральной среде цинк является более сильным восстановителем.
Zn+Cl2= ZnCl2
ZnCl2 + 4(NH3•H2O)(конц.) = [Zn(NH3)4]Cl2
4 Почему в молекуле фтора образуется только ковалентная связь, а в молекуле хлора возникает донорно-акцепторное взаимодействие? Как это различие влияет на сравнительную величину энергии связи и прочность молекул? Покажите электронную схему возникновения донорно-акцепторного взаимодействия при образовании молекулы.
|
|
|
5 Объясните следующие наблюдения. При действии H2S на растворы, содержащие соответственно ионы [Ag(NH3)2]+ и [Ag(CN)2]–, выпадает черный осадок. Действие KI вызывает выделение желтого осадка только из первого раствора. При добавлении же NaCl образование осадков не происходит. Чем объяснить различие в устойчивости комплексов [Ag(NH3)2]+ и [Ag(CN)2]–?
6 Как ведет себя концентрированная и разбавленная серная кислота по отношению к металлам и неметаллам? Использование какой реакции позволяет получать большее количество водорода:
а) Zn + H2SO4(р) → …
б) Cu + H2SO4(к) →…
7 Чем отличается действие разбавленной и концентрированной серной кислоты на металлы? Ответ мотивируйте уравнениями реакций.
8 Напишите уравнения реакций получения комплексов [Zn(OH)4]2–, [Cd(NH3)2]2+, [Hg(CN)4]2–. Опишите их электронное и пространственное строение. Какой из комплексов является наиболее устойчивым и почему? Что образуется при действии цианида калия на аммиакат кадмия?
9 При добавлении раствора иодида калия в раствор нитрата ртути (II) выпадает оранжевый осадок. При дальнейшем прибавлении раствора иодида калия осадок растворяется и снова получается бесцветный раствор. Если из раствора испарить воду, то выделяются желтоватые кристаллы состава HgI2×2KI. Объясните описанные экспериментальные факты с помощью уравнений реакций.
|
|
|
10 Какие продукты образуются в результате смешивания водных растворов сульфата алюминия и гидрокарбоната натрия?
11 Напишите уравнения реакций, характеризующих следующие превращения: SO2 → Na2SO3 → NaHSO3 → Na2SO3 → Na2SO4
12 Какими кислотно-основными свойствами обладает оксид и гидроксид цинка? Исходя из этого, составьте уравнения реакций и уравняйте их методом ионно-электронного баланса:
а) Zn + NaOH + H2O →
б) Zn + N2H4 + NaOH + H2O →
в) ZnO + SiO2 →
13 Составьте уравнения реакций в водном растворе:
а) KNO2 + H2SO4 + KMnO4 =
б) Mn(NO3)2 + KMnO4 =
Используя табличные значения j° (25 °С), докажите, что данные реакции самопроизвольно протекают в стандартных условиях.
14 Составьте уравнения реакций в водном растворе:
а) KMnO4 + K2SO3 =
б) KMnO4 + H2SO4 + H2O2 =
Используя табличные значения j° (25 °С), докажите, что данные реакции самопроизвольно протекают в стандартных условиях.
15 Охарактеризуйте окислительно-восстановительные свойства оксида марганца (IV). Какие условия необходимы для перевода соединений Mn (IV) в производные Mn (II) и Mn (VI)? Приведите примеры реакций.
|
|
|
16 Сравните значения стандартных электродных потенциалов j° (25 °С) соответствующих полуреакций и установите, будут ли протекать реакции при сливании: 1) подкисленного раствора KMnO4 и раствора Na2SO3; 2) раствора KMnO4 и раствора Na2SO3; 3)сильнощелочного раствора KMnO4 и большого избытка раствора Na2SO3. Какая среда благоприятствует реакциям перехода MnO4– в [Mn(H2O)6]2+, MnO4– в MnO2, MnO4 в MnO42– ? В какой среде – кислой или щелочной – окислительные свойства перманганат – иона проявляются в большей степени?
17 Какие степени окисления наиболее характерны для марганца? Как изменяются кислотно-основные свойства в ряду Mn(OH)2 – Мn(OH)4 – H2MnO4 – HMnO4? В виде каких ионов существуют Mn (II), Mn(VI), Mn(VII) в водных растворах?
18 Сравните электронное строение атомов марганца и хлора. На основе этого объясните различие в их химических свойствах и наличие нескольких степеней окисления обоих элементов.
19 Напишите уравнения гидролиза в ионной и молекулярной формах следующих соединений FeCl3, FeS, Cr(NO3)3. Укажите рН раствора, запишите выражение константы гидролиза.
|
|
|
20 Напишите уравнения гидролиза в ионной и молекулярной формах следующих соединений FeCl2, FeS, Cr2(SO4)3. Укажите рН раствора, запишите выражение константы гидролиза.
21 Напишите уравнения гидролиза в ионной и молекулярной формах следующих соединений CrCl3, FeSO4, Cr2S3. Укажите рН раствора, запишите выражение константы гидролиза.
22 Напишите уравнения реакций взаимодействия цинка, марганца и меди с разбавленной и концентрированной серной кислотой. Определите окислители и восстановители в реакциях.
Объясните, как изменяется восстановительная активность в ряду: HF – HCl – HBr – HI?
Какие элементы относятся к группе галогенов. В чем проявляется сходство и отличие элементов (рассмотреть с точки зрения строения атома). Проанализируйте (графически) и объясните характер изменения энергии ионизации и сродства к электрону в ряду Cl, Br, I, At.
25 Объясните, как и почему изменяются в ряду HClO – HClO2 – HClO3 – HClO4: а) устойчивость; б) окислительно-восстановительные свойства; в) кислотные свойства. Соли какой кислоты называют перхлоратами? Проанализируйте возможность взаимодействия а) перхлорат-иона и перманганат-иона; б) перхлорат-иона и диоксида марганца. Приведите уравнения реакций, если они возможны.
26 Записать уравнения реакций H2SO4 (конц.) с металлами: Pb, Ba и Ag, подобрать коэффициенты методом полуреакций.
27 Запишите качественные уравнения реакций для обнаружения галогенидов в молекулярной и ионно-молекулярной форме. Как и почему различаются по растворимости образуемые соли (ответ обосновать с позиции строения вещества).
28 Дайте сравнительную характеристику свойств, образуемых галогенами простых веществ, указав характер изменения: а) энергии связи в молекулах галогенов; б) окислительно-восстановительных свойств. Назовите причины, вызывающие эти изменения. Чем объяснить наибольшую прочность связи в молекуле хлора?
29 Записать уравнения реакций H2SO4 (конц.) с металлами: Mg, Mn и Cu, подобрать коэффициенты методом полуреакций.
30 Записать уравнения реакций свободной серы с окислителями: HNO3 (конц.), HNO3 (разб.), H2SO4 (конц.), K2Cr2O7 и раствором NaOH.
31 Почему хлор, бром и иод могут проявлять степени окисления -1, +1, +3, +5, +7, а фтор - только –1 (с точки зрения строения атома). Допишите и уравняйте реакции:
а) KCl + HNO3 →…
б) KIO3 + KI + H2SO4 →
32 Записать уравнения реакций сероводорода с HNO3 (конц.), HNO3 (разб.), H2SO4 (конц.) и подобрать коэффициенты методом полуреакций.
33 Какими свойствами обладает водный раствор HCl, представьте основные уравнения реакций.
34 Назовите кислоту по окислительным свойствам, превосходящую серную: H2MoO4, H2WO4, H2SeO4, H2CrO4. Ответ подтвердите справочными данными. Напишите ее графическую формулу. Приведите уравнение реакции взаимодействия этой кислоты с золотом. Какие еще растворители золота вам известны?
35 В каком направлении пойдут реакции, если:
а) к водному раствору сульфита калия добавить бромную воду;
б) к водному раствору сульфита натрия добавить сероводород?
В обоснование ответа используйте справочные данные по величине стандартных электродных потенциалов окислительно-восстановительных систем. Напишите уравнения реакций.
36 Как изменяется устойчивая степень окисления элементов сверху вниз в побочных подгруппах? Составьте электронные и молекулярные уравнения реакций:
а) Cr + HNO3(разб.) ®…
б) W + KNO3(т) + KOH(т) ®…
в) Re + H2SO4(конц.) ® …
г) Mn + HNO3(разб.) ® …
д) Ta + HNO3 + HF ® H2[TaF7] + ...
е) Hf + H2SO4(конц.) ® …
37 На основании стандартных ОВП меди и окислителя охарактеризуйте взаимодействие меди с:
а) водой;
б) водным раствором гидроксида натрия;
в) водным раствором цианида калия;
г) разбавленным и концентрированным растворами серной кислоты;
д) разбавленным и концентрированным растворами азотной кислоты.
Составьте ионно-электронные и молекулярные уравнения реакций.
38 На основании стандартных ОВП цинка и окислителя охарактеризуйте взаимодействие цинка с:
а) водой;
б) водным раствором гидроксида натрия;
в) разбавленным и концентрированным растворами серной кислоты;
г) разбавленным и концентрированным растворами азотной кислоты.
Составьте ионно-электронные и молекулярные уравнения реакций.
39 Каким образом изменяются радиусы ионов Fe3+, Co3+, Ni3+? Приведите электронно-графические схемы ионов. Чем объясняется такое изменение? Как изменяются кислотно-основные свойства гидроксидов, образованных указанными ионами? Ответ подтвердите уравнениями реакций.
40 Каким образом изменяются радиусы ионов Fe2+, Co2+, Ni2+? Приведите электронно-графические схемы ионов. Чем объясняется такое изменение? Как изменяются кислотно-основные свойства гидроксидов, образованных указанными ионами? Ответ подтвердите уравнениями реакций.
41 Сопоставьте в ряду CrO3 - MoO3 - WO3 изменения следующих свойств:
а) термической устойчивости;
б) кислотно-основных свойств;
в) окислительных свойств (проиллюстрируйте двумя примерами уравнений реакции). Объясните наблюдаемые закономерности.
42 Обсудите возможность взаимодействия в растворах между следующими веществами:
а) хлоридом хрома (III) и карбонатом натрия;
б) нитратом хрома (III) и гидроксидом натрия;
в) хроматом калия и алюминием в щелочной среде. Напишите молекулярные уравнения реакций. Для окислительно-восстановительных реакций напишите электронно-ионные уравнения полуреакций, для ионно-обменных – сокращенные ионно-молекулярные уравнения. Если реакции могут приводить к различным веществам укажите, в чем состоит различие в условиях проведения этих процессов.
43 Напишите уравнения реакций следующих превращений. Укажите условия их проведения. Для осуществления каждого превращения используйте минимальное число стадий. Для окислительно-восстановительных процессов в растворах напишите электронно-ионные уравнения полуреакций:
а) Cr ® Cr(NO3)3 ® K2Cr2O7 ® K2CrO4 ® K3[Cr(OH)6] ® Cr2(SO4)3;
б) WO3 ® W ®Na2WO4 ® H2WO4.
44 В результате взаимодействия каких соединений образовались следующие продукты? Напишите уравнения реакций. Для окислительно-восстановительных процессов в растворах напишите электронно-ионные уравнения полуреакций:
а) . . . ® CrCl2 + H2; б) . . . ® Cr(OH)3 + CO2 + NaCl;
в) . . . ® Cr2(SO4)3 + H2O + K2SO4; г) . . . ® K3[Cr(OH)6] + K2[Sn(OH)6] + KCl.
45 Какие кислоты называют хромовой и двухромовой? Как изменяется сила и устойчивость этих кислот? Как называют соли этих кислот. Объясните, в каких реакциях и почему будет наблюдаться изменение окраски раствора с желтой на зеленую и с желтой на оранжевую. Ответ подтвердите уравнениями реакций:
а) K2CrO4 + AgNO3 ®…
б) K2CrO4 + Zn + KOH ® …
в) K2CrO4 + H2SO4 ® …
г) K2CrO4 + (NH4)2S + H2O ®…
46 Как можно получить гидроксид хрома (III)? Какими кислотно-основными свойствами он обладает? Допишите продукты реакций:
а) Cr(OH)3 + H2O2 + KOH ® …
б) Cr(OH)3 + HCl ® …
в) Cr(OH)3 + KOH ® …
г) Cr(OH)3 + H2SO4 ® …
Для окислительно-восстановительных реакций напишите электронно-ионные уравнения полуреакций, для ионно-обменных – сокращенные ионно-моленкулярные уравнения. Назовите продукты реакций.
47 Как изменяются кислотно-основные свойства гидроксидов повышением степени окисления хрома в ряду: Cr(OH)2 - Cr(OH)3 – H2CrO4? Ответ проиллюстрируйте уравнениями реакций.
48 Объясните следующие наблюдения с помощью уравнений реакций. При добавлении к раствору соединений хрома (III) щелочи выделяется серо-зеленый осадок, который действием избытка щелочи переводится в раствор зеленого цвета. Добавление к последнему бромной воды при нагревании приводит к изменению окраски раствора на желтую.
49 Пользуясь значениями стандартных электродных потенциалов систем оцените возможность протекания реакций при:
а) сливании щелочного раствора хрома (VI) и раствора соли серы (IV);
б) пропускании хлора через щелочной раствор соединений хрома (III).
Почему: а) окислительные свойства бихромат-ионов в кислой среде выражены сильнее, чем в щелочной или нейтральной; б) окисление же соединений хрома (III) относительно легко протекает в щелочной среде, а в кислой среде оно проходит под действием наиболее сильных окислителей? Ответ проиллюстрируйте уравнениями реакций и значения ОВП.
50 Известно, что окраска растворов соединений хрома (III) при стоянии на воздухе изменяется. Как? Чем это объясняется? В обоснование ответа приведите значения стандартных электродных потенциалов систем. Какое практическое применение находят соли хрома (III)?
51 Какая из кислот - хромовая, молибденовая или вольфрамовая является наиболее сильной? Ответ мотивируйте. Допишите и уравняйте методом электронного баланса реакции:
а) Cr2(SO4)3 + PbO2 + KOH ® …
б) MoS2 + HNO3 ® …
в) Na2WO4 + FeSO4 + H2SO4 ®…
52 Как относится железо к растворам щелочей и кислот (соляной, серной и азотной)? Напишите соответствующие уравнения реакций, уравняйте их методом ионно-электронного баланса.
Дата добавления: 2019-01-14; просмотров: 743; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
