Способы выражения состава растворов
ДОМАШНЕЕ ЗАДАНИЕ №1
1.«Строение вещества . Закономерности протекания химических процессов. Процессы в растворах»
Строение вещества
В соответствии с приведенным планом охарактеризуйте два предложенных элемента.
| Вариант | Элементы | Вариант | Элементы | Вариант | Элементы |
| 1 | P, V | 11 | Cs, Au | 21 | Nb, As |
| 2 | Mn, Cl | 12 | V, As | 22 | Pb, Zr |
| 3 | В, Sc | 13 | Ti, Ge | 23 | Sc, Ga |
| 4 | Sn, Zr | 14 | Al, Sc | 24 | Se, W |
| 5 | Zn, Sr, | 15 | Nb, Sb | 25 | Na, Cu |
| 6 | Si, Ti | 16 | Cr, Se | 26 | Cs, Ag |
| 7 | K, Cu | 17 | Ca, Cd | 27 | Ge, Hf |
| 8 | Ca, Zn | 18 | Mo, Те | 28 | S, W |
| 9 | Cr, S | 19 | Mn, Br | 29 | Cl, Те |
| 10 | Ba, Zn | 20 | Mo, Se | 30 | Rb, Ag |
План характеристики элемента по порядковому номеру:
1. Установите состав атома: число протонов (заряд ядра), нейтронов, электронов.
2. Запишите электронную формулу атома, укажите внешний электронный уровень и орбиталь, на которую идет последний электрон. Сделайте вывод о типе элемента. Изобразите электронно-структурную формулу валентного уровня.
3. Используя электронную формулу, определите положение элемента в периодической системе Д.И. Менделеева.
4. Определите возможные значения степеней окисления. Укажите наиболее устойчивые степени окисления для данного элемента. Приведите примеры соединений данного элемента в этих степенях окисления.
|
|
|
5. Исходя из электронной формулы определите характер свойств простого вещества (металл/неметалл). Опишите физические свойства простого вещества. Приведите уравнения реакций характеризующие химические свойства простого вещества.
6. Запишите формулы и приведите уравнения реакций, характеризующие химические свойства характеристических соединений: высшего оксида и высшего гидроксида.
7. Сделайте вывод о причинах сходства и различия предложенных элементов.
Химическая связь и строение молекул
С позиций метода валентных связей (МВС) объясните строение предложенных молекул. Укажите тип гибридизации центрального атома, изобразите перекрывание орбиталей, укажите порядки всех связей и их тип, определите, полярна ли данная молекула.
| Вариант | Молекулы | Вариант | Молекулы | ||
| 1 | CH4 | AlBr3 | 16 | COCl2 | PBr3 |
| 2 | C2H4 | POCl3 | 17 | CNCl | PF5 |
| 3 | СН3ОН | NH3 | 18 | HNCO | CSCl2 |
| 4 | CH2F2 | H2O | 19 | NH2CHO | BH3 |
| 5 | COCl2 | GeBr4 | 20 | HOCN | PCl3 |
| 6 | C2H3Cl | BF3 | 21 | HCOOH | H2S |
| 7 | CS2 | NH2OH | 22 | C2H2 | AsF5 |
| 8 | CSCl2 | В2О3 | 23 | HCN | OF2 |
| 9 | CNCl | AsF3 | 24 | CH2Cl2 | NH2Cl |
| 10 | CH2O | PCl5 | 25 | CO2 | SnF4 |
| 11 | CF4 | NSCl | 26 | CHCl3 | COCl2 |
| 12 | HNCO | PF5 | 27 | COS | BBr3 |
| 13 | COS | H2SO4 | 28 | COF2 | BeCl2 |
| 14 | HSCN | AsF5 | 29 | H2CO3 | PH3 |
| 15 | С2Н2 | SnCl4 | 30 | CCl4 | NOCl |
|
|
|
1.3. Окислительно-восстановительные реакции
| Вариант | Методом электронного баланса расставьте коэффициенты в уравнении окислительно-восстановительной реакции |
| 1 | КМnO4 + HCl → Cl2 + MnCl2 + KCl + H2O |
| 2 | МnO2 + НСl → Сl2 + MnCl2 + Н2O |
| 3 | KMnO4 + KNO2 + H2SO4 → MnSO4 + KNO3 + K2SO4 + H2O |
| 4 | Au + HNO3 + НСl → H[AuCl4] + NO + H2O |
| 5 | Si + HNO3 + HF → H2[SiF6] + NO + H2O |
| 6 | K2MnO4 + H2O → KMnO4 + MnO2 + KOH |
| 7 | KClO3 + KJ + H2SO4 → KCl + J2 + K2SO4 + H2O |
| 8 | K2Cr207 + KNO2 + H2SO4 → Cr2(SO4)3 + KNO3 + K2SO4 + H2O |
| 9 | Na2SO3 + H2S + H2SO4 → Na2SO4 + S2 + H2O |
| 10 | KMnO4 + H2S + H2SO4 → MnSO4 + S + K2SO4 + H2O |
| 11 | H2O2 + FeSO4 + H2SO4 → Fe2(SO4)3 + H2O |
| 12 | K2Cr2O7 + H2O2 + H2SO4 → Cr2(SO4)3 + O2 + K2SO4 + H2O |
| 13 | Br2 + K3[Cr(OH)6] + KOH → KBr + К2СrO4 + H2O |
| 14 | Cl2 + NaOH → NaClO3 + NaCl + H2O |
| 15 | Cu + HNO3 → Cu(NO3)2 + NO + H2O |
| 16 | Fe + HNO3 → Fe(NO3)3 + NO2 + H2O |
| 17 | KMnO4 + K2HPO3 + H2SO4 → MnSO4 + H3PO4 + K2SO4 + H2O |
| 18 | Zn + H2SO4 → ZnSO4 + H2S + H2O |
| 19 | КВrO3 + KBr + H2SO4 → Br2 + K2SO4 + H2O |
| 20 | HJO3 + P + H2O → HJ + H3PO4 |
| 21 | Cl2 + H2S + H2O → HCl + H2SO4 |
| 22 | KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + KOH |
| 23 | HNO3 + PbS → NO + S + Pb(NO3)2 + H2O |
| 24 | HNO3 + P + H2O → NO + H3PO4 |
| 25 | KMnO4 + K2SO3 + KOH → K2MnO4 + K2SO4 + H2O |
| 26 | HNO3 + Cu2O → NO + Cu(NO3)2 + H2O |
| 27 | HNO3 + Ca → NH4NO3 + Ca(NO3)2 + H2O |
| 28 | NaMnO4 + Na2S + H2SO4 → MnSO4 + S + Na2SO4 + H2O |
| 29 | KMnO4 + HBr → MnBr2 + Br2 + KBr + H2O |
| 30 | НClO3 + P + H2O → HCl + H3PO4 |
| 31 | KMnO4 + H3AsO3 + H2SO4 → MnSO4 + H3AsO4 + K2SO4 + H2O |
| 32 | Br2 + NaCrO2 + NaOH → NaBr + Na2CrO4 + H2O |
| 33 | Zn + HNO3 → Zn(NO3)2 + N2O + H2O |
| 34 | KClO3 + FeSO4 + H2SO4 → KCl + Fe2(SO4)3 + H2O |
| 35 | K2Cr2O7 + НСl → CrCl3 + Cl2 + KCl + H2O |
| 36 | CrO3 + HCl → CrCl3 + Cl2 + H2O |
| 37 | KMnO4 + Cd + H2SO4 → MnSO4 + CdSO4 + K2SO4 + H2O |
| 38 | Cr2O3 + КСlO3 + KOH → K2CrO4 + KCl + H2O |
| 39 | PbO2 + MnSO4 + HNO3 → Pb(NO3)2 + HMnO4 + PbSO4↓ + H2O |
Химическая кинетика
|
|
|
1. Период полураспада радиоактивного изотопа Cs, который попал в атмосферу в результате аварии на Чернобыльской АЭС, - 29,7 лет. Через какое время количество этого изотопа составит менее 1 % от исходного?
2. Определить период полураспада и сколько исходного вещества прореагировало за 45 мин в реакции второго порядка 2 NO → N2 + O 2, если константа скорости равна 47,059 л/(моль·мин.) и Co ( NO ) = 2,83 моль/л.
3. Определите период полураспада сколько вещества прореагировало за 28 мин. при равных начальных концентрациях исходных реагентов (0,1 моль/л), если константа скорости реакции равна 1,46·10-3 л/(моль·мин.) и стехиометрические коэффициенты в уравнении совпадают с периодом реакции по соответствующим реагентам: Н2 + J = 2 HJ.
|
|
|
4. Константа скорости реакции PН3 → 1/2Р2 + 3/2Н2 равна 1,83·10-2 мин-1. Определите период полураспада, сколько вещества прореагирует за 80 мин, если исходная концентрация фосфина была равна 0,87 моль/л.
5. В необратимой реакции I порядка за 20 мин. при 125 °С степень превращения исходного вещества составила 60 %, а при 145°С такая же степень превращения бала достигнута за 5,5 мин. Найдите константы скорости и энергию активации данной реакции.
6. Реакция А + В = С является реакцией II порядка. Если исходные концентрации равны, то за 500 с реакция проходит на 20 %. За какое время она пройдет на 60 %?
7. Необратимые реакции I порядка за 20 мин. при 125°С прореагировало 50 % от исходного вещества. Рассчитайте, за какое время прореагирует 99 % исходного реагента.
8. Для некоторой реакции II порядка период полураспада равен 10 мин. при начальной концентрации исходных веществ 0,1 моль/л. Как изменится период полураспада, если начальная концентрация станет равной 0,2 моль/л?
9. Определите период полураспада сколько вещества прореагировало за 90 мин. при равных начальных концентрациях исходных реагентов 3,75 моль/л, если константа скорости реакции равна 3·10-4л/(моль·мин.) и стехиометрические коэффициенты в уравнении совпадают с порядком реакции по соответствующим реагентам: СО + Н2О = СО2 + Н2.
10. Константа скорости реакции I порядка СОС l = СО + СС l 2 равна 5,3·10-3 мин-1. Определите период полураспада и сколько исходного вещества прореагирует за 10 мин., если начальная концентрация С O С l 2 равна 0,8моль/л.
11. Реакция термического разложения этана является реакцией I порядка. Рассчитайте период полураспада этапа при 350 °С, если константа скорости равна 0,1 с-1. Определите, какое количество этана останется в системе через 1 с, если исходная концентрация равна 10 моль/л.
12. За 14 дней активность изотопа полония уменьшилась на 6,85 %. Определить константу скорости его распада, период полураспада и рассчитать, в течение какого промежутка времени он разлагается на 90 %.
13. Установлено, что реакция: C 2 H 4 Cl 2 (г.) → С2Н3С l (г.) + НС1 (г.) первого порядка и при 450 °С ее константа скорости равна 3,10·10-3 с-1. Вычислите время, за которое прореагирует половина исходного количества дихлорэтана. Сколько времени понадобится, чтобы дихлорэтан прореагировал на 90 %?
14. Гидролиз бутилацетата в щелочной среде - реакция II порядка. За сколько времени прореагирует 70 % эфира, если исходные концентрации эфира и NaOH одинаковы и равны 0,05 моль/л, а константа скорости этой реакции равна 3,93 л/(моль·мин)?
15. Установлено, что реакция: 2 HI (г.) → I 2 (г.) + Н2 (г.) протекает по II порядку. При равенстве начальной концентрации HI 0,2 моль/л период полураспада равен 30 с. Определите константу скорости этой реакции и периоды полураспада при начальной концентрации H I 0,02 моль/л.
16. Определить сколько вещества прореагировало с момента времени t при начальной концентрации Со. Н2 + В r 2 = 2НВ r К = 8,56·10-2 л/(моль·мин) , t = 60мин, С0 = 0,03 моль/л.
17. Рассчитайте период полураспада и концентрацию исходного вещества через 15 с после протекания реакции СН3 N Н2 = HCN + 2Н2, если исходящая концентрация CH 3 NH 2 равна 10-3 моль/л, а константа скорости при Т = 913К равна 5· 10-3 с-1.
18. Период полураспада радиоактивного изотопа 90 Sr, который попадает в атмосферу при ядерных испытаниях - 28,1 лет. Предположим, что организм новорожденного ребенка поглотил 1 мг этого изотопа. Сколько стронция останется в организме через: а) 18 лет, б) 70 лет, если считать, что он не выводится из организма.
19. Реакция А + В = С является реакцией II порядка. Если исходные концентрации равны, то за 10 мин реакция происходит на 20 %. За какое время она пройдет на 70 %?
20. Определите время, необходимое для разложения бромистого этила на 90 % при 1000 К, если период полураспада равен 2,6·10-2 с, а исходная концентрация равна 1 моль/л:
С2Н5В r → С2Н4 + НВ r.
21. В реакции, протекающей по мономолекулярному закону, период полураспада равен 1 с. Определите константу скорости реакции и количество вещества, не прореагировавшего к концу второй секунды.
22. Реакция гидролиза монохлоруксусной кислоты:
СН2С lC ООН + Н2 O → СН2(ОН) СООН + НС l
подчиняется кинетическому уравнению реакции I порядка. Определите период полураспада и количество прореагировавшего монохлоруксусной кислоты через 20 мин, если исходящая концентрация кислоты равна 0,1 моль/л, а константа скорости 7,31·10-2 мин-1.
23. Рассчитайте период полураспада и концентрацию исходного вещества через 10 с после протекания реакции I порядка 2F2O = 2F2 + O2, если начальная концентрация исходного реагента была равна 10 моль/л, константа скорости равна 1,04·10-4.
24. Рассчитайте период полураспада и концентрацию исходного вещества через 10 с для реакции I порядка N2O5 = N2O4 + ½ O2, если начальная концентрация была равна 0,1 моль/л, а константа скорости равна 7,9·10-7 (при 273 К).
25. Реакция НСНО + Н2 O 2 = НСООН + Н2 O протекает по уравнению II порядка. При равных исходных концентрациях реагентов 0,5 моль/л через 2 часа при температуре 60°С С HCOOH будет равна 0,215 моль/л. Вычислите константу скорости, и определите, через сколько времени прореагирует 90 % исходного вещества.
26. Определите время, необходимое для распада некоторого вещества на 90 %, если период полураспада равен 2 часа, а процесс идет по уравнению первого порядка.
27. Константа скорости реакции I порядка SO 2 Cl 2 → SO 2 + Cl 2 равна 6·10-5 мин-1. Определите период полураспада и концентрацию исходного вещества через 35 минут после начала реакции, если начальная концентрация SO2C l 2 была равна 2,5 моль/л.
28. Реакция II порядка А+D → В+С проводится в растворе с начальными концентрациями Cо(A) = 0,080 моль·л-1 и Cо(D) = 0,070 моль·л-1. Через 90 мин концентрация вещества D уменьшилась до 0,020 моль·л-1. Рассчитайте константу скорости и периоды полупревращения (образования или распада) веществ A, D.
29. Реакция второго порядка А+D → В+С проводится в растворе с начальными концентрациями Cо(A)= 0,060 моль·л-1 и Cо(B) = 0,080 моль·л-1. Через 60 мин концентрация вещества A уменьшилась до 0,025 моль·л-1. Рассчитайте константу скорости и периоды полупревращения (образования или распада) веществ А, В.
30. Период полураспада радиоактивного изотопа Cs , который попал в атмосферу в результате Чернобыльской аварии - 29,7лет. Через какое время количество этого изотопа составит менее 15 % от исходного.
Химическая кинетика
На основании значений констант скоростей реакции при двух температурах определить: энергию активации, константу скорости при температуре T 3, температурный коэффициент скорости и количество вещества, израсходованного за время τ, если начальные концентрации равны C 0. Принять, что порядок реакции и молекулярность совпадают.
| № варианта | Реакция | T 1 , K | K 1 | Т2 , К | К 2 | Т3, К | τ, мин | С0, кмоль/м3 |
| 1 | Н2 + Вr2 → 2НВr | 574,5 | 0,0856 | 497,2 | 0,00036 | 483,2 | 60 | 0,03 |
| 2 | H2 + Br2 → 2HBr | 550,7 | 0,0159 | 524,6 | 0,0026 | 568,2 | 10 | 0,1 |
| 3 | Н2 + I2 → 2HI | 599,0 | 0,00146 | 672,0 | 0,0568 | 648,2 | 28 | 2,83 |
| 4 | Н2 + I2 → 2НI | 683,0 | 0,0659 | 716,0 | 0,375 | 693,2 | 27 | 1,83 |
| 5 | 2НI → Н2+I2 | 456,2 | 0,942·10-6 | 700,0 | 0,00310 | 923,2 | 17 | 238 |
| 6 | 2НI → Н2+I2 | 628,4 | 0,809·10-4 | 780,4 | 0,1059 | 976,2 | 18 | 1,87 |
| 7 | 2NO → N2 + O2 | 1525,2 | 47059 | 1251,4 | 1073 | 1423,2 | 45 | 2,83 |
| 8 | 2N2O → 2N2 + O2 | 986,0 | 6,72 | 1165,0 | 977,0 | 1053,2 | 65 | 1,75 |
| 9 | N2O5 → N2O4 + ½ O2 | 298,2 | 0,00203 | 288,2 | 0,475·10-3 | 338,2 | 32 | 0,93 |
| 10 | PN3 → Pг + 3/2 H2 | 953,2 | 0,0183 | 918,2 | 0,0038 | 988,2 | 80 | 0,87 |
| 11 | SO2Cl2 → SO2 + Cl2 | 552,2 | 0,609·10-4 | 593,2 | 0,132·10-2 | 688,2 | 35 | 2,5 |
| 12 | NO2 + CO → NO + CO2 | 435,0 | 3,7·10-3 | 446,0 | 8,3·10-3 | 440,0 | 5 | 0,7 |
| 13 | N2O5 → 2NO2 + 1/2 O2 | 273,0 | 7,87·10-7 | 298,0 | 3,46·10-5 | 280,0 | 10 | 0,5 |
| 14 | РН3 → ½ Р2 + 3/2 Н2 | 918,0 | 3,8·10-3 | 953,0 | 0,18 | 930,0 | 12 | 1,0 |
| 15 | CO + H2O → CO2+H2 | 313,0 | 8,1·10-3 | 288,0 | 3,1·10-4 | 300,0 | 10 | 4,0 |
| 16 | COCl2 → CO + Cl2 | 552,0 | 0,6·10-4 | 593,0 | 0,1·10-2 | 570,0 | 5 | 2,5 |
| 17 | КClO3 + 6FeSO4 + 3H2SO4 → → КС1 + 3Fe2(SO4)3 +3H2O* | 283,2 | 1,00 | 305,2 | 7,15 | 383,2 | 35 | 1,67 |
| 18 | CO+H2O → CO2+H2 | 288,2 | 0,00031 | 313,2 | 0,00815 | 303,2 | 89 | 3,85 |
| 19 | СОС12 → СО+С12 | 655,0 | 0,53·10-2 | 745,0 | 67,6·10-2 | 698,2 | 104,5 | 0,8 |
| 20 | C2H5ONa + CH3I → С2Н5ОСН3 + NaI | 273,3 | 0,0336 | 303,2 | 2,125 | 288,2 | 10 | 0,87 |
| 21 | СН2ОНСН2С1 + КОН → СН2ОНСН2ОН + КСl | 297,7 | 0,68 | 316,8 | 5,23 | 303,2 | 18 | 0,96 |
| 22 | СН2СlСООН + Н2O → СН2ОНСООН + НСl | 353,2 | 0,222·10-4 | 403,2 | 0,00237 | 423,2 | 26 | 0,5 |
| 23 | СН3СO2С2Н5 + NaOH → CH3CO2Na + C2H5OH | 282,6 | 2,307 | 318,1 | 21,65 | 343,2 | 15 | 0,95 |
| 24 | CH3CO2CH3 + Н2O → СН3СO2Н + СН3ОН (в водном растворе катализатор НСl 0,1 н.) | 298,2 | 0,653·10-3 | 308,2 | 1,663·10-3 | 313,2 | 25 | 1,6 |
| 25 | СН3СO2СН3 + Н2O → СН3СO2Н + СН3ОН (в водном растворе катализатор НСl 1/8 н.) | 298,2 | 16,09·10-3 | 308,2 | 37,84·10-3 | 323,2 | 80 | 2,96 |
| 26 | СН3СO2СН3 + Н2O → СН3СO2Н + СН3ОН (в водном растворе катализатор НСl 0,1 н.) | 273,2 | 2,056·10-5 | 313,2 | 109,4·10-5 | 298,2 | 67 | 3,55 |
| 27 | 2СН2O + NaOH → HCO2Na + CH3OH | 323,2 | 5,5·10-3 | 358,2 | 294,0·10-3 | 338,2 | 5 | 0,5 |
| 28 | (CH3)2SO4 + NaI → CH3I + Na(CH3)SO4 | 273,2 | 0,029 | 298,2 | 1,04 | 285,8 | 100 | 3,89 |
| 29 | С6Н5СН2Вr + C2H5OH → C6H5CH2OC2H5 + HBr | 298,2 | 1,44 | 338,2 | 2,01 | 318,2 | 90 | 2,67 |
| 30 | C12H22O11 + H2O → C6H12O6 + C6H12O6 | 298,2 | 0,765 | 328,2 | 35,5 | 313,2 | 15 | 1,85 |
Примечание: Размерность констант соответственно мин-1 (кмоль/м3) -1 (для реакции II порядка);
* Принять, что реакция подчиняется уравнению реакции первого порядка.
Химическая термодинамика
Для указанной реакции вычислите Δr H 0 298 , Δ r G 0 T , KT равн . На основе расчетов сделайте вывод о тепловом эффекте процесса, его термодинамической возможности при заданных температурах и положении химического равновесия. Какие условия и как следует изменить для увеличения выхода продуктов реакции.
| № вар. | Реакция | T, K |
| 1 | Fe2O3(к) + CO(г) ↔ 2FeO(к) + CO2(г) | 800,1500 |
| 2 | FeO(к) + H2(г) ↔ Fe(к) + H2O(г) | 500,1000 |
| 3 | 3H2O(г) + 2Al(к) ↔ Al2O3(к) + 3H2(г) | 600,1200 |
| 4 | 2CO2(г) + 3Fe(к) ↔ Fe3C(к) + CO2(г) | 1000,2000 |
| 5 | MnO2(к) + 2H2(г) ↔ Mn(к) + 2H2O(г) | 1200,1500 |
| 6 | Fe2O3(к) + H2(г) ↔ 2FeO(к) + H2O(г) | 600,1400 |
| 7 | Fe3O4(к) + 4CO(г) ↔ 3Fe(к) + 4CO2(г) | 800,1500 |
| 8 | FeO(к) + CO(г) ↔ Fe(к) + CO2(г) | 500,1200 |
| 9 | WO3(к) + 3H2(г) ↔W(к) + 3H2O(г) | 800,2000 |
| 10 | MnO(к) + CO(г) ↔ Mn(к) + CO2(г) | 1000,1500 |
| 11 | 3Fe(к) + 4H2O(г) ↔ Fe3O4(к)+ 4H2(г) | 800,1400 |
| 12 | GeO2(к) + 2H2(г) ↔ Ge(к)+ 2H2O(г) | 500,800 |
| 13 | PtCl2(к) + CO(г) + H2O(г) ↔ Pt(к) + CO2(г) + 2HCl(г) | 300,800 |
| 14 | SiO2(к) + 2H2(г) ↔ Si(к) + 2H2O(г) | 1200,1800 |
| 15 | Fe3O4(к) + 4H2(г) ↔ 3Fe(к) + 4H2O(г) | 700,1400 |
| 16 | Fe2O3(к) + 3CO(г) ↔ 2Fe(к) + 3CO2(г) | 600,1200 |
| 17 | Fe2O3(к) + 3H2(г) ↔ 2Fe(к) + 3H2O(г) | 600,1200 |
| 18 | 3Fe2O3(к) + CO(г) ↔ 2Fe3O4(к) + CO2(г) | 1000,1500 |
| 19 | 3Fe2O3(к) + H2(г) ↔ 2Fe3O4(к) + H2O(г) | 1000,1500 |
| 20 | 2Fe(к) + 3H2O(г) ↔ Fe2O3(к) + H2(г) | 1200,1400 |
| 21 | Mn3O4(к) + 4H2(г) ↔ Mn(к) + 4H2O(г) | 800,1500 |
| 22 | MnO(к) + CO(г) ↔ Mn(к) + CO2(г) | 800,1500 |
| 23 | TiO2(к) + C(к) ↔ Ti(к) + 2CO(г) | 1000,3000 |
| 24 | Mg(к) + H2O(г) ↔ MgO(к) + H2(г) | 400,1000 |
| 25 | Fe3O4(к) + CO(г) ↔ 3FeO(к) + CO2(г) | 500,2000 |
Гидролиз солей
Учитывая, что гидролиз идет по первой ступени, вычислите константу, степень гидролиза и pH в водном растворе соли по следующим данным:
| № варианта | Соль | c ,моль/л | № варианта | Соль | c ,моль/л |
| 1 | FeSO4 | 0,1 | 14 | NaClO | 0,1 |
| 2 | Na3PO4 | 0,02 | 15 | Na2CO3 | 0,002 |
| 3 | K2CO3 | 0,5 | 16 | NiBr2 | 0,02 |
| 4 | Cu(NO3)2 | 0,01 | 17 | FeCl3 | 0,2 |
| 5 | ZnCl2 | 0,05 | 18 | HCOONa | 0,1 |
| 6 | (NH4)2SO4 | 0,2 | 19 | Cr(NO3)3 | 0,01 |
| 7 | BaS | 0,4 | 20 | Na2SO3 | 0,1 |
| 8 | NH4Cl | 0,8 | 21 | MnSO4 | 0,2 |
| 9 | CH3COOK | 0,01 | 22 | KNO2 | 0,03 |
| 10 | Na2SiO3 | 0,02 | 23 | ZnSO4 | 0,5 |
| 11 | Al2(SiO4)3 | 0,1 | 24 | NH4NO3 | 0,1 |
| 12 | NaCN | 0,04 | 25 | Na2S | 0,02 |
| 13 | CdCl2 | 0,2 |
Константы диссоциации соответствующих слабых электролитов см.: Рабинович В.А., Хавин З.Я. Краткий химический справочник. М: Химия, 1978, 392 с.
Растворы
1. Определите температуру замерзания 45 %-ного раствора хлорида натрия, если кажущаяся степень диссоциации NaCl в этом растворе равна 84,5%. Криоскопическая постоянная воды равна 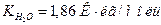 .
.
2. Раствор, содержащий 0,933 г бромида натрия в 33,5 г воды, замерзает при температуре -0,944°С. Вычислите кажущуюся степень диссоциации бромида натрия в этом растворе  .
.
3. Чему равна степень диссоциации ортофосфата натрия в его 0,1 моль/кг растворе, температура кипения которого равна 100,17°С  .
.
4. Раствор 146 г хлорида щелочного металла в 5 кг воды (α = 70 %) замерзает при -1,6°С. Вычислите молекулярную массу металла  .
.
- Определите температуру кипения раствора, содержащего в 1000 г воды 0,01 моль хлорида бария, если кажущаяся степень диссоциации его равна 87 %. Эбуллиоскопическая постоянная воды
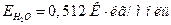 .
.
6. Чему равна степень диссоциации хлорида кальция в его одномоляльном растворе, температура кипения которого равна -5,46°С.  .
.
7. Раствор, содержащий 2,85 г сульфата калия в 100 г воды, кипит при температуре 100,191°С. Вычислите кажущуюся степень диссоциации сульфата калия. Эбуллиоскопическая постоянная воды равна 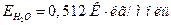 .
.
8. Раствор, содержащий 1,7 г хлорида цинка в 250 г воды, замерзает при температуре -0,23°С. Определите кажущуюся степень диссоциации хлорида цинка в этом растворе. 
9. Раствор, содержащий бромид натрия массой 0,933 г в воде массой 33,5 г, замерзает при температуре 0,944°С. Вычислите кажущуюся степень диссоциации NaBr в этом растворе. Криоскопическая постоянная воды равна  .
.
10. Температура замерзания раствора хлорида кальция массовой долей 2,5 % равна -1,2°С. Определите кажущуюся степень диссоциации соли в этом растворе. Криоскопическая постоянная воды равна 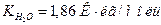 .
.
11. Сколько грамм свекловичного сахара содержится в воде массой 100 г, если этот раствор замерзает при той же температуре, что и раствор хлорида калия молекулярной концентрацией 0,1 моль/кг? Кажущаяся степень диссоциации соли равна 83 %. Криоскопическая постоянная воды равна  .
.
12. Раствор, содержащий хлорид аммония массой 0,75 г в воде массой 100 г, кипит при температуре 100,128°С. Вычислите кажущуюся степень диссоциации хлорида аммония в этом растворе. Эбуллиоскопическая постоянная воды равна  .
.
- Раствор бензойной кислоты (С6Н5СООН) массой 0,608 г содержащийся в воде массой 25 г кипит при температуре 100,104°С. Эбуллиоскопическая постоянная воды равна
 . К слабым или сильным электролитам относится бензойная кислота?
. К слабым или сильным электролитам относится бензойная кислота?
14. Раствор, содержащий 1,5 г КС l в 100 г Н2О, замерзает при температуре -0,684°С. Определить изотонический коэффициент, степень диссоциации и давление пара этого раствора при 25°С, если давление пара воды при этой температуре равно 23,756 мм рт.ст. Криоскопическая постоянная воды равна  .
.
15. Раствор, содержащий сульфат калия массой 2,85 г в воде массой 100 г , кипит при температуре 100,191°С. Вычислить кажущуюся относительную молекулярную массу и кажущуюся степень диссоциации, если эбуллиоскопическая постоянная воды равна  .
.
16. При 75° C давление паров воды равно 138,5 кПа. При растворении в воде массой 100 г хлорида бария массой 3,4 г, давление пара понизилось на 0,51 кПа. Вычислите кажущуюся степень диссоциации хлорида бария.
17. Водный 7,5% раствор хлорид кальция кипит при 374 К, при этом давление раствора равно 101,325 кПа. Найти кажущуюся степень диссоциации. Давление пара воды при 374 К равно 105 кПа.
18. Давление пара раствора содержащего 2,21 г CaCl 2 в 100 г воды при 293 К равно 2321 Па, а давление пара воды при той же температуре 2339 Па. Вычислить кажущуюся степень диссоциации.
19. Атмосферное давление таково, что чистая вода кипит при 372,4 К. При какой температуре будет кипеть раствор 3,291 г хлорид кальция в 100 г воды. Кажущая степень диссоциации раствора -68 %. Эбуллиоскопическая постоянная воды равна 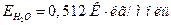 .
.
20. Рассчитайте, при какой температуре замерзает раствор, содержащий 74,4 г сульфата магния, в 20 кг воды (α = 75%),  .
.
21. Раствор 59,2 г хлорида щелочного металла в 2 кг воды (α = 70 %) замерзает при -1,6°С. Вычислите молекулярную массу металла. 
22. Найдите массу хлорида натрия, который растворили в 1,5 л воды, если полученный раствор (α = 72 %) замерзает при -1,53°С. 
23. Рассчитайте степень электролитической диссоциации сульфата магния в 0,01 моль/л растворе, замерзающем при -0,027°С. Плотность раствора принять равной 1,015 г/см3.
24. Чему равна степень диссоциации ортофосфата натрия в 0,1 моль/л растворе, кипящем при 100,17°С. Плотность раствора 1,007 г/см3.  .
.
25. Чему равна степень диссоциации хлорида алюминия в его 0,5 моль/л растворе, кипящем при 100,91°С. Плотность раствора 1,060г/см3. 
Способы выражения состава растворов
Рассчитайте: а) массовую долю растворенного вещества; б) молярную концентрацию; в) моляльность раствора; г) мольную долю растворенного вещества растворов, полученных при растворении веществ в воде.
| № вар. | Растворенное вещество | Объем воды, мл | Плотность раствора, г/мл | |
| формула | масса | |||
| 1 | H3PO4 | 18 | 282 | 1,036 |
| 2 | KOH | 56 | 144 | 1,280 |
| 3 | HNO3 | 108 | 192 | 1,210 |
| 4 | H2SO4 | 24 | 376 | 1,037 |
| 5 | NaOH | 24 | 276 | 1,090 |
| 6 | HCl | 60 | 240 | 1,100 |
| 7 | H3PO4 | 40 | 160 | 1,113 |
| 8 | KOH | 42 | 258 | 1,137 |
| 9 | HNO3 | 48 | 252 | 1,090 |
| 10 | H2SO4 | 60 | 340 | 1,120 |
| 11 | NaOH | 66 | 234 | 1,250 |
| 12 | HCl | 60 | 540 | 1,050 |
| 13 | H3PO4 | 80 | 120 | 1,210 |
| 14 | KOH | 36 | 114 | 1,220 |
| 15 | HNO3 | 24 | 176 | 1,070 |
| 16 | H2SO4 | 132 | 168 | 1,350 |
| 17 | NaOH | 160 | 240 | 1,430 |
| 18 | HCl | 60 | 140 | 1,150 |
| 19 | H3PO4 | 60 | 140 | 1,181 |
| 20 | KOH | 21 | 329 | 1,050 |
| 21 | HNO3 | 120 | 80 | 1,370 |
| 22 | H2SO4 | 36 | 564 | 1,037 |
| 23 | NaOH | 25 | 475 | 1,055 |
| 24 | HCl | 30 | 170 | 1,075 |
| 25 | H3PO4 | 25 | 475 | 1,028 |
ДОМАШНЕЕ ЗАДАНИЕ № 2
2. «Электрохимические процессы. Коррозия металлов»
Гальванические элементы
1. Составьте схему, напишите уравнения электродных процессов и суммарной реакции элемента, один из электродов которого стандартный хлорный, а второй - цинковый с  . Рассчитайте ЭДС этого элемента при 298 К.
. Рассчитайте ЭДС этого элемента при 298 К.
2. .Составьте схему, напишите уравнения электродных процессов и суммарной реакции, у которого один электрод кадмиевый с  , а второй - кислородный при стандартном давлении О2 при рН=1. Рассчитайте ЭДС этого элемента при 298 К.
, а второй - кислородный при стандартном давлении О2 при рН=1. Рассчитайте ЭДС этого элемента при 298 К.
3. Составьте схему, напишите уравнения электродных процессов и суммарной реакции, у элемента которого один электрод цинковый с  , а второй - водородный при стандартном давлении водорода и pH = 2. Рассчитайте ЭДС этого элемента при 298 К.
, а второй - водородный при стандартном давлении водорода и pH = 2. Рассчитайте ЭДС этого элемента при 298 К.
4. Составьте схему, напишите уравнения электродных процессов и суммарной реакции, у элемента которого один электрод кадмиевый с  , а второй - хлорный со стандартным давлением хлора и с
, а второй - хлорный со стандартным давлением хлора и с 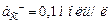 . Рассчитайте ЭДС этого элемента для 298 К.
. Рассчитайте ЭДС этого элемента для 298 К.
5. Составьте схему, напишите уравнения электродных процессов и суммарной реакции (Т = 298 К) элемента, у которого один электрод цинковый с  , а второй — хлорный со стандартным давлением хлора и
, а второй — хлорный со стандартным давлением хлора и 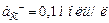 . Рассчитайте ЭДС этого элемента.
. Рассчитайте ЭДС этого элемента.
6. Составьте схему, напишите уравнения электродных процессов и суммарной реакции, у которого один электрод литиевый с  , а второй водородный со стандартным давлением водорода и рН = 10. Рассчитайте ЭДС этого элемента.
, а второй водородный со стандартным давлением водорода и рН = 10. Рассчитайте ЭДС этого элемента.
7. Составьте схему, напишите уравнения электродных процессов элемента, состоящего из серебряной и свинцовой пластин, опущенных в раствор, содержащий собственные ионы с  . Рассчитайте ЭДС этого элемента. Изменится ли ЭДС, если активность ионов уменьшить в 10 раз?
. Рассчитайте ЭДС этого элемента. Изменится ли ЭДС, если активность ионов уменьшить в 10 раз?
8. Составьте схему, напишите уравнения электродных процессов элемента, состоящего из медной и кадмиевой пластин, опущенных в раствор, содержащий собственные ионы с  . Рассчитайте ЭДС этого элемента. Изменится ли ЭДС, если активность ионов возрастает в 10 раз?
. Рассчитайте ЭДС этого элемента. Изменится ли ЭДС, если активность ионов возрастает в 10 раз?
9. Рассчитайте ЭДС при Т = 298 К и напишите уравнения электродных процессов для гальванического элемента.
Cr | Cr 3+ (0,1 моль/л) || Au 3+ (0,001 моль/л) | Au
10. Рассчитайте ЭДС гальванического элемента при Т = 298 К и напишите уравнения электродных процессов для гальванического элемента.
Zn | Zn 2+ (0,01 моль/л) || Hg 2+ (0,01 моль/л) | Hg
11. Рассчитайте ЭДС при Т = 298 К и напишите уравнения электродных процессов для гальванического элемента.
Pb | Pb 2+ (0,001 моль/л) || Ag + (0,01 моль/л) | Ag
12. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС медно-кадмиевого гальванического элемента, в котором  , а
, а  .
.
13. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в 0,01 М, а второй - в 0,1 М растворы AgNO 3.
14. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод в 0,01 М растворе сульфата никеля.
15. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией  . Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое количество раз?
. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое количество раз?
16. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией  . Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л?
. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/л?
17. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на аноде и на катоде. Какой концентрации надо было бы взять ионы железа (моль/л), чтобы ЭДС элемента стала равной нулю, если  ?
?
18. Составьте схему гальванического элемента, в основе работы которого лежит реакция, протекающую по уравнению: Ni + Pb ( NO 3 )2 = Ni ( NO 3 )2 + Pb.
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если  , а
, а  .
.
19. Составьте схему, напишите уравнения электродных процессов элемента состоящего из свинцовой и цинковой пластин, опущенных в раствор, содержащих собственные ионы с  и
и  . Рассчитайте ЭДС этого элемента.
. Рассчитайте ЭДС этого элемента.
20. Составьте схему, напишите уравнения электродных процессов элемента, состоящего из алюминиевой и серебреной пластин, опущенных в раствор AlCl 3 (0,1 М) и A gN O 3 (0,1 М). Рассчитайте ЭДС этого элемента.
21. Составьте схему и рассчитайте ЭДС элемента при 298 К, в основе работы которого лежит реакция:
Zn + Sn 2+ = Zn 2+ + Sn
при  ,
,  .
.
22. Составьте схему и рассчитайте ЭДС элемента при 298 К, в основе работы которого лежит реакция:
Fe + 2 Ag + = Fe 2+ + 2 Ag
при  ,
,  .
.
23. Составьте схему и напишите уравнения электродных процессов и суммарной реакции элемента у которого один электрод кадмиевый с  , а второй водородный при стандартном давлении водорода и рН = 3. Рассчитайте ЭДС этого элемента при 298 К.
, а второй водородный при стандартном давлении водорода и рН = 3. Рассчитайте ЭДС этого элемента при 298 К.
24. Составьте схему, напишите уравнения электродных процессов элемента, состоящую из никелевой и свинцовой пластины, опущенных в раствор, содержащий собственные ионы с  и
и  . Рассчитайте ЭДС этого элемента при 298 К.
. Рассчитайте ЭДС этого элемента при 298 К.
25. Составьте схему и напишите уравнения электродных процессов и суммарной реакции элемента у которого один электрод алюминиевый с  , а второй кислородный при стандартном давлении кислорода и рН = 1. Рассчитайте ЭДС этого элемента при 298 К.
, а второй кислородный при стандартном давлении кислорода и рН = 1. Рассчитайте ЭДС этого элемента при 298 К.
Электролиз
1. В течение какого времени ток силой 10 А должен проходить через электролитическую ячейку, содержащую расплавленный хлорид натрия, чтобы на катоде образовался металлический натрий массой 69 г? Определите массу хлора, выделившегося на аноде.
2. При электролизе соли трёхвалентного металла при силе тока 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислите атомную массу металла.
3. Электролиз раствора сульфата цинка проводили в течение 5 ч, в результате чего выделилось 6 л кислорода (н.у.). Составьте уравнения электродных процессов и вычислите силу тока.
4. Раствор CuSO 4 подвергается электролизу с медным катодом и платиновым анодом. За время электролиза на катоде отложилось 6,35 г меди. Выделившийся на аноде кислород измерен при давлении 1,013·105 Па. Каков объём газа? Сколько времени продолжался электролиз, если сила тока равна 0,1 А?
5. Сколько и каких продуктов можно получить в результате пропускания тока силой 10 А через электролизер в течение часа, если электролизер заполнен: а) расплавом иодида серебра; б) разбавленным водным раствором иодида серебра.
6. Раствор сульфата никеля подвергали электролизу током в 15 А в течение часа. На катоде выделились никель и водород, при этом 60 % напряжения было израсходовано на выделение никеля. Какова масса никеля, выделенная на катоде? Каков объём водорода, если электролиз проводился при нормальных условиях?
7. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КОН. Чему равна сила тока, если в течение 1 ч 15 мин 20 с на аноде выделилось 6,4 л газа? Сколько литров газа (н. у.) выделилось при этом на катоде?
8. Электролиз раствора сульфата некоторого металла проводили при силе тока 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите эквивалентную массу металла.
9. При электролизе соли некоторого металла в течение 1,5 ч при силе тока 1,8 А на катоде выделилось 1,75 г этого металла. Вычислите эквивалентную массу металла.
10. При электролизе раствора CuSO 4 на аноде выделилось 168 см3 (н. у.) газа. Составьте электронные уравнения процессов, происходящих на электродах, и вычислите, какая масса меди выделилась на катоде.
11. Ток силой 3 А пропускался в течение 3 часов через водный раствор CuSO 4. Каков выход по току металлической меди, если за указанное время на катоде выделилась медь массой 9,162 г?
12. Электролиз раствора Na 2 SO 4 проводили в течение 5 ч при силе тока 7 A. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объём газов (н. у.), выделившихся на катоде и аноде?
13. Электролиз раствора CuSO 4 проводили в течение 15 мин при силе тока 2,5 А. Выделилось 0,72 г меди. Составьте электронные уравнения процессов, происходящих на электродах в случае медного и угольного анода. Вычислите выход по току.
14. Электролиз раствора CuSO 4 проводили с медным анодом в течение 4 ч при силе тока 50 А. При этом выделилось 224 г меди. Вычислите выход по току. Составьте электронные уравнения процессов, происходящих на электродах в случае медного и угольного анода.
15. При пропускании тока 2 А в течение 1 ч 14 мин 24 с через водный раствор хлорида металла ( II ) на одном из графитовых электродов выделился металл массой 2,94 г. Чему равна атомная масса металла, если выход по току 100 %, и что это за металл? Напишите уравнения реакций, протекающих на электродах.
15. Через раствор сульфата кадмия пропущено 25А·ч электричества. При этом на катоде выделился кадмий массой 42,5 г. Напишите уравнения реакций, протекающих на электродах, рассчитайте выход по току кадмия.
16. Рассчитайте выход по току кадмия, если при электролизе в течение 1 ч на катоде выделился кадмий массой 5,62 г, а ток был равен 5,36 А.
17. Составьте уравнения реакций, происходящих на электродах при электролизе: а) раствора КСl; б) расплава КСl. Рассчитайте массу веществ, выделившихся на катоде в случаях а) и б) при прохождении тока 26,8 А в течение 10 ч.
18. Составьте уравнения реакций, происходящих при электролизе: а) раствора КОН; б) расплава КОН. Рассчитайте массу веществ, выделившихся на катоде в случаях а) и б) при прохождении 1,34 А в течение 100 ч.
19. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе растворов NaCl и КОН. Сколько литров (н. у.) газа выделится на аноде при электролизе гидроксида калия, если электролиз проводить в течение 30 мин при силе тока 0,5 А?
20. При электролизе сульфата натрия получили при н.у. Н2 объемом 448 л. Напишите уравнения реакций, протекающих на нерастворимых аноде и катоде и рассчитайте, сколько времени протекал электролиз, если ток был 100 А.
21. Электролиз раствора K 2 SO 4 проводили с нерастворимыми электродами при токе 2,68 А в течение 1 ч. Составьте уравнения процессов, происходящих на электродах, вычислите объём выделяющихся при н.у. на электродах веществ.
23. При электролизе раствора сульфата меди на аноде выделился кислород объемом 560 мл, измеренный при н.у. Сколько граммов меди выделилось на катоде?
22. Электролиз раствора сульфата цинка проводили с нерастворимыми анодами в течение 6,7 ч, в результате чего выделился кислород объёмом 5,6 л, измеренный при н.у. Вычислите ток и массу осажденного цинка при выходе его по току 70 %.
23. Напишите уравнения реакций, протекающих на нерастворимых электродах при электролизе водного раствора КОН. Какие вещества и в каком объёме можно получить при н.у., если пропустить ток 13,4 А в течение 2 ч?
24. Электролиз раствора нитрата серебра проводили при силе тока 2 А в течение 4 ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса серебра выделилась на катоде и каков объем газа (н. у.), выделившегося на аноде?
25. Сплав меди с сурьмой, содержащей 47 % сурьмы, анодно растворяли при силе тока 0,02 А в течение 3600 с. Определить количество меди и сурьмы, перешедшие в раствор, если на аноде протекают только процессы ионизации меди и сурьмы и выход по току меди равен 53 %.
26. При электролизе растворов MgSO 4 и ZnCl 2, соединенных последовательно с источником тока, на одном из катодов выделилось 0,25 г водорода. Какая масса вещества выделится на другом катоде? На анодах?
27. Электролиз раствора NaI проводили при силе тока 6 А в течение 2,5 ч. Составьте электронные уравнения процессов, происходящих на угольных электродах, и вычислите массу вещества, выделившегося на катоде и аноде.
28. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора KBr. Какая масса вещества выделяется на катоде и аноде, если электролиз проводить в течение 1 ч 35 мин при силе тока 15 А?
29. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора Na 2 SO 4. Вычислите массу вещества, выделяющегося на катоде, если на аноде выделяется 1,12 л газа (н. у.). Какая масса H2SO4 образуется при этом возле анода?
30. Электролиз раствора K 2 SO 4 проводили при силе тока 5 А в течение 3 ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н. у.), выделившихся на катоде, аноде?
31. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора AgNO 3. Если электролиз проводить с серебряным анодом, то его масса уменьшается на 5,4 г . Определите расход электричества при этом.
32. Ток силой 1,5 А выделяет из раствора сульфата кадмия в течение 40 мин кадмий массой 2,283 г . Вычислите молярную массу эквивалента этого металла. Какое вещество и какой массой выделилось на угольном аноде при нормальных условиях?
33. Через раствор сульфата меди (II), в который опущены медные электроды, в течение 3 ч пропускали ток силой 1,5 А. Какие процессы происходили у анода и катода? Как изменилась масса анода?
34. Напишите уравнения реакций, протекающих на графитовых электродах при электролизе: а) расплава хлорида магния; б) раствора хлорида магния. Сколько времени необходимо вести электролиз при токе 2 А, чтобы на катоде выделилось вещество массой 2,43 г (для реакций а) и б)?
35. Насколько уменьшится масса серебряного анода, если электролиз раствора AgNO 3 проводить при силе тока 2 А в течение 38 мин 20 с? Составьте электронные уравнения процессов, происходящих на графитовых электродах.
36. Напишите уравнения реакций, протекающих на графитовом электроде при электролизе а) расплава хлорида кальция; б) раствора хлорида кальция. Сколько времени необходимо вести электролиз при токе 1 А, чтобы на катоде выдели вещество массой 4 г (для случаев а) и б).
37. Напишите уравнения реакций, протекающих при электролизе водного раствора сульфата никеля: а) электроды никелевые; б) электроды нерастворимые. Каким должен быть ток, чтобы за 10 ч на катоде выделился никель массой 47 г при выходе его по току 80 %.
38. В двух электролизерах с графитовыми электродами происходит электролиз: а) раствора едкого натра; б) расплава едкого натра. Напишите уравнения электродных реакций. Рассчитайте массу веществ, выделившихся на катоде, при прохождении 26,8 А·ч электричества в электролизерах.
39. Какие процессы идут на графитовых электродах при электролизе раствора КОН? Сколько граммов вещества выделится на электродах при прохождении через раствор тока 6,7 А в течение 1 ч?
40. Через раствор сульфата железа ( II ) пропускали ток 13,4 А в течение 1 ч. Определите массу железа, которая выделилась на катоде, если выход по току был равен 70 %. Напишите уравнения реакций, протекающих на электродах.
41. В двух электролизерах с графитовыми электродами происходит электролиз: а) раствора КОН; б) расплава КОН. Напишите уравнения электродных реакций, рассчитайте массу веществ, выделившихся на катодах при прохождении 53,6 А·ч электричества.
Коррозия
1. Возможна ли коррозия системы Fe - Cu в растворе следующего состава:  , С( Na 2 CO 3 )=10-6 моль/л. Изобразите схемы электродных процессов и условную схему коррозионного элемента.
, С( Na 2 CO 3 )=10-6 моль/л. Изобразите схемы электродных процессов и условную схему коррозионного элемента.
2. Запишите схемы электродных процессов и условную схему коррозионного элемента при коррозии сплава Fe - Cu в 0,1 М деаэрированном растворе FeCl 2. Вычислите ЭДС коррозионного элемента.
3. Какая масса металла растворяется за 25 мин. в коррозионном элементе, возникающем при погружении пластинки луженого железа в раствор NaCl, если этот элемент дает ток силой 5 А? Приведите схему процессов в указанном коррозионном элементе.
4. Будет ли корродировать медь в деаэрированном растворе сульфата меди ( II ), если  ,
,  ? Приведите схему процессов в указанном коррозионном элементе.
? Приведите схему процессов в указанном коррозионном элементе.
5. Запишите схему электродных процессов и условную схему гальванического элемента при коррозии системы Fe - C в морской воде, если ее рН=8. Вычислите ЭДС коррозионного элемента, учитывая, что 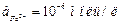 .
.
6. Возможна ли коррозия железа с выделением водорода в растворе с рН=3, в котором  . Изобразите схему электродных процессов и условную схему коррозионного элемента.
. Изобразите схему электродных процессов и условную схему коррозионного элемента.
7. Как протекает коррозия сплава Fe - Co в растворе с рН=5, при  и хорошем доступе кислорода. Вычислите ЭДС коррозионного элемента.
и хорошем доступе кислорода. Вычислите ЭДС коррозионного элемента.
8. Будет ли корродировать никель в деаэрированном растворе хлорида никеля ( II ) концентрацией 0,005 моль/л. Изобразите схему электродных процессов и условную схему коррозионного элемента.
9. При коррозии системы Al - Cr в растворе K 2 CO 3 концентрацией 0,001 моль/л за 1 мин 20 с поглотилось 0,034 л кислорода. Сколько грамм металла растворилось? Изобразите схему электродных процессов и условную схему коррозионного элемента.
10. Возможна ли коррозия сплава Cu - Ni в растворе при следующих условиях  ,
,  . Изобразите схему электродных процессов и условную схему коррозионного элемента.
. Изобразите схему электродных процессов и условную схему коррозионного элемента.
11. Образец Cu - Cd сплава массой 10 г опустили в раствор хлорида кадмия концентрацией 0,001 моль/л. Через 30 мин масса пластины составила 9,8 г. Какой объем газа при этом выделился? Изобразите схему электродных процессов, суммарное уравнение и условную схему коррозионного элемента.
12. Изобразите схему электродных процессов при коррозии ферросилиция в растворе с рН=3, а  . Вычислите ЭДС коррозионного элемента. Сделайте вывод о термодинамической возможности процесса.
. Вычислите ЭДС коррозионного элемента. Сделайте вывод о термодинамической возможности процесса.
13. Пластинка железа, покрытого кадмием опущена в раствор, содержащий соляную кислоту с 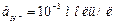 . Изобразите схему электродных процессов, суммарное уравнение и условную схему коррозионного элемента, если
. Изобразите схему электродных процессов, суммарное уравнение и условную схему коррозионного элемента, если  .
.
14. Будет ли корродировать медь в аэрированном растворе CuSO 4 концентрацией 0,004 моль/л? Изобразите схему возможных электродных процессов, суммарное уравнение и условную схему коррозионного элемента.
15. Пластинка луженого железа опущена в 0,001 М раствор соляной кислоты. Изобразите схему электродных процессов, суммарное уравнение и условную схему коррозионного элемента. Чему равна ЭДС элемента, если потенциал железа в этих условиях равен -0,5 В?
16. При коррозии Zn - Al сплава в 0,1 М растворе HCl через внешнюю цепь возникающего элемента проходит ток силой 2 А. Сколько металла растворится и какой объем газа выделится в течение 30 мин? Изобразите схему происходящих процессов.
17. Изобразите схему электродных процессов, суммарное уравнение и условную схему коррозионного элемента, возникающего при коррозии ферромарганца в электролите следующего состава: 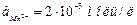 , С( HCl )=0,02 моль/л. Вычислите ЭДС коррозионного элемента.
, С( HCl )=0,02 моль/л. Вычислите ЭДС коррозионного элемента.
18. Изобразите схему электродных процессов, суммарное уравнение и условную схему коррозионного элемента, возникающего при коррозии ферромарганца в растворе, с  . Вычислите ЭДС коррозионного элемента.
. Вычислите ЭДС коррозионного элемента.
19. Запишите схему электродных процессов, суммарное уравнение и условную схему коррозии чугуна в электролите содержащем: С( FeSO 4 )=10-6 моль/л, С( K 2 CO 3 )=10-6 моль/л. Вычислите ЭДС коррозионного элемента.
20. Будет ли корродировать Ag в деаэрированном растворе содержащем AgNO 3, если  , рН=3? Запишите схему процессов в указанном коррозионном элементе.
, рН=3? Запишите схему процессов в указанном коррозионном элементе.
21. Никель-алюминиевый сплав помещен в 2%-ный раствор соляной кислоты объемом 100 мл. Через 30 мин объем выделившегося газа составил 0,448 л. Какое количество электричества прошло через внешнюю цепь возникающего коррозионного элемента? Насколько уменьшилась масса образца сплава? Запишите схему электродных процессов и условную схему коррозионного элемента.
22. Запишите схему электродных процессов и условную схему гальванического элемента при коррозии системы Fe - Pb в морской воде, если ее рН=8,5, а активная концентрация ионов  .
.
23. Какая масса металла растворится за 30 мин в коррозионном элементе, возникающем при погружении пластинки оцинкованного железа в раствор NaCl, если этот элемент дает ток силой 1 А? Приведите схему процессов в указанном коррозионном элементе.
24. Изобразите схему электродных процессов при коррозии сплава свинца с кадмием в растворе с рН=3,5 и активной концентрацией ионов  . Вычислите ЭДС коррозионного элемента. Сделайте вывод о термодинамической возможности процесса.
. Вычислите ЭДС коррозионного элемента. Сделайте вывод о термодинамической возможности процесса.
25. Будет ли корродировать свинец в электролите, содержащем Na 2 CO 3 (С=10-6 моль/л) и ионы Pb 2+, С( Pb 2+ )=10-6 моль/л. Запишите схему электродных процессов и условную схему коррозионного элемента.

Кристаллы
В задачах (1 - 20) определите, используя приведенные ниже экспериментальные данные, структурный тип кристаллической решетки, в которой кристаллизуется данный металл (гранецентрированная кубическая, объемно-центрированная кубическая или типа алмаза), рассчитайте эффективный радиус атома металла, изобразите элементарную ячейку, укажите координационное число.
| № п/п | Металл | Плотность, г/см3 | Ребро куба a · 10-10,м | № п/п | Металл | Плотность, г/см3 | Ребро куба a · 10-10,м |
| 1 | Cr | 7.00 | 2.89 | 11 | Cu | 8.90 | 3.62 |
| 2 | V | 6.10 | 3.04 | 12 | Sn | 5.75 | 6.46 |
| 3 | W | 19.20 | 3.16 | 13 | Nb | 3.47 | 3.30 |
| 4 | Rb | 1.53 | 5.6 | 14 | Та | 16.6 | 3.30 |
| 5 | Pb | 11.34 | 4.95 | 15 | α-Fe | 7.80 | 2.87 |
| 6 | Au | 19.32 | 4.08 | 16 | Mo | 10.20 | 3.15 |
| 7 | Na | 0.97 | 4.20 | 17 | Cs | 1.90 | 6.00 |
| 8 | Ge | 5.32 | 5.65 | 18 | Ba | 3.75 | 5.02 |
| 9 | Li | 0.53 | 3.5 | 19 | γ-Fe | 8.14 | 3.64 |
| 10 | Pt | 21.45 | 4.93 | 20 | Al | 2.70 | 4.05 |
В задачах (21 - 40) определите, используя приведенные ниже экспериментальные данные, структурный тип кристаллической решетки, в которой кристаллизуется данное вещество (структурный тип NaCl или CsCl), рассчитайте ионный радиус катиона, изобразите элементарную ячейку, укажите координационное число.
| № п/п | Соединение | Радиус аниона R · 10-10, м | Плотность, г/см3 | Ребро куба a · 10-10, м | № п/п | Соединение | Радиус аниона R · 10-10, м | Плотность, г/см3 | Ребро куба a · 10-10, м |
| 21 | AgCl | 1.81 | 5.56 | 5.55 | 31 | LiF | 1.33 | 2.63 | 4.03 |
| 22 | KF | 1.33 | 249 | 5.34 | 32 | ТiCl | 1.81 | 7.00 | 3.86 |
| 23 | PbS | 1.85 | 7.50 | 5.92 | 33 | CaS | 1.85 | 2.61 | 5.68 |
| 24 | КСl | 1.81 | 1.98 | 6.29 | 34 | MnO | 1.40 | 5.44 | 4.44 |
| 25 | AgF | 1.33 | 5.85 | 5.24 | 35 | CdO | 1.40 | 8.15 | 4.70 |
| 26 | CsBr | 1.96 | 4.44 | 4.30 | 36 | CsH | 1.36 | 3.42 | 6.39 |
| 27 | LiCl | 1.81 | 2.07 | 5.14 | 37 | TiI | 2.19 | 7.29 | 4.21 |
| 28 | RbF | 1.33 | 3.87 | 5.64 | 38 | TiO | 1.40 | 5.52 | 4.25 |
| 29 | CsI | 2.19 | 4.51 | 4.57 | 39 | MgS | 1.85 | 2.66 | 5.20 |
| 30 | RbCl | 1.81 | 2.76 | 6.55 | 40 | TiBr | 1.95 | 7.56 | 3.98 |
В задачах (41 - 60) определите структурный тип соединения (CsCl, NaCl или ZnS) по приведенным ниже экспериментальным данным, изобразите элементарную ячейку, укажите координационное число ионов или атомов
| № п/п | Соединение | R катиона · 10-10, м | R аниона · 10-10, м | Плотность, г/см3 | |
| 41 | CuBr | 0,60 | 1,95 | 5,826 | |
| 42 | AuZn | 1,42 | 1,32 | 13,81 | |
| 43 | MnS | 0,80 | 1,85 | 3,99 | |
| 44 | АlР | 1,30 | 1,0 | 2,40 | |
| 45 | SnSb | 1,90 | 1,50 | 6,90 | |
| 46 | CoAl | 1,35 | 1,25 | 6,12 | |
| 47 | SiC | 1,10 | 0,70 | 3,27 | |
| 48 | CuPd | 1,24 | 1,34 | 10,8 | |
| 49 | SrTe | 1,12 | 2,20 | 4,84 | |
| 50 | CuCl | 0,60 | 1,81 | 5,823 | |
| 51 | NiAl | 1,35 | 1,25 | 6,05 | |
| 52 | RbBr | 1,47 | 1,95 | 3,40 | |
| 53 | CdTe | 0,78 | 2,20 | 6,356 | |
| 54 | NaF | 0,97 | 1,33 | 2,558 | |
| 55 | CuBe | 1,24 | 1,07 | 6,09 | |
| 56 | CdS | 0,78 | 1,85 | 4,82 | |
| 57 | CoO | 0,72 | 1,40 | 6,43 | |
| 58 | ZnTe | 1,32 | 2,20 | 6,34 | |
| 59 | NbN | 0,72 | 1,46 | 8,4 | |
| 60 | MgO | 0,66 | 1,40 | 3,58 | |
Диаграммы плавкости
Построить в условных кривых схему диаграммы плавкости для 2-х компонентов, образующих систему эвтектических сплавов. Дать анализ областей диаграммы по правилу фаз Гиббса.
| № вар. | Компонент системы | Температура плавления компонентов, °С | Эвтектика | |||
| 1 | 2 | 1 | 2 | Температура плавления, °С | Содержание 2-го компонента, % | |
| 1 | Sn | Zn | 232 | 419.5 | 200 | 9 |
| 2 | Pb | Sb | 327 | 633 | 250 | 13 |
| 3 | Tl | Au | 303,6 | 1063 | 120 | 28 |
| 4 | Cd | Bi | 321 | 271 | 146 | 61 |
| 5 | Ag | Ge | 960 | 959 | 651 | 19 |
| 6 | Al | Ge | 660 | 959 | 424 | 53 |
| 7 | Au | Ge | 1063 | 959 | 356 | 12 |
| 8 | Au | Si | 1063 | 1420 | 370 | 6 |
| 9 | Be | Si | 1280 | 1420 | 1090 | 61 |
| 10 | Sn | Bi | 232 | 271 | 139 | 57 |
Построить в условных кривых схему диаграммы плавкости для 2-х компонентов, образующих систему твердых растворов. Дать анализ областей диаграммы по правилу фаз Гиббса.
| № вар. | Компонент системы | Температура плавления компонентов, °С | Температура для 50%-го сплава, °С | |||
| 1 | 2 | 1 | 2 | Начала кристаллизации | Конца кристаллизации | |
| 11 | Cu | Ni | 1083 | 1452 | 1310 | 1250 |
| 12 | Au | Pt | 1063 | 1769 | 1500 | 1280 |
| 13 | Bi | Sb | 271 | 630 | 520 | 330 |
| 14 | Ge | Si | 940 | 1414 | 1280 | 1120 |
| 15 | Ag | Au | 960 | 1063 | 1020 | 1000 |
| 16 | Ag | Pd | 960 | 1552 | 1340 | 1290 |
| 17 | V | Ta | 1920 | 2996 | 2630 | 2350 |
Дата добавления: 2019-01-14; просмотров: 257; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
