Добавьте в раствор №1 25 мл воды. Рассчитайте концентрацию раствора №2
Г
Лабораторная работа № 1
Тема: Приготовление раствора заданной концентрации
Цель работы:
1. Научиться рассчитывать и готовить растворы заданной концентрации.
2. Познакомиться с основными приемами взвешивания, с устройством весов.
Оборудование и реактивы: Весы, разновесы, стеклянные палочки. мерные колбы на 200 мл, 250 мл, хлорид натрия (поваренная соль), вода.
Методика приготовления растворов
Приготовление растворов является одной из важнейших операций в химической практике. Одним из основных растворителей в химическом анализе является вода. Вода используется только дистиллированная, так как обычная питьевая вода содержит помимо солей жесткости ряд органических соединений, растворенный в воде углекислый газ, хлор и соединения хлора, образовавшиеся в результате хлорирования воды.
Чаще всего растворы готовят из рассчитанных количеств отдельных компонентов. При этом обычно твердые вещества берут по массе, а жидкие - по объему. Для приготовления растворов приблизительной концентрации навеску вещества берут на технохимических весах, требуемый объем растворителя отмеривают с помощью мерного цилиндра. Растворение ведут в стакане или колбе, в которой предполагается хранить раствор.
Массу растворяемого вещества, необходимую для приготовления определенного количества раствора заданной концентрации (ω %), рассчитывают по формулам:
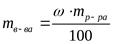 или
или 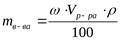
|
|
|
где mр-ра - масса раствора, г; Vр-ра - объем раствора, мл; ρ - его плотность, г/мл
В первом случае массу воды, которая требуется для приготовления заданного раствора, определяют по разности: mводы =mр-ра - mв-ва
Если для растворения применяют твердое вещество, содержащее кристаллизационную воду, то его массу находят по формуле:
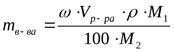
где М1 и М2 - молекулярные массы кристаллогидрата и безводного вещества соответственно.
Часть 1 Расчеты по приготовлению растворов
Пример 1.Какую массу соли надо добавить к 200 мл воды, чтобы получить 3 %-ный раствор?
Решение: Для решения поставленной задачи воспользуемся формулой:
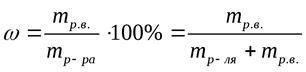
Массу растворителя найдем по формуле: mводы=Vводы· ρ = 200 г∙ 1 г/мл = 200г. Таким образом, остается одно неизвестное - масса растворенного вещества. Подставив известные величины в уравнение для массовой доли, получим 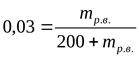 . , Отсюда mр.в.= 6,2 г.
. , Отсюда mр.в.= 6,2 г.
Пример 2. Сколько готового 3 %-го раствора и воды нужно взять для получения 250г 2%-го раствора?
Весовое
 3%
3%  2 вес. ч.
2 вес. ч.

 2%
2%
 |
0% 1 вес. ч.
|
|
|
Из схемы видно, что необходимо взять 2 вес.частей 3%-ного раствора и 1 вес.часть воды, что составляет 250г х 2 вес.ч. / 3 вес.ч.= 166,7г раствора соли и 83,3г воды.
Пример 3. Приготовить 100 г 14%-ного раствора NaCl из 22%-ного (р=1,168 г/мл) и 10%-ного (р = 1,073 г/мл) растворов этой соли:
Решение: Весовое соотношение исходных растворов находим по правилу смешения (креста):
10%  8 вес. ч.
8 вес. ч.


 14%
14%
 |
22% 4 вес. ч.
Из схемы видно, что необходимо взять 8 вес.частей 10%-ного и 4 вес.части 22%-ного растворов для получения 100г раствора. Таким образом, 1 весовая часть будет составлять 8,333 (100/(8+4)= 8,333). Т.е. нужно взять 66,7 г 10%-ного раствора (8∙ 8,333 =66,7) и 33,3 г 14%-ного раствора (4∙ 8,333 =33,3). Разделив массы растворов на их плотности, получим: для приготовления 100 г требуемого 14%-ного раствора NaCl требуется: 62 мл 10 %-ного и 28,5 мл 22 %-ного растворов.
Часть 2.
Взвешиванием называют сравнение массы данного тела с массой гирь, масса которых известна и выражена в определенных единицах (мг, г, кг). Весы являются важнейшим прибором в химической лаборатории, т.к. почти ни одна работа в ней не обходится без определения массы того или иного вещества или тары, в которую помещают взвешиваемое вещество. Для точного взвешивания применяют разнообразные так называемые технохимические и технические весы.
|
|
|
У весов для точного взвешивания имеется арретирное устройство и балансировочные гайки. При помощи арретирного устройства самые ответственные части весов- призмы коромысла и подушки- в нерабочем положении отделяются и не касаются площадок. Это предохраняет призму от износа, а весы от потери чувствительности.
При взвешивании поворотом ручки арретира весы приводят в рабочее состояние.
Точные весы устанавливают стационарно, в определенном месте лаборатории, строго по отвесу, с соблюдением правил указанных в инструкции к ним. Для регулировки положения у весов имеются передние винтовые ножки, которые опираются на круглые металлические подставки с выемками в центре.
Если при опускании арретира весы не будут находиться в равновесии, его добиваются при помощи балансировочных гаек.
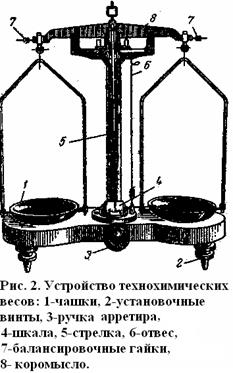
| Для взвешивания на технохимических весах применяют точный разновес. Он представляет собой набор гирь, расположенных в определенном порядке в гнездах специального ящика, имеющего крышку. Граммовые гири точного разновеса по большей части никелированные. Самая крупная гиря в таком разновесе имеет массу 500 г. Кроме граммовых гирь, в разновесе имеются миллиграммовые гири в виде пластинок из алюминия, нейзильбера или никеля. Каждая миллиграммовая гирька имеет загнутый краешек, или ушко, за который берут ее пинцетом, когда кладут на весы или снимают с них. Перед взвешиванием проверяют, правильно ли по отвесу стоят весы, и в противном случае с помощью установочных ножек-винтов добиваются правильной их установки. После этого опускают арретиром коромысло весов и наблюдают колебания стрелки по нижней шкале. Если стрелка при колебании отклоняется от нуля на одно и то же число делений вправо и влево, весами можно пользоваться. |
Если же стрелка отклоняется от нуля в одну сторону более, чем в другую, нужно посмотреть нет ли на чашках весов каких-нибудь загрязнений, чисты ли призмы и гнезда для них. Если же и после устранения этих неполадок стрелка будет отклоняться в одну сторону более, чем в другую, нужно при помощи балансировочных гаек добиться равномерного колебания стрелки, или, как говорят, установить весы на нуль.
|
|
|
По окончании взвешивания с чашек весов удаляют взвешиваемый предмет и немедленно же убирают гири и разновесы, укладывая их в определенном порядке в футляр.
Ход работы
Задание 1. Приготовление раствора из соли.
Вариант
Приготовьте 80 мл 6%-го раствора сульфата меди.
Вариант
Приготовьте 150 мл 13%-го раствора поваренной соли.
Вариант
Приготовьте 110 мл 7 %-го раствора сульфата меди.
Вариант
Приготовьте 100 мл 15%-го раствора поваренной соли.
Вариант
Приготовьте 50 мл 10 %-го раствора поваренной соли.
Вариант
Приготовьте 100 мл 12%-го раствора поваренной соли.
Рассчитайте массу соли и воды, необходимые для приготовления раствора. Взвесьте вещество на весах. Отмерьте мерным цилиндром необходимое количество воды. Смешайте соль и воду в колбе Условия и результаты расчетов запишите в лабораторный журнал.
Задание 2. Разбавление раствора до нужной концентрации.
Добавьте в раствор №1 25 мл воды. Рассчитайте концентрацию раствора №2
Мерным цилиндром отмерьте необходимый объем воды, добавьте отмеренное количество воды в колбу с раствором №1 – получаете раствор №2.
Результаты расчетов запишите в лабораторный журнал.
Задание 3. Увеличение концентрации раствора
Добавьте в раствор №2 5 граммов соли. Какой раствор вы получили? Рассчитайте его концентрацию.
Задание 4. Приготовление рабочего раствора путем смешивания двух растворов разной концентрации
Дата добавления: 2019-01-14; просмотров: 362; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
