Относительная электроотрицательность элементов
Министерство образования и науки Российской Федерации Федеральное государственное автономное образовательное учреждение высшего образования «Российский государственный профессионально-педагогический университет» Институт инженерно-педагогического образования Кафедра металлургии, сварочного производства и методики профессионального обучения
ЗАДАНИЯ И МЕТОДИЧЕСКИЕ УКАЗАНИЯ
К ВЫПОЛНЕНИЮ КОНТРОЛЬНЫХ РАБОТ
ПО ДИСЦИПЛИНЕ «ХИМИЯ»
для студентов всех форм обучения
направления подготовки 44.03.04 Профессиональное обучение (по отраслям)
Екатеринбург
РГППУ
2016
Задания и методические указания к выполнению контрольных работ по дисциплине «Химия». Екатеринбург: ФГАОУ ВО «Российский государственный профессионально-педагогический университет», 2016. 73 с.
Задания и методические указания к выполнению контрольных работ по дисциплине «Химия» предназначены для студентов всех форм обучения направления подготовки 44.03.04 Профессиональное обучение (по отраслям).
Они включают основной теоретический материал по всем темам курса химии, примеры решения задач, контрольные задания и необходимые справочные данные.
| Авторы: | канд.хим.наук, доц. | Г.В. Харина |
| канд.хим.наук, доц. | М.В. Слинкина |
Одобрены на заседании кафедры металлургии, сварочного производства и методики профессионального обучения. Протокол от 16.10.2015 г. № 2.
|
|
|
| Заведующий кафедрой металлургии, сварочного производства и методики профессионального обучения | Б.Н. Гузанов |
Рекомендованы к печати методической комиссией института инженерно-педагогического образования РГППУ. Протокол от 09.11.2015 г. № 3.
| Председатель научно-методической комиссии института ИПО | А.О. Прокубовская | |
© ФГАОУ ВО «Российский государственный профессионально-педагогический университет», 2016
| © Слинкина М.В., Харина Г.В., 2016 |
Содержание
Введение. 4
1. МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПО ОСНОВНЫМ РАЗДЕЛАМ КУРСА ХИМИИ 5
1.1. Электронное строение атома. 5
Примеры решения задач. 7
1.2. Периодический закон и периодическая система Д.И. Менделеева. 9
Примеры решения задач. 11
1.3. Химическая связь. 12
Примеры решения задач. 14
1.4. Классы неорганических соединений. 16
Примеры решения задач. 17
1.5. Элементы химической термодинамики и термохимии. 20
Примеры решения задач. 22
1.6. Химическая кинетика и химическое равновесие. 24
Примеры решения задач. 26
1.7. Электролитическая диссоциация. Реакции ионного обмена. 28
Примеры решения задач. 31
|
|
|
1.8. Растворы. Способы выражения концентрации растворов. 32
Примеры решения задач. 33
1.9. Коллоидные растворы.. 34
Примеры решения задач. 36
1.10. Растворы неэлектролитов. 37
Примеры решения задач. 39
1.11. Окислительно-восстановительные реакции. 40
Примеры решения задач. 41
1.12. Электрохимические процессы в гетерогенных системах. 42
Гальванические элементы.. 42
Примеры решения задач. 44
1.13. Коррозия металлов. 45
Примеры решения задач. 46
1.14. Электролиз. 48
Примеры решения задач. 50
1.15. Свойства и получение полимеров. 52
2. КОНТРОЛЬНЫЕ ЗАДАНИЯ.. 54
3. ВАРИАНТЫ КОНТРОЛЬНЫХ ЗАДАНИЙ.. 70
ЛИТЕРАТУРА.. 73
Введение
Самостоятельная работа студента над курсом химии предусматривает изучение программного теоретического материала по лекциям, учебникам и учебным пособиям, выполнение индивидуальной контрольной работы, подготовку к лабораторному практикуму и экзамену (зачету).
Контрольная работа по курсу химии выполняется по индивидуальному варианту, включающему 10 задачдля студентов заочной формы обучения и
20 задач для студентов дневной формы обучения. К выполнению контрольной работы следует приступать только после изучения и усвоения теоретической части курса. Изучать курс химии рекомендуется по отдельным темам, причем пока не усвоена предыдущая тема, не следует переходить к изучению последующей. Далее следует разобраться с типовыми задачами по изучаемой теме, решение которых приведено в конце каждого подраздела методических указаний. Если эти задачи не вызывают у Вас затруднений, то тогда можно смело обратиться к решению задачи, предложенной в индивидуальной контрольной работе.
|
|
|
Обратите внимание на решение расчетных задач: оно обязательно должно включать в себя уравнения химических реакций, математические выражения законов (или принципов), которые используются для расчетов, физический смысл всех величин, входящих в эти выражения, и числовые значения используемых констант. При решении задач необходимо поэтапно приводить все математические преобразования и только потом уже давать окончательный числовой ответ.
Контрольную работу следует выполнить в отдельной тетради в 12 листов. На титульном листе необходимо указать номер варианта, который для студентов заочной формы обучения соответствует двум последним цифрам номера студенческого билета или зачетной книжки. Студентам дневной формы обучения вариант контрольной работы выдается преподавателем, который и устанавливает требования к ее выполнению. Студенты всех форм обучения при оформлении работы сначала должны записать номер задачи и ее полное условие и только после этого изложить подробный ход решения.
|
|
|
Контрольная работа студентов заочной формы обучения должна быть аккуратно оформлена, датирована, подписана студентом и представлена в университет на рецензирование не позднее, чем за две недели до начала сессии. Контрольная работа, выполненная с ошибками, возвращается студенту. Ее следует доработать с учетом всех замечаний, сделанных преподавателем. Все необходимые исправления следует выполнять только в конце работы под заголовком «Работа над ошибками», исправления в тексте не допускаются.
Контрольная работа, выполненная студентом по другому варианту, на рецензирование не принимается.
1. МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ОСНОВНЫМ РАЗДЕЛАМ КУРСА ХИМИИ
Электронное строение атома
Согласно представлениям квантовой механики электрон имеет двойственную природу: он ведет себя и как частица, и как волна. Электрон в атоме не имеет траектории движения. Квантовая механика рассматривает вероятность нахождения электрона в пространстве вокруг ядра.
Пространство вокруг ядра, в котором наиболее вероятно нахождение электрона, называется атомной орбиталью (АО).
Состояние электронов в атоме определяется энергией взаимодействия электронов с ядром. Эта энергия квантована, т.е. ее величина не может быть любой, а принимает лишь определенные значения, зависящие от некоторых величин n, l, ml, которые называются квантовыми числами. Поэтому атомная орбиталь – это энергетическое состояние электрона, для которого определены значения n, l иml..
Главное квантовое число (n) характеризует уровень энергии электронов (энергетический уровень): чем больше значение n, тем больше энергия соответствующего уровня и средний размер электронного облака. Главное квантовое число принимает целочисленные значения: n = 1, 2, 3 …
Своими значениями главное квантовое число нумерует энергетические уровни, на которых могут находиться электроны в атоме. Число заполняемых электронами энергетических уровней в атоме численно равно номеру периода, в котором находится элемент: у атомов элементов первого периода – один энергетический уровень, второго периода – два и т.д. Каждый энергетический уровень (кроме первого) расщепляется на несколько энергетических подуровней. Эти подуровни энергий определяются орбитальным квантовым числом (l), которое характеризует также форму атомной орбитали. Орбитальное квантовое число принимает значения от 0 до (n – 1): l = 0, 1, 2, 3 … (n – 1).
В зависимости от величины l подуровни энергий различаются по типам, которые обозначаются латинскими буквами. Величине l = 0 соответствует s – подуровень, 1 – p, 2 – d, 3 – f. Чем больше значение l, тем выше энергия соответствующего подуровня в пределах одного и того же энергетического уровня.
1-й уровень (n=1, l = 0) имеет s – подуровень (1s); 2-й уровень (n=2, l = 0,
l = 1) имеет s– и p– подуровни (2s 2p); 3-й уровень (n=3, l = 0, l = 1, l = 2) имеет
s–, p– и d–подуровни (3s3p3d) и т.д.
Магнитное квантовое число (ml) характеризует пространственную ориентацию атомной орбитали. Его значения зависят от величины орбитального квантового числа: ml = – l … 0 … + l . Например, для l = 1 (р – подуровень),
ml = -1, 0, 1. Число значений, принимаемых ml, определяет число АО на данном подуровне. То есть на р-подуровне имеется 3АО , которым соответствуют три различных ориентации в пространстве, на s – подуровне (l = 0, ml = 0)– 1АО, на d (l =2, ml = -2,-1, 0, 1, 2) – 5АО и на f (l =3, ml = -3 -2,-1, 0, 1, 2, 3) – 7АО.
|
|
Для условного изображения АО принят символ квадрата называемый квантовой или электронной ячейкой.
Электрон имеет собственный магнитный и механический моменты, которые объединили общим названием «спин», и в связи с этим ввели четвертое квантовое число ms − спиновое число, принимающее всего два значения: + ½ (↑) и – ½ (↓).
Порядок заполнения электронами энергетических уровней и подуровней подчиняется следующим правилам.
Принцип минимума энергии заключается в том, что заполнение электронами энергетических подуровней происходит в порядке возрастания их энергии. Так как энергия электронов на подуровнях главным образом определяется квантовыми числами n и l, то в первую очередь электроны заполняют подуровень, характеризующийся наименьшей суммой (n + l). Если для двух энергетических подуровней (n + l) одинакова, то прежде всего заполняется подуровень с меньшим значением n. Эти утверждения выражает правило Клечковского, с учетом которого последовательность заполнения электронами энергетических подуровней может быть представлена в виде следующего ряда: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d ≈ 4f < 6p < 7s < 6d ≈ 5f …
Принцип Паули определяет максимальное число электронов на атомной орбитали, которое не может быть больше двух: в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел. Поэтому если на атомной орбитали появляется второй электрон, то он будет иметь спиновое квантовое число противоположного знака. Принцип Паули позволяет определить максимальное число электронов (ē) на каждом энергетическом подуровне:
s – подуровень – 2 ē (s2); p – подуровень – 6 ē (p6); d – подуровень – 10 ē (d10);
f – подуровень – 14 ē (f14).
| ↑ | ↑ | ↑ | ↑ | ↑ |
Правило Гунда определяет порядок заполнения атомных орбиталей в пределах данного энергетического подуровня: атомные орбитали заполняются так, чтобы суммарное спиновое квантовое число электронов на подуровне было максимальным. Например, заселение вакантных d-АО пятью электронами возможно в только одним способом, отвечающим наименьшей энергии основного состояния d5:
Распределение электронов по различным АО называется электронной конфигурацией (электронной формулой) атома. Например, электронная конфигурация атома кислорода 1s2 2s2 2p4 , а атома натрия – 1s2 2s2 2p63s1.
В электронной конфигурации энергетические уровни обозначаются цифрами 1, 2, 3. Каждому энергетическому уровню соответствует определенное квантовое число n = 1, 2, 3 … Энергетические подуровни обозначаются буквенными символами s, p, d, f . Каждый подуровень имеет соответствующее значение орбитального квантового числа l: s – 0, p – 1, d – 2, f – 3. Число электронов, находящихся на подуровне, изображается верхним индексом у буквенного символа, например, 1s2.
При составлении электронной конфигурации необходимо пользоваться Периодической системой Д.И. Менделеева, которая отражает электронное строение атома элемента (см. примеры решения задач).
Строение внешнего энергетического уровня, определяет химические свойства атома – способность принимать или отдавать электроны. Вступая в химическое взаимодействие, атом стремится приобрести наиболее устойчивую конфигурацию внешнего уровня – конфигурацию ближайшего к нему инертного газа: двухэлектронную – ns2 (типа He) или восьмиэлектронную – ns2np6(любого другого газа). Атомы, которые отдают свои электроны другим атомам при химическом взаимодействии, превращаясь в положительно заряженные ионы, проявляют металлические или восстановительные свойства. Атомы, которые принимают электроны, превращаясь в отрицательно заряженные ионы, проявляют неметаллические или окислительные свойства. Заряд образующегося иона называется степенью окисления. В Периодической системе Д.И. Менделеева все элементы делятся на металлы, неметаллы и химически инертные благородные газы (8 группа, главная подгруппа). К металлам относятся s – элементы (элементы, у которых последним заполняется s – подуровень внешнего уровня), кроме водорода и гелия; все d - и f – элементы (у них последними заполняются d – подуровень второго снаружи уровня и f – подуровень третьего снаружи уровня, соответственно); а также некоторые p – элементы (у них последним заполняется p – подуровень внешнего уровня). Среди p – элементов металлы отделены от неметаллов диагональю, проходящей от B к At, и лежат ниже этой диагонали.
Примеры решения задач
Пример 1. Какой из подуровней: 4d или 5s заполняется электронами в первую очередь?
Р е ш е н и е . Последовательность заполнения электронами подуровней в атоме определяется правилом Клечковского, которое предполагает сравнение значений суммы (n + l) для каждого из подуровней. Следовательно, надо определить сумму квантовых чисел n и l для данных подуровней: для 4d – подуровня n = 4, l = 2, n + l = 6; для 5s – подуровня n = 5, l = 0, n + l = 5. В первую очередь будет заполняться 5s – подуровень, так как для него значение (n + l) меньше, чем для 4d– подуровня, то есть 5s – подуровень имеет меньшее значение энергии, чем 4d– подуровень, а заполнение подуровней электронами происходит в порядке возрастания их энергии.
Пример 2. Запишите электронную конфигурацию и электронную схему строения внешнего уровня атома элемента с зарядом ядра, равным +33. Определите, какими химическими свойствами обладает атом этого элемента.
Р е ш е н и е. 1) Определим, атом какого элемента имеет Z = +33. Так как заряд ядра атома равен порядковому номеру N элемента в Периодической системе, то элементом с N = 33 является мышьяк (As).
2) Запишем электронную конфигурацию атома As (рассмотрим распределение электронов по энергетическим уровням и подуровням). Для этого определим координаты данного элемента в Периодической системе, т.е. номер периода (арабская цифра) и номер группы (римская цифра). Группы делятся на две подгруппы – главную (обозначают символом «А») и побочную (обозначают символом «В»). Номер периода равен числу энергетических уровней в атоме, а номер группы – числу электронов на внешнем уровне (валентных электронов). Координаты As: (4, VА) т.е. элемент расположен в четвертом периоде (атом имеет четыре энергетических уровня); в пятой группе (имеет пять электронов на внешнем уровне) и главной подгруппе (р – элемент).
Число электронов в атоме равно заряду его ядра, следовательно, электронная оболочка As содержит 33 электрона. Распределение электронов по энергетическим уровням и подуровням проводим в соответствии с порядком их заполнения, учитывая максимальное число электронов на каждом подуровне: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4s2 4p3
В электронной конфигурации выделим строение внешнего уровня, на котором находятся валентные электроны, способные участвовать в химическом взаимодействии – 4 s 2 4 p 3.
3) Изобразим электронную схему строения внешнего уровня, которая характеризует распределение электронов по энергетическим уровням, подуровням и атомным орбиталям, руководствуясь принципом Паули и правилом Гунда:
| ↑ | ↑ | ↑ |
4p
| ↑↓ |
4s
4) Определим химические свойства атома As.
Химические свойства атома определяются строением внешнего энергетического уровня. Вступая в химическое взаимодействие, любой атом стремится завершить внешний уровень. Атом As имеет 5 валентных электронов, поэтому завершение внешнего уровня возможно за счет присоединения трех электронов. Принимая их, атом мышьяка проявляет окислительные свойства:
As 0 + 3ē = As 3-
4 s2 4 p3 4 s2 4 p6
Атом мышьяка может проявлять восстановительные свойства, отдавая электроны внешнего уровня - три или все пять:
As0 - 3ē = As3+ As0 - 5ē = As5+
4s2 4p3 4s2 4s2 4p3 3s2 3p6 3d10
Пример 3. Электронная конфигурация атома имеет вид: [ Kr ] 4 d 2 5 s 2. Определите, какой это элемент, и какие химические свойства проявляет атом этого элемента.
Р е ш е н и е. 1) Определим координаты атома данного элемента в Периодической системе Д.И. Менделеева. Из электронной конфигурации атома видно, что главное квантовое число внешнего энергетического уровня равно пяти (n = 5), т.е. атом имеет пять энергетических уровней, следовательно, элемент расположен в 5-м периоде. Число валентных электронов равно четырем, значит, элемент расположен в IV группе. Так как незавершенным является d– подуровень (т.е. он заполняется последним), то мы имеем дело с d- элементом, а все d- элементы расположены в Периодической системе Д.И. Менделеева в побочных подгруппах. Таким образом, элемент (Э) имеет следующие координаты: Э (5, IVВ). Как видно из Периодической системы, этот элемент – цирконий (Zr).
2) Установим химические свойства атома циркония.
Вспомним, что все d – элементы являются металлами. Значит, атом циркония проявляет восстановительные свойства и способен только отдавать свои валентные электроны, превращаясь в положительно заряженный ион со степенью окисления +4:
Zr 0 – 4ē = Zr 4+
1.2. Периодический закон и периодическая система Д.И. Менделеева
Современная формулировка Периодического закона : свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины зарядов ядер их атомов.
Физический смысл Периодического закона состоит в том, что с возрастанием заряда ядра происходит периодическое повторение сходного строения внешнего энергетического уровня атомов элементов. В соответствии с этим физические и химические свойства атомов элементов периодически повторяются.
Периодическая система является графическим выражением Периодического закона. Все элементы в Периодической системе расположены в виде горизонтальных и вертикальных рядов, называемых периодами и группами.
Период – это горизонтальная последовательность элементов, в атомах которых происходит заполнение электронами одинакового числа энергетических уровней. Номер периода определяет число энергетических уровней в атомах элементов данного периода и соответствует значению главного квантового числа внешнего энергетического уровня
Группа - это вертикальная последовательность химических элементов. Номер группы указывает на число валентных электронов, т.е. тех, которые могут участвовать в образовании химической связи. В одну группу объединяются элементы с одинаковым числом валентных электронов независимо от их электронного типа (s-, p-, d-, f-). Номер группы совпадает с высшей валентностью элемента в возбужденном состоянии и отвечает высшей положительной степени окисления атомов (кроме F , O и Br).
Каждая группа состоит из двух подгрупп – главной и побочной. В главную подгруппу входят s- и р- элементы, а в побочную – d- элементы. То есть в каждой подгруппе объединены элементы, атомы которых имеют сходное строение валентного уровня. Такие элементы называют электронными аналогами.
Важнейшие характеристики атома, которые изменяются периодически от величины заряда ядра и в конечном итоге определяют химические свойства элементов и их соединений, – это радиус атома, энергия ионизации, энергия сродства к электрону и электроотрицательность.
Эффективный радиус атома ( r ат ) принимают равным половине межъядерного расстояния в молекулах или кристаллах соответствующих простых веществ. В пределах одного периода (при движении слева направо) при неизменном числе энергетических уровней заряд ядра атома увеличивается. Это приводит к возрастанию силы электростатического притяжения валентных электронов к ядру, вследствие чего происходит сжатие орбиталей, т.е. атомный радиус уменьшается. Внутри группы (при движении сверху вниз) заряд ядра атома и число энергетических уровней возрастают. Вследствие проявления эффекта экранирования (защиты валентных электронов от влияния ядра атома электронами внутренних энергетических уровней) силы электростатического притяжения между ядром и валентными электронами уменьшаются, и радиус атома увеличивается.
Энергия ионизации (Еи) – это энергия, необходимая для отрыва одного электрона от невозбужденного атома. Еи является количественной характеристикой восстановительных свойств атомов. Чем меньше величина Еи, тем сильнее восстановительные свойства атома.
Энергия сродства к электрону (Ее) – это энергия, которая выделяется при присоединении электрона к нейтральному атому. Ее характеризует окислительные свойства атомов. С увеличением энергии сродства к электрону окислительная способность атома повышается.
Электроотрицательность (ЭО) – это способность атома в молекуле притягивать к себе чужие электроны, участвующие в образовании химической связи. ЭО = (Еи + Ее) / 2.
В настоящее время используется шкала относительных электроотрицательностей, в которой ЭО атома фтора, как самого сильного окислителя, условно принята равной 4 (табл.1). При образовании молекулы электроны смещаются от атома с меньшей ЭО к атому с большей ЭО. Внутри периодов наблюдается общая тенденция роста ЭО атомов, а в группах – ее падение.
Химические свойства атома зависят от конфигурации внешнего энергетического уровня, r ат, Еи, и Ее. В пределах периода (слева направо) r ат уменьшается, Еи, и Ее повышаются. В результате способность атомов к отдаче электрона уменьшается, а к присоединению электрона увеличивается. Таким образом, в периоде металлические свойства атомов элементов ослабляются, а неметаллические – усиливаются. В главной подгруппе (сверху вниз) r ат увеличивается, а Еи уменьшается, в результате способность атомов отдавать свои электроны повышается, а способность принимать чужие электроны снижается. Таким образом, в главной подгруппе металлические свойства атомов элементов усиливаются, а неметаллические ослабевают.
В периоде с ростом степени окисления основные свойства гидроксидов ослабевают, а кислотные свойства усиливаются. В подгруппах (сверху вниз) кислотные свойств кислородсодержащих соединений ослабевают, а основные свойства увеличиваются. Так, La ( OH )3 значительно более сильное основание, чем Al ( OH )3; H 3 AsO 3 более слабая кислота, чем HNO 3.
Таблица 1
Относительная электроотрицательность элементов
|
Периоды | Группы | ||||||
| I | II | III | IV | V | VI | VII | |
| 1 | H 2,1 | ||||||
| 2 | Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 |
| 3 | Na 0,9 | Mg 1,2 | Al 1,6 | Si 1,8 | P 2,1 | S 2,5 | Cl 3,0 |
| 4 | K 0,8 | Ca 1,0 | Ga 1,6 | Ge 1,8 | As 2,0 | Se 2,4 | Br 2,8 |
| 5 | Rb 0,8 | Sr 1,0 | In 1,7 | Sn 1,8 | Sb 1,9 | Te 2,1 | I 2,5 |
| 6 | Cs 0,7 | Ba 0,9 | Tl 1,8 | Pb 1,6 | Bi 1,9 | Po 2,0 | At 2,2 |
Примеры решения задач
Пример 1. Объясните, почему алюминий и скандий находятся в одной группе, но в разных подгруппах?
Р е ш е н и е. 1) Запишем электронные конфигурации атомов и выделим валентные уровни: Al 1 s 2 2 s 2 2 p 6 3s2 3p1
Sc 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4s2 3d1
2) Обоснуем расположение элементов Al и Sc в одной группе, но в разных подгруппах. Атомы алюминия и скандия имеют одинаковое число валентных электронов – три. Следовательно, Al и Sc – это элементы одной группы (III). Однако характер заполнения валентного уровня у этих атомов различен. Алюминий – это p – элемент, у него последним заполняется p – подуровень внешнего энергетического уровня, поэтому валентными являются электроны 3 s 2 3 p 1. Скандий – это d- элемент, у которого в последнюю очередь заполняется d– подуровень предпоследнего энергетического уровня, поэтому валентные электроны – 4 s 2 3 d 1. Именно это является причиной расположения атомов Al и Sc в разных подгруппах: Al (IIIА) – в главной, а Sc (IIIB) – в побочной подгруппе.
Пример 2. Руководствуясь положением элементов в Периодической системе, определите, какой из атомов – сера или теллур проявляет более сильные неметаллические свойства.
Р е ш е н и е. 1) Определяем координаты этих элементов в Периодической системе: S (3, VIA) и Те (5, VIA), т.е. эти элементы являются электронными аналогами, так как расположены в одной (главной) подгруппе VI группы.
2) Составляем электронные формулы атомов этих элементов и выделяем строение внешних уровней (именно они ответственны за химические свойства любого атома):
S – 1 s 2 2 s 2 2 p 6 3s2 3p4 , Те – 1 s 2 2 s 2 3 s 2 Зр6 3 d 10 4 s 2 4р6 4 d 10 5s2 5р4
Действительно, атомы S и Те имеют сходное строение внешнего уровня, который можно представить в виде ns2 n р4 , т.е. на внешнем уровне находится 6 валентных электронов.
3) Сравним неметаллические свойства атомов S и Те. Неметаллические свойства определяются способностью атома присоединять электроны при их химическом взаимодействии. Неметаллические свойства атомов зависят от конфигурации внешнего уровня, радиуса атома (гат) и величины энергии сродства к электрону (Ее).
Как уже отмечалось, элементы S и Те расположены в одной группе, имеют сходное строение внешнего уровня - ns2 n р4. Однако атом S имеет три энергетических уровня, а атом Те – пять, поэтому валентные электроны у S расположены ближе к ядру. Радиус атома S меньше, чем радиус атома Те, а энергия сродства к электрону больше, чем Ее атома Te (в главной подгруппе сверху вниз гат увеличивается, а Ее уменьшается). Поэтому атом S обладает большей способностью присоединять электроны. Следовательно, атом S по сравнению с атомом Те проявляет более сильные неметаллические свойства.
Пример 3. Руководствуясь Периодической системой, определите какой из элементов – магний или алюминий обладает более выраженными металлическими свойствами.
Р е ш е н и е. 1) Химические свойства элементов определяются электронным строением внешних уровней их атомов. Запишем электронные конфигурации атомов магния и алюминия. Они расположены в третьем периоде (имеют одинаковое число энергетических уровней, равное трем). Магний – элемент второй группы, имеет два валентных ē. Алюминий – элемент третьей группы, имеет три валентных ē. Оба элемента расположены в главных подгруппах, т.е. все валентные электроны находятся на внешнем уровне. Отсюда электронные конфигурации внешних уровней: Mg 2s2, Al 3s23p1.
2) Сравним металлические свойства атомов этих элементов – способность отдавать электроны при химическом взаимодействии. Металлические свойства зависят от конфигурации внешнего уровня, радиуса атома (rат) и энергии ионизации (Еи). Магний и алюминий находятся в одном периоде. При переходе от Mg к Al происходит увеличение заряда ядра и числа ē на внешнем уровне, которые все сильнее удерживаются ядром атома вследствие уменьшения rат. При этом Еи возрастает и способность атома к отдаче электронов уменьшается. Следовательно, магний обладает более сильными металлическими свойствами, чем алюминий.
1.3. Химическая связь
Выделяют три типа химической связи: ковалентную, ионную и металлическую.
Ковалентная связь – химическая связь, осуществляемая общими электронными парами. В соответствии с методом валентных связей (ВС) ковалентная связь между двумя атомами осуществляется общей для этих атомов парой электронов с противоположными спинами. В момент образования связи атомные орбитали перекрываются, что приводит к увеличению электронной плотности между ядрами взаимодействующих атомов и к взаимному притяжению ядер к области повышенной электронной плотности. В результате этого происходит выделение энергии и потенциальная энергия системы уменьшается.
Общая для двух атомов электронная пара может образовываться по двум механизмам: обменному или донорно-акцепторному.
При обменном механизме два связываемых атома (А и В) предоставляют для образования связи по одному неспаренному электрону, как бы обмениваясь ими:
| ↑ |
| ↑↓ |
| ↓ |
А +В → А В А
Донорно-акцепторный механизмобразования связи заключается в том, что один атом А (донор) на образование связи предоставляет пару электронов, а другой атом В (акцептор) – вакантную атомную орбиталь.
Различают две разновидности ковалентной связи: неполярную и полярную.
Ковалентная неполярная связь – это связь, при которой область повышенной электронной плотности расположена симметрично относительно ядер обоих атомов. Такая связь образуется между атомами с одинаковой электроотрицательностью (ЭО), например, в молекулах Cl 2 , O 2 , H 2 и др.
Ковалентная полярная связь – это связь, при которой область повышенной электронной плотности смещена к ядру атома с большей ЭО. В результате этот атом приобретает эффективный отрицательный заряд, а на другом менее электроотрицательном атоме возникает равный по величине эффективный положительный заряд. Такая система представляет собой электрический диполь. Полярная связь образуется между атомами с разной ЭО, например, в молекулах HCl , HI , H 2 O , H 2 S , CO и др. Чем больше разность электроотрицательностей атомов, образующих связь (∆ЭОА – В), тем выше полярность связи.
Важнейшие свойства ковалентной связи – насыщаемость и направленность. Насыщаемость – это способность атомов образовывать ограниченное число ковалентных связей. В случае обменного механизма число связей равно числу неспаренных валентных электронов атома. Способность атома к образованию химических связей характеризуется валентностью.
Валентность определяется как число химических связей, которыми данный атом соединен с другими атомами. Она зависит от того, в каком состоянии - основном или возбужденном находится атом. Основное состояние – это устойчивое состояние с наименьшей энергией. При возбуждении спаренные валентные электроны разъединяются и переходят с одного подуровня на свободные АО другого, энергетически более высокого подуровня в пределах внешнего энергетического уровня. В результате число неспаренных электронов увеличивается, и атом данного элемента образует максимально возможное для него число химических связей, проявляя при этом высшую валентность и высшую положительную степень окисления, равную номеру группы в Периодической системе (см. примеры решения задач).
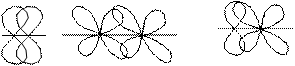
Ковалентная связь имеет направленность, которая обусловливает пространственную структуру молекулы, т.е. ее геометрическую форму. В зависимости от способа перекрывания АО различают σ (сигма)- , π (пи)- и
δ (дельта)- связи.
 σ – связь обладает осевой симметрией относительно межъядерной оси, и область перекрывания АО лежит на межъядерной оси. Ее могут образовывать s – АО, p – АО и d – АО. Именно σ – связи определяют пространственную конфигурацию молекул:
σ – связь обладает осевой симметрией относительно межъядерной оси, и область перекрывания АО лежит на межъядерной оси. Ее могут образовывать s – АО, p – АО и d – АО. Именно σ – связи определяют пространственную конфигурацию молекул:
 |
 π – связь образуется при перекрывании АО, расположенных параллельно друг другу. Область перекрывания лежит по обе стороны от межъядерной оси. В образовании π – связи могут участвовать p – и d – АО:
π – связь образуется при перекрывании АО, расположенных параллельно друг другу. Область перекрывания лежит по обе стороны от межъядерной оси. В образовании π – связи могут участвовать p – и d – АО:
δ – связи образуют толькоd – АО.
Сигма – связь является самой прочной связью и всегда образуется в первую очередь. Между двумя атомами в молекуле возможна лишь одна σ – связь.
 Для объяснения геометрической структуры молекул (или направленности ковалентной связи) используют представление о гибридизации атомных орбиталей центрального атома в молекуле АВ n.
Для объяснения геометрической структуры молекул (или направленности ковалентной связи) используют представление о гибридизации атомных орбиталей центрального атома в молекуле АВ n.
Гибридизация – это выравнивание энергии различных АО у атома А в результате их смешения перед химическим взаимодействием, что приводит к образованию гибридных орбиталей. В гибридизации участвуют только АО одного уровня, например, 2s и 2p. Каждому виду гибридизации АО соответствует определенная геометрическая форма молекулы. Например, sp– гибридизации (две связи) соответствует линейная форма молекулы (BeCl 2), sp2– гибридизации (три связи) – плоская треугольная (BCl 3), sp3 - гибридизации (четыре связи) – тетраэдрическая (CH 4).
Ионная связь – связь между ионами, осуществляемая их электростатическим взаимодействием. Ионная связь возникает между атомами металлов и неметаллов, резко отличающимися по своей электроотрицательности. Механизм образования ионной связи заключается в переходе электронов от одного атома к другому (более электроотрицательному), в результате чего атомы превращаются в противоположно заряженные ионы (катион и анион) и происходит их электростатическое взаимодействие. Свойства ионной связи – ненаправленность и ненасыщаемость.
Металлическая связь – это связь, образованная в результате перекрывания валентных орбиталей атомов металлов, в результате чего электроны свободно перемещаются из одной орбитали в другую, осуществляя связь между всеми атомами кристалла металла.
Примеры решения задач
Пример 1. Объясните механизм образования ковалентной химической связи в молекуле HBr и оцените степень ее полярности.
Р е ш е н и е. 1) Для объяснения механизма образования ковалентной химической связи необходимо определить, какие электроны участвуют в образовании этой связи. Запишем электронные конфигурации атомов и электронные схемы строения их валентных уровней; изобразим форму АО, участвующих в образовании связи.
| ↑ |
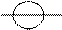 Н 1s1
Н 1s1
Z = +1
Br 1s22s22p63s23p63d104s24p5
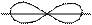 Z = +35 4p
Z = +35 4p
| ↑↓ | ↑↓ | ↓ |
4s
| ↑↓ |
Для образования ковалентной связи атомы водорода и брома предоставляют по одному неспаренному электрону с антипараллельными спинами: атом Н – электрон, находящийся на s – АО (форма АО – сфера), а атом Br – электрон с
p – АО (форма АО – гантель).
2) Покажем механизм образования ковалентной связи в молекуле HBr.
В молекуле HBr связь создается за счет перекрывания двух атомных орбиталей: s – АО и p – АО с образованием между ядрами атомов H и Br зоны повышенной электронной плотности:
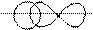 H Br
H Br
3) Для определения степени полярности связи рассчитаем разность электроотрицательностей атомов, образующих молекулу: ЭОН = 2,2; ЭОBr = 2,8; т.е. ЭОH − Br = 0,6, поэтому связь в молекуле HBr ковалентная полярная.
4) Определим вид химической связи в зависимости от способа перекрывания АО взаимодействующих атомов. В молекулах с одинарной химической связью (а именно таковой является молекула HBr) всегда образуется σ – связь как более прочная. В случае σ – связи область перекрывания АО расположена на линии, соединяющей ядра двух атомов.
Пример 2. Определите химические свойства, валентность и возможные степени окисления атома углерода в основном и возбужденном состояниях.
Р е ш е н и е. 1) Рассмотрим основное состояние атома углерода. Так как химические свойства атома определяются его электронным строением, составим электронную конфигурацию атома С и выделим строениевалентного уровня:
С Z = +6 , 1 s 2 2s22p2
2) Составим электронную схему валентного уровня и определим химические свойства атома С, его валентность и степень окисления.
| ↑ | ↑ |
| ↑↓ |
2s 2p
Валентность атома определяется числом неспаренных электронов валентного уровня. Из данной схемы видно, что атом углерода имеет два неспаренных валентных электрона, значит в основном состоянии валентность атома углерода равна двум (В=II), т.е. атом углерода может образовывать две химические связи. Вступая во взаимодействие с другими атомами, атом С стремится завершить свой внешний уровень. Поэтому он может отдать эти два неспаренных электрона, проявляя при этом восстановительные свойства и превращаясь в положительно заряженный ион со степенью окисления +2: С0 − 2 ē = С+2
2 s22 p2 2 s2 (типа He)
Но атом углерода, как неметалл, может принимать недостающие до завершения внешнего уровня четыре электрона, проявляя окислительные свойства и превращаясь в отрицательно заряженный ион со степенью окисления – 4:
С0 + 4 ē = С-4
2 s22 p2 2 s22 p6 (типа Ne)
3) Рассмотрим возбужденное состояние атома углерода. Для возбуждения атома необходимо наличие свободной АО внутри валентного уровня и спаренных электронов. Из электронной схемы строения внешнего уровня атома углерода видно, что атом С имеет вакантную АО на 2p – подуровне, а из четырех валентных электронов два электрона (2 s 2) спарены. Следовательно, атом углерода может находиться в возбужденном состоянии. При возбуждении происходит распаривание 2 s 2- электронов и переход их с 2 s- на 2 p – подуровень:
| ↑ | ↑ | ↑ |
С0…2s22p2 → С* … 2s12p3
| ↑ | ↑ |
| ↑↓ |
| ↑ |
2s 2p 2s 2p
Основное состояние Возбужденное состояние
При возбуждении число неспаренных электронов увеличивается до четырех. Значит в возбужденном состоянии атом углерода проявляет валентность В=IV и образует четыре химические связи. В возбужденном состоянии атом С может только отдать на связь свои 4ē, проявляя восстановительные свойства и превращаясь в положительно заряженный ион со степенью окисления +4:
С 0 – 4 ē = С +4
2s22p2 1s2 (типа He)
Пример 3. Определите, какая связь C − N или C − H является более полярной. Укажите, к ядру какого атома происходит смещение общей электронной пары.
Р е ш е н и е. Для определения полярности связи необходимо найти разность электроотрицательностей атомов (∆ЭО), образующих эти связи. Из табл.1 выписываем значения ЭО этих атомов и находим ∆ЭО:
ЭОС =2,5; ЭО N = 3,0; ЭО H = 2,1; ∆ЭО C − N =3,0 – 2,5 = 0,5; ∆ЭО C − H = 2,5 – 2,1 = 0,4.
Известно, что чем больше ∆ЭО атомов, образующих связь, тем выше полярность связи. Поэтому более полярной является связь C – N. При образовании ковалентной связи общая электронная пара смещается к ядру атома с большей ЭО. В химической связи C − N общая электронная пара смещена к атому N, а в химической связи C − H – к атому С.
Дата добавления: 2019-01-14; просмотров: 320; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
