Основы молекулярно-кинетической теории
Относительная молекулярная (или атомная) масса вещества (Mr) — отношение массы молекулы (или атома) (m0) данного вещества к 1/12 массы атома углерода (m0C). 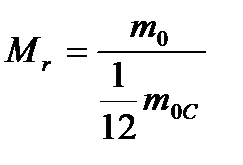
Постоянная Авогадро — величина, равная числу молекул в одном моле; определяется числом молекул в 12 граммах углерода.
NА 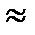 6 · 1023 моль-1
6 · 1023 моль-1
Молярная масса (M) вещества — это масса вещества, взятого в количестве одного моля и равная произведению массы молекулы (m0) на постоянную Авогадро (NA).
М = m0 NА
M = Mr· 10-3 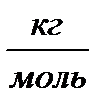 ,
,
Количество вещества (v) равно отношению:
1) числа молекул (N) в данном теле к постоянной Авогадро (NA), т.е. к числу молекул в одном моле вещества:
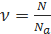
2) массы вещества (m) к его молярной массе (М):
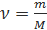
СИ: моль
Число молекул (N) любого количества вещества массой (m) и молярной массой (М) равно: 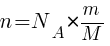
Концентрация молекул (n) — это число молекул (N) в единице объёма (V), занимаемого этими молекулами, — определяется, как 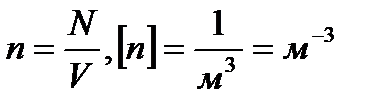
Давление газа (основное уравнение молекулярно- кинетической теории газа)
Давление (p) газа на стенку сосуда пропорционально концентрации (n) молекул (атомов), массе (m0) одной молекулы (атома) и средней квадратичной скорости ( 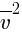 ) молекулы (атома). p =
) молекулы (атома). p = 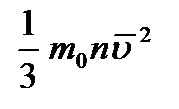
СИ: Па
Давление идеального (p ) газа пропорционально произведению концентрации молекул (n) на среднюю кинетическую энергию поступательного движения молекул ( 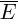 ).
).
p= 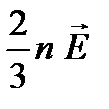 ,
,
p = 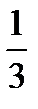 ρ
ρ 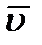
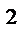
 ,
,
СИ: Па
Температура. Энергия теплового движения молекул
Абсолютная температура
Любое значение абсолютной температуры (T) по шкале Кельвина на 273 градуса выше соответствующей температуры (t) по шкале Цельсия.
T = t + 273
СИ: K
Постоянная Больцмана — величина, связывающая температуру в энергетических единицах (Дж) с температурой (Т) в Кельвинах.
k = 1,38×10-23 Дж/K
Средняя кинетическая энергия ( 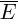 ) хаотичного поступательного движения молекул газа пропорциональна абсолютной температуре (T).
) хаотичного поступательного движения молекул газа пропорциональна абсолютной температуре (T).
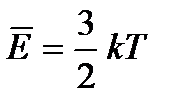
СИ: Дж
Связь давления газа, концентрации его молекул и температуры
При одинаковых давлениях (p) и температурах (T) концентрация молекул (n) у всех газов одна и та же. p = 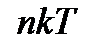
СИ: Па
Средняя квадратичная скорость ( 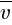 ) теплового движения молекулы газа пропорциональна абсолютной температуре (T) и обратно пропорциональна массе молекулы (m0).
) теплового движения молекулы газа пропорциональна абсолютной температуре (T) и обратно пропорциональна массе молекулы (m0). 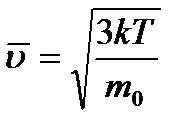
СИ: м/с
Универсальная газовая постоянная (R) — величина, равна произведению постоянной Больцмана (k) и постоянной Авогадро (NA)
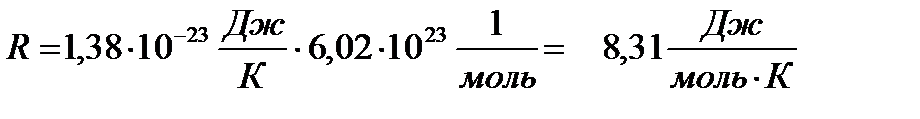
Газовые законы
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) связывает давление (р), объём (V) и температуру (T) идеального газа произвольной массы (m), в данном состоянии идеального газа. 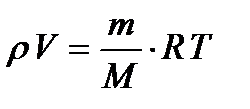
где M – молярная масса, R – универсальная газовая постоянная.
Уравнение Клапейрона
Переход данной массы идеального газа из одного состояния в другое подчиняется соотношению 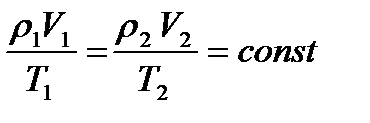
Закон Бойля-Мариотта (изотермический процесс)
Для газа данной массы при переходе из одного состояния в другое при постоянной температуре (T) произведение давления (р) газа на его объём (V) не меняется.
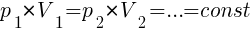 , (при T=const)
, (при T=const)
Закон Гей-Люссака (изобарный процесс)
Для газа данной массы при переходе из одного состояния в другое при постоянном давлении (р) отношение объёма (V) к абсолютной температуре (T) есть величина постоянная для всех газовых состояний.
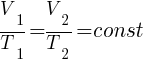 , (при p=const)
, (при p=const)
Закон Шарля (изохорный процесс)
Для газа данной массы при переходе из одного состояния в другое при постоянном объёме (V) отношение давления (р) к абсолютной температуре (T) есть величина постоянная для всех газовых состояний.
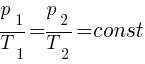 , (при p=const)
, (при p=const)
Закон Дальтона
Для разреженных (идеальных) газов давление (р) смеси равно сумме парциальных давлений (р1, р2,… рn) компонентов смеси.
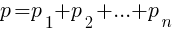
СИ: Па
Дата добавления: 2018-11-24; просмотров: 165; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
