ТСХ - СКРИНИНГ ТОКСИЧЕСКИХ СОЕДИНЕНИЙ
Общая схема обнаружения неизвестного яда
Огромный круг веществ, представляющий токсикологический интерес, и постоянное совершенствование методов их анализа привели к формированию процесса идентификации неизвестного вещества, ставшего причиной отравления. Этот процесс состоит из 2-х этапов: предварительного, позволяющего выявить принадлежность яда к определенной группе химических соединений, и подтверждающего исследования, которое позволяет идентифицировать конкретное вещество.
Проведение предварительного отбора или «скрининга» может быть основано на использовании разнообразных химических или физико-химических методов. В качестве примера можно привести химический скрининг алкалоидов с общеалкалоидными реактивами. Более совершенным и широко используемым в настоящее время является скрининг исследуемых веществ на основе ТСХ. Он позволяет за минимальное время с достаточно высокой чувствительностью выявить из большого круга соединений одно или несколько веществ, чтобы затем целенаправленно выбрать схему химико-токсикологического анализа.
Качественной характеристикой определяемого вещества на данном сорбенте и в данной системе растворителей является величина Rf (отношение расстояния, пройденного веществом, к расстоянию, пройденному растворителем). Величина Rf зависит от техники эксперимента, активности и природы сорбента, толщины слоя сорбента, температуры, качества и природы растворителя, детектирования и др. Отношение величины Rf определяемого вещества к величине Rf стандарта (метчика) обозначают Rsl. Воспроизводимые значения Rf и RSI получаются при соблюдении всех методических указаний.
|
|
|
Пробы наносят мерным капилляром, микрошприцом или обычным капилляром на линию старта на расстоянии не менее 1 см от нижнего края пластинки. Диаметр пятна не должен превышать 2-3 мм. Пластины с нанесенной пробой помещают в хроматографическую камеру, при этом слой подвижной фазы должен быть ниже линии старта на 0,5 - 1 см. Расстояние между соседними пробами на стартовой линии должно быть не менее 1 см.
В методе ТСХ используют различные сорбенты (оксид алюминия, силикагель, целлюлоза и др.), нанесенные на пластину.
В качестве хроматографической камеры используют стандартные камеры или стеклянные емкости любой формы, имеющие герметические крышки. В хроматографическую камеру помещают органические растворители или их смеси (подвижная фаза) и насыщают камеру парами растворителя в течении 30 мин. В качестве метчиков (свидетелей) используют субстанции анализируемых («подозреваемых») веществ. Следует иметь в виду, что в случае использования в качестве метчиков лекарственных веществ, извлеченных из таблеток и других лекарственных форм, наблюдается не полное соответствие Rf метчика и определяемого вещества. Обнаружение (детектирование) определяемых веществ на хроматограмме проводят в УФ- свете и после обработки хроматографических пластин специальными реагентами Пятна, обнаруженные на хроматограмме, копируют и измеряют расстоянш от центра пятна до стартовой линии, рассчитывают Rf.
|
|
|
Основной качественной характеристикой тонкослойной хроматографии является величина Rf, которая представляет собой отношение расстояний, которые пройдены исследуемым веществом и подвижной фазой. Дл определения Rf очень важно точно установить положение фронт растворителя.
Для того чтобы получить истинные значения Rf, необходимо выполня-следующие требования:
а) соблюдать постоянство условий вдоль пути разделения;
б) исключить возможность потерь подвижной фазы;
в) точно определять положение фронта растворителя путем измерения расчета его действительного положения;
г) исключить случайные влияния при нанесении пробы.
На воспроизводимость значений Rf влияют два наиболее важных фактора:
|
|
|
1. тщательное приготовление слоев равномерной толщины (присамостоятельном изготовлении пластинки);
2. регулирование активности хроматографического слоя путем стандартизации сушки и обработки пластинки.
Чувствительность слоев кремниевой кислоты (силикагеля) сильно зависит от влажности атмосферы. Если хроматографирование проводить при относительной влажности в интервале 1—80%, полученные Rf могут различаться на 300%. Не рекомендуется держать пластинки слишком долго на воздухе. Пересушенные пластинки дают завышенные значения Rf, переувлажненные — заниженные.
Заметное влияние на воспроизводимость Rf оказывает степень насыщения парами растворителя атмосферы камеры, где происходит разделение, так как в ненасыщенной камере значения Rf выше.
За редкими исключениями, повышение или понижение температуры не влияет на Rf.
Влияние расстояния между уровнем растворителя в хроматографической мере и линией старта на Rf зависит от природы сорбента, природы оделяемого вещества и применяемой системы растворителей. Если деление производится в двухкомпонентной системе, то указанное расстояние влияет на величину Rf, особенно в случаях соединений с низкими эниями Rf.
|
|
|
Полученные значения Rf зависят также от размеров нанесенной пробы, и степень этого влияния определяется типом разделяемых соединений,
На величину Rf оказывает влияние способ нанесения пятна. Если пробу наносят не всю сразу, а несколькими порциями в одно пятно, чтобы дать растворителю испариться, это приведет к частичному радиальному хроматографированию, что скажется на форме пятна и величине Rf.
Кроме того,при нанесении пробы следует по возможности пользоваться
малополярным растворителем. Примеси в пробе также влияют на величину Rf.
Существенное влияние на величину Rf оказывает природа сорбента и размер его частиц, причем для более мелких частиц имеет место тенденция к увеличению Rf.
Подводя итог сказанному, можно отметить, что величины Rf, получаемые в ТСХ, хорошо воспроизводятся, если достигается идентичность условий получения тонкослойных хроматограмм. Идентичные условия ТСХ достигаются:
• конструкцией и размерами камеры для разделения;
• способом герметизации камеры;
• условиями насыщения атмосферы камеры парами растворителя;
• температурой опыта;
• влажностью и относительной влажностью;
• толщиной слоя сорбента, типом подложки;
• связующими, флюоресцирующими веществами, буферами, веществами, используемыми для модификации сорбента;
• методом активирования слоя;
• устройством для нанесения пробы;
• расстоянием от края пластинки до линии старта;
• числом пластинок в камере;
• продолжительностью опыта и длиной пробега;
• составом смеси растворителей и их чистотой;
• размерами пятна или полосы;
• растворителем, применяемым для нанесения пробы;
• методом нанесения, например на открытом воздухе, в атмосфере азо1 и т.д.
Следует помнить, что даже при полном совпадении полученного значения с Rf известного соединения можно говорить только о возможной идентичности вещества, которую еще необходимо подтвердить другими методами. По рекомендации Международного комитета по систематическому токсикологическому анализу (СТА-комитет) перед использованием приготовленной хроматографической системы необходимо провести ее апробацию с использованием образцов сравнения. И только убедившись в совпадении полученных величин Rf с табличными, можно приступить к аналитическому исследованию.
Выбор наилучшей системы для конкретной задачи зависит от поставленной цели исследования. Например, если необходимо разделить большое число компонентов, т.е. применить скрининг, рекомендуется использовать три главных системы.
Во-первых, система должна дать хорошее распределение пятен по всей пластинке для наиболее важных веществ. Во-вторых, значения Rf должны быть воспроизводимы.
Система ТСХ-скрининга предусматривает поэтапное исследование токсикологически важных соединений: на первом этапе проводится скрининг в общих системах растворителей и, при положительном результате, исследование элюатов в частной системе растворителей.
Критерием выбора общих систем растворителей является разделение определяемых веществ на определенные группы, локализованные в хроматографические зоны.
В основу выбора частных систем растворителей положена высокая эффективность разделения исследуемых соединений, входящих в ту или иную хроматографическую зону.
Обнаружение веществ на хроматограмме осуществляется на основе использования (последовательного или параллельного) реагентов, избирательно реагирующих с лекарственными веществами, входящими в определенную химическую группу.
Метод имеет отрицательное судебно-химическое значение. При положительном результате проводят исследование, включающее: химические реакции, ГЖХ, фотометрию и УФ- спектрофотометрию, фармакологические пробы.
Таким образом, общую схему обнаружения неизвестного яда можно представить следующим образом.
При выполнении общего (ненаправленного) анализа на группу веществ, изолируемых полярными растворителями, ТСХ-скрининг в общих и частных системах растворителей проводится раздельно для веществ кислого и слабоосновного характера и для веществ основного характера. Рассмотрим систему ТСХ-скрининга лекарственных веществ, разработанную Г.М. Родионовой ( Московская медицинская академия).
Исследования веществ кислотного и слабоосновного характера в общих
системах растворителей
Условия анализа:
1. Подвижная фаза - ацетон: хлороформ =1:9.
2. Неподвижная фаза - закрепленный слой силикагеля КСК на стеклянных пластинах 9*12 см (в отдельных случаях «Силуфол»).
3. Высота подъема фронта растворителя 10 см.
4. Время насыщения камеры 15-20 мин.
 Схема разметки пластинки
Схема разметки пластинки
Пластинка условно делится на 4 вертикальные зоны по анализируемым соединениях (А, Б, В, Г) и 3 горизонтальные зоны по значениям Rf отдельных групп соединений.
Зона Б - 1/25 экстакта из кислой среды (для качественного анализа).
Зона В - стандарт (циклобарбитал) для расчета значений Rf.
Зона Г - 1/10 экстракта из кислой среды (используется после элюирования в частных системах).
После хроматографирования исследуемые соединения распределяются по вертикальным зонам следующим образом:
1 зона - амидопирин, антипирин, кофеин (Rf=0-0,25).
2 зона - фенобарбитал, барбитал, нитразепам, барбамил, этаминал-натрий,
циклобарбитал, бутобарбитал (Rf=0,31-0,41).
3 зона - диазепам (Rf=0,41-0,64).
Обнаружение соединений на хроматограмме проводится путем последовательной обработки слоя сорбента зон А, Б, В (при закрытой зоне Г) следующими реактивами:
• 0,1% раствор ДФК в СНС13 и 5% раствор HgS04 - обнаруживаются производные барбитуровой кислоты (красно-фиолетовые пятна).
Метод имеет отрицательное судебно-химическое значение. При положительном результате проводят исследование, включающее: химические реакции, ГЖХ, фотометрию и УФ- спектрофотометрию, фармакологические пробы.
Таким образом, общую схему обнаружения неизвестного яда можно представить следующим образом.
При выполнении общего (ненаправленного) анализа на группу веществ, изолируемых полярными растворителями, ТСХ-скрининг в общих и частных системах растворителей проводится раздельно для веществ кислого и слабоосновного характера и для веществ основного характера. Рассмотрим систему ТСХ-скрининга лекарственных веществ, разработанную Г.М. Родионовой ( Московская медицинская академия).
Исследования веществ кислотного и слабоосновного характера в общих
системах растворителей
Условия анализа:
1. Подвижная фаза - ацетон: хлороформ =1:9.
2. Неподвижная фаза - закрепленный слой силикагеля КСК на стеклянных пластинах 9*12 см (в отдельных случаях «Силуфол»).
3. Высота подъема фронта растворителя 10 см.
4. Время насыщения камеры 15-20 мин.
• 10% FeCb, - производные пиразолона: антипирин - красно-оранжевое окрашивание, амидопирин - сине-фиолетовое.
• реактив Драгендорфа и 10% раствор H2S04 (для повышения чувствительности): антипирин, амидопирин - оранжевое, кофеин - оранжево-коричневое, нитразепам, диазепам - оранжево- желтое.
Рассчитывают RSI.
Слой сорбента из зоны Г, расположенный параллельно окрашенному пятну в зоне Б, снимают и экстрагируют метанолом (зона 1) или ацетоном (зона 2,3). Экстракты хроматографируют в частных системах растворителей.
ТСХ-скрининг веществ кислотного характера в частных системах
растворителей
Схема разметки пластинки.
Зона А и Б - метчики (вещества, входящие в
исследуемую зону).
Один метчик - циклобарбитал.
| А | Б | В |
Зона В - элюат из зоны Г, полученный при анализе в общих системах.
Соединения 1 зоны:
1.Подвижная фаза-ацетон : циклогексан (5: 1).
2.Сорбент - незакрепленный слой основного оксида алюминия на стеклянной пластинке 9*12.
3.Реагент-10% раствор FeCl3 на антипирин и амидопирин.
Соединения 2 зоны:
1. Подвижная фаза-хлороформ: н-бутанол : 25%NH4OH=70:40:5.
2.Сорбент - силикагель КСК, забуференный 0,1 н раствором Н3ВО3, закрепленный на стеклянной пластинке 9* 12.
3.Реагенты: 0,1% раствор ДФК (дифенилкарбазон) и 5% раствор HgS04 - на барбитураты.
Обнаружение нитразепама - гидролиз на пластинке (6н НС1, 140°С, 40 минут) с последующим образованием азокрасителя с (3- нафтолом.
Соединения 3 зоны:
1.Подвижная фаза-этил ацетат: бензол: этанол: 25% раствор NH3 = 95:15:5:2,5.
2. Сорбент - силикагель КСК, закрепленный на стеклянных пластинках 9*12.
3.Реактив Драгендорфа. Рассчитывают Rst.
Исследование веществ основного характера в общих системах
растворителей
Условия анализа:
1. Подвижная фаза: хлороформ: диоксан: ацетон: аммиак = 45:47,5:5:2,5
2. Неподвижная фаза: силикагель.
3. Высота подъема фронта растворителя 10 см.
4. Время насыщения камеры 15-20 мин.
Схема разметки пластинки:
| А | Б | В | Г | |
| 4 | ||||
| 3 | ||||
| 2 | ||||
| 1 | ||||
|
| ||||
Пластинка делится на 4 горизонтальных зоны (по
наносимым зонам) и 4 вертикальных зоны по
значениям Rf, отдельных групп соединений.
Зона А - наносим метчики (атропин, кокаин).
Зона Б - 1/25 часть хлороформного экстракта из
щелочной среды.
Зона В - стандарт (этаперазин) для расчета значений
Rst.
Зона Г - 1/10 часть хлороформного экстракта из щелочной среды.
После хроматографирования вещества основного характера распределяются по вертикальным зонам следующим образом:
1 зона - пахикарпин, морфин, атропин, эфедрин, стрихнин, хинин, кодеин, дионин (Rf= 0,12-0,36).
2 зона - этаперазин, антипирин, кофеин (Rf= 0,5-0,58).
3 зона - дипразин, новокаин, тиоридазин, аминазин, промедол, нитразепам. амидопирин (Rf= 0,63-0,83)
4 зона - левомепромазин, папаверин, диазепам, кокаин (Rf 0,87-0,98).
Обнаружение соединений на хроматограмме производится путем последовательной обработки слоя сорбента зон А, Б, В следующими реагентами:
• 10% раствор РеСЬ - производные пиразолона и фенотиазина;
• конц. НС104+ 3-5% раствор NaN02 - усиление окраски фенотиазинов;
• 10%о раствор H2S04 + УФ-свет - хинин;
· Реактив Драгендорфа и 10% раствор серной кислоты-все соединения, содержащие третичный атом азота.
Слой сорбента из зоны Г, расположенный параллельно окрашенному пятну в зоне Б,снимают и экстрагируют смесью метанол-диэтиламин = 9:1 (для 1 зоны)и смесью метанол:25% раствор NH3 = 9:1 (для 2-4 зоны). Экстракты хроматографируют в частных системах.
ТСХ-скрининг веществ основного характера в частных системах.
Соединения 1 зоны (похикарпин, морфин, атропин, эфедрин, стрихнин, I, дионин).
1.Подвижная фаза - хлороформ-диэтиламин= 9:1.
2.Сорбент-силикагель КСК (закрепленный слой)
3.Реагенты:
• реактив Драгендорфа - проявляются вещества, содержащие третичный атом азота;
• реактив Марки - производные фенантренизохинолина;
• 10% раствор H2S04+ УФ-свет (хинин).
Соединения 2 зоны (этаперазин, антипирин, кофеин).
1.Подвижная фаза - ацетон- хлороформ = 1:5.
2.Сор6ент - незакрепленный слой нейтрального оксида алюминия.
З.Реагенты:
• конц. НСL04+ 3-5% раствор NaN02 - этаперазин {розовая окраска):
• 10%) раствор FeCL3- антипирин (оранжево-коричневая окраска
Соединения 3 зоны (дипразин, новокаин, тиоридазин,аминазин, промедол, нитразепам, амидопирин).
1.Подвижная фаза- хлороформ-этанол = 20:1.
2.Сорбент - незакрепленный слой основного оксида алюминия. 3.Реагенты:
• 10% раствор FeCh - амидопирин (фиолетовая окраска);
Конц.HCLO4 + 3-5% раствор NaNO2- дипразин, аминазин (розовое
окрашивание), тиоридазин (зеленое окрашивание);
• реактив Марки - промедол (розовое окрашивание);
• реакция азосочетания - новокаин;
• гидролиз с последующим азосочетанием - хлозепид, нитразепам.
Соединения 4 зоны (левомепромазин, папаверин, диазепам, кокаин).
1 .Подвижная фаза - циклогексан-ацетон = 5:1.
2.Сорбент - незакрепленный слой основного оксида алюминия.
3.Реагенты:
• конц. НС104+3-5% раствор NaNCb - левомепромазин (фиолет окрашивание);
• реактив Марки - папаверин (розовое окрашивание);
• реактив Драгендорфа - диазепам (желто-оранжевое окрашивш кокаин (оранжево-коричневое окрашивание).
Следует отметить, что предварительное исследование методом ТСХ- скрининга особенно эффективно при анализе материала, не подвергшегося гнилостному разложению, так как, в противном случае, при изолирование экстрагируется значительное количество эндогенных аминов, пептидов и других ВМС, затрудняющих проведение ТСХ-скрининга. Существуют и другие системы ТСХ- скрининга лекарственных вещества.
Например, В.А.Карташов предложил систему ТСХ -скрининга более лекарственных веществ основного характера.
МЕТОД ГАЗОВОЙ ХРОМАТОГРАФИИ
Процесс хроматографического разделения основан на сорбции, с которой мы встречаемся в повседневной жизни - это поглощение веществ твердой поверхностью (адсорбция) или растворение газов и жидкостей в жидких растворителях (абсорбция). Самое известное применение адсорбции -очистка в противогазах: адсорбент (активированный уголь), заполняющий коробку противогаза, удерживает вредные примеси или ОВ, содержащиеся в воздухе. Абсорбция характерна для многих биологических процессов, в частности для процесса дыхания. Поглощение кислорода гемоглобином крови в легких - тоже в определенной степени хроматографический процесс, так как при этом происходит сорбционное отделение кислорода от других газов, присутствующих во вдыхаемом воздухе. К сожалению, содержащиеся в воздухе вредные для организма примеси тоже поглощаются кровью и иногда необратимо.
Человеком, который впервые сумел правильно объяснять процесс сорбции (явления, происходящие при движении вещества вдоль слоя сорбента), был русский ученый Михаил Семенович Цвет. Используя эти явления, он создал аналитический метод, показал его широкие возможности и дал название, которое и по сей день мы применяем для обозначения не только метода, но также и самого процесса и научной дисциплины, его изучающего. Возможность разделения веществ на слое порошка была известна давно, однако честь открытия хроматографии как метода разделения веществ, принадлежит Цвету, который впервые применил в 1903г проявительный вариант жидкостно-адсорбционной хроматографии для анализа хлорофилла. В трубку с порошком мела он залил раствор пигментов хлорофилла. В верхней части образовалось окрашенное кольцо. Затем он стал непрерывно подавать в верхнюю часть трубки бензол. Пигменты частично растворялись в нем, опускались, адсорбировались другими зернами мела, снова растворялись в новых порциях бензола и снова опускались по трубке.
Но так как разные вещества по-разному извлекались бензолом из адсорбента (мела), они опускались по трубке с разной скоростью. Поэтом) первоначальное зеленое кольцо, опускаясь, постепенно расширялось н делилось на несколько цветных колец. В конце концов этих колец оказалось шесть: верхнее желтое, затем оливково-зеленое, далее темно-зеленое и тр\ желтых.
Цвет извлек слой мела из трубки, разрезал его на цилиндрики, в каждом и: которых оказалось свое цветное кольцо. Теперь можно было извлечь вещества из адсорбента спиртом и исследовать. В результате ученый показал что хлорофилл - это не индивидуальное соединение, а смесь двух веществ которые разделились на колонке с мелом и дали оливково-зеленое и темно зеленое кольца.
Цвет назвал получаемую при разделении веществ разноцветную картин; хроматограммой, а сам метод (основанный на разделении веществ по и склонности к адсорбции) хроматографией.
Газовая хроматография Задачей количественного анализа является определение количественного содержания компонентов, входящих в состав анализируемого объект Методы количественного анализа подразделяются на химически (гравиметрический, титриметрический), физические и физико-химические.
Химические методы являются классическими методами аналитической химии. Однако химические методы не всегда удовлетворяют требованиям Наиболее перспективны в этом отношении физико-химические и физически методы. Широкое применение получил хроматографический метод анализ; Хроматографический метод анализа основан на распределении компоненте смесей веществ между двумя несмешивающимися фазами - неподвижной подвижной (движущейся). В качестве неподвижной фазы используют твердое вещество или жидкость, нанесенную на твердый инертный носитель Подвижной фазой служит газ или жидкость, которые содержат смеси разделяемых веществ.
Современные хроматографические методы разделения имеют большие возможности. Эти методы позволяют разделять органические соединения, и химические соединения, имеющие сходные структуры, и неорганические нения с близкими химическими свойствами.
По агрегатному состоянию среды, используемой для разделения смеси, различают газовую, жидкостную и газожидкостную хроматографию. В простейшем случае под термином «газовая хроматография» подразумевается метод анализа, когда разделение смеси веществ в хроматографической колонке осуществляется в потоке газа (газа-носителя), прерывно пропускаемого через колонку. Газоадсорбционная (разделение 1 адсорбенте - угле, силикагеле или оксиде алюминия) и газожидкостная )азделение на сорбенте - твердый носитель, покрытый жидкостью
-Неподвижной жидкостью - неподвижной жидкой фазой) - это все варианты газовой хроматографии.
Одним из главных преимуществ газовой хроматографии по сравнению с другими физико-химическими методами является экспрессность. Так, если продолжительность разделения многокомпонентной смеси ректификацией измеряется часами, то газовая хроматография позволяет получить более надежные и более детальные результаты в течение нескольких минут и даже секунд. Расшифровка результатов хроматографического анализа достаточно проста, а современный газовый хроматограф представляет собой автоматический прибор, снабженный устройством для обработки информании.
В токсикологической химии и медицине газожидкостная хроматография помогает решать разнообразные задачи - анализ биологических жидкостей больных, с целью раннего диагностирования, выявления нарушений метаболизма, определения времени нахождения лекарств и их метаболитов в организме, выявление различных групп токсикантов.
Современные хроматографические методы разделения имеют большие возможности. Эти методы позволяют разделять органические соединения, и неорганические соединения, имеющие сходные структуры, и неорганические соединения с близкими химическими свойствами.
По агрегатному состоянию среды, используемой для разделения смеси, различают газовую, жидкостную и газожидкостную хроматографию. В самом простейшем случае под термином «газовая хроматография» подразумевается метод анализа, когда разделение смеси веществ в хроматографической колонке осуществляется в потоке газа (газа-носителя), непрерывно пропускаемого через колонку. Газоадсорбционная (разделение на адсорбенте - угле, силикагеле или оксиде алюминия) и газожидкостная (разделение на сорбенте - твердый носитель, покрытый жидкостью -неподвижной жидкостью - неподвижной жидкой фазой) - это все варианты газовой хроматографии.
Одним из главных преимуществ газовой хроматографии по сравнению с другими физико-химическими методами является экспрессность. Так, если продолжительность разделения многокомпонентной смеси ректификацией измеряется часами, то газовая хроматография позволяет получить более надежные и более детальные результаты в течение нескольких минут и даже секунд. Расшифровка результатов хроматографического анализа достаточно проста, а современный газовый хроматограф представляет собой автоматический прибор, снабженный устройством для обработки информации.
В токсикологической химии и медицине газожидкостная хроматография помогает решать разнообразные задачи - анализ биологических жидкостей больных, с целью раннего диагностирования, выявления нарушений метаболизма, определения времени нахождения лекарств и их метаболитов в организме, выявление различных групп токсикантов.
Достоинства метода ГЖХ. универсальность - можно разделять и анализировать различные смеси газообразных, жидких и твердых веществ, обладающих летучестью и
быстрота анализа и высокая разделительная способность. Большой выбор неподвижных жидких фаз, их комбинирование позволяет разделить практически любые сложные смеси;
высокая чувствительность - детектирующие системы позволяют определять концентрацию 10~8- 10~9 мг/мл;
малая величина пробы - в дозирующее устройство вводится для анализа проба жидкая или газообразная в объеме 0,1-10 мкл; точность метода - относительная ошибка определения составляет 2-5%.
Устройства газового хроматографа
Газовый хроматограф «Кристалл-5ООО. 1»
термической устойчивостью при температуре колонки от - 70 до 450 С;

Назначение основного узлов и блоков.
Для проведения газохроматографического анализа служит специальный прибор - газовый хроматограф. Газовый хроматограф - это прибор для проведения процесса газовой хроматографии с целью качественного и количественного анализа смесей веществ, для выделения из смесей чистых компонентов, а также физико-химических измерений. Современные газовые хроматографы представляют собой многодетекторные полностью автоматизированные приборы, в которых все стадии регулируются компьютером.
Принципиальная схема газового хроматографа
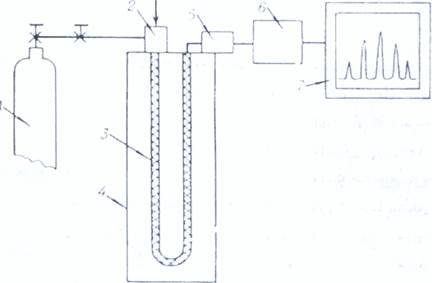
1. баллон с инертным газом
2. устройство для ввода пробы в хроматографическую колонку
3. хроматографическая колонка
4. термостат
5. детектор
6. преобразователь сигналов
7. регистрирующее устройство
Газ-носитель из баллона высокого давления через редуктор поступает в систему подготовки газов, включающий регулятор давления, кран тонкой регулировки, фильтр для очистки газа от посторонних примесей и паров воды предназначенную для установки, стабилизации и измерения скорости газа-носителя и газов, питающих некоторые детекторы. В процессе анализа важно установить оптимальный расход газа - носителя, исключить колебания расхода газов, так как эти факторы ухудшают воспроизводимость параметров регулируемых пиков анализируемых веществ. Дозирующее устройство предназначено для ввода пробы. Обычно жидкую или газообразную пробу вводят с помощью шприца в поток газа - носителя непосредственно перед колонкой. В этом случае место ввода представляют собой небольшую емкость перед началом колонки, снабженную каучуковой мембраной. При вводе пробы эту мембрану прокалывают, а через несколько сотен вводов заменяют. Практически одновременно с вводом жидкая проба переходит в газообразное состояние, чтобы она смешалась с потоком газа-носителя. Для этого дозатор нагревают до температуры, повышающей температуру колонки на несколько десятков градусов. В описаниях методик газохроматографического анализа присутствует параметр «температура испарителя». Для ввода проб используют специальные микрошприцы, позволяющие отмерять объем от долей микролитра до нескольких десятков микролитров.
Разделение смеси на отдельные входящие в ее состав компоненты происходит в колонке. В ГЖХ используются три типа аналитических колонок - насадочные, микронасадочные и капиллярные.
• Насадочные. Изготовлены из закрученных спиралью металлических, стеклянных или фторопластовых трубок с внутренним диаметром от 2 до 4 мм и длиной - 0,5-3 м. колонка заполнена твердым носителем (хромасорб Р, инзинский и апрелевский кирпич, диатомиты, силаны, полихромы).
• Микронасадочные. Отличаются от предыдущих только диаметром трубок - 0,8-1,0 мм и длиной 5-10 см.
• Капиллярные - металлический, стеклянный или кварцевый капилляр с внутренним диаметром 0,25-0,5 мм и длиной 10-50м. Неподвижная фаза нанесена в виде тонкой пленки нелетучего вещества или тонкого слоя адсорбента и не заполняет всей внутренней полости, а лишь покрывает внутреннюю поверхность трубки.
Современные капиллярные колонки представляют собой длинные и тонкие стеклянные или кварцевые капилляры (длина 10-100м и внутренний диаметр 0,25 - 0,53мм), на внутреннюю поверхность которых нанесена тонкая (0,5 -5мкм) пленка НЖФ, снаружи покрытые полимерным материалом для исключения ломкости.
Капиллярная колонка

Требования к твердым носителям:
• Значительная удельная поверхность, позволяющая нанести жидкость в виде тонкой пленки и не допускающая ее перемещение;
• Малая адсорбционная способность по отношению к разделяемы» веществам;
• Химическая инертность и отсутствие каталитической активности;
• Механическая прочность;
• Способность к равномерному заполнению колонки;
• Термическая стабильность;
• Смачиваемость поверхности наносимой на нее жидкости.
Требования к неподвижным жидким фазам:
• Селективность;
• Оптимальная сорбционная емкость;
• Химическая инертность по отношению к твердому носителю, материал} колонки, газу-носителю и разделяемым веществам;
• Низкое давление пара при рабочей температуре;
• Химическая стабильность в условиях применения;
• Малая вязкость;
• Отсутствие примесей;
• Доступность.
Хроматографическая колонка помещена в термостат, температура в котором поддерживается с точностью до 0,05-0,5 С. Основным параметром среди условий хроматографического анализа является «температура колонки», температура воздуха, циркулирующего в термостате. Если в ходе всего хроматографического анализа температура колонки не меняется, такой режим разделения называется изотермическим. Однако для разделения смесей с широким интервалом температур кипения компонентов необходимо повышение температуры хроматографической колонки в процессе анализа. В таком случае используют так называемый режим разделения с программированием температуры.
Разделенные компоненты с потоком газа-носителя попадают в детектор, который преобразует возникающие изменения физико-химических свойств систем газ-носитель: компонент в электрический сигнал. Детектор представляет собой устройство, предназначенное для обнаружения и количественного определения, выходящих из колонки в потоке газа-носителя компонентов анализируемой смеси. Величина сигнала зависит от природы компонентов анализируемой смеси.
Для газовой хроматографии предложено около 50 детекторов, но наибольшее распространение в силу универсальности и высоких эксплуатационных качеств получили пламенно-ионизационный детектор и детектор по теплопроводности. Кроме того, широко используются селективные детекторы, позволяющие определить в сложных смесях только соединения определенного состава (детекторы электронного захвата, термоионные, пламенно - фотометрические).
Принцип действия детектора по теплопроводности (катарометра) основан на изменении температуры нагретых нитей (чувствительных элементов) в зависимости от теплопроводности окружающего газа, которая в свою очередь определяется его составом. Поэтому наибольшая чувствительность может быть получена в том случае, когда теплопроводность анализируемой смеси газ-носитель/вещество возможно больше отличается от теплопроводности чистого газа-носителя. Так как теплопроводность большинства органических соединений низкая, то для их анализа используются газы с высокой теплопроводностью - водород и гелий. Водород используется значительно реже ввиду его взрывоопасное™. Для получения дифференциального сигнала через одну из камер катарометра - измерительную, проходит газ с анализируемым веществом, выходящий из хроматографической колонки, через другую - сравнительную, чистый газ-носитель. Изменение условий теплообмена чувствительного элемента в измерительной камере относительно камеры сравнения приводит к изменению сопротивления и возникновению электрического сигнала.
Катарометр - простой и надежный в работе детектор. Однако из-недостаточной чувствительности не применяется для определен: микропримесей и не применяется при работе с водными растворами. Ионизационные методы детектирования обеспечивают наибольшее) чувствительность и широко применяются для определения малых количественного анализируемого вещества. В составе его лежит зависимое электропроводности ионизированной газовой среды от ее состава. Сигнал! является изменение ионного тока, вызванное введением его в анализируемые вещества. «Ионный» ток возникает в детекторе п воздействием какого-либо источника ионизации (радиоактивного изота пламени, разряда, фотоионизации, электронной или ионной эмиссии) электрического поля между электродами детектора. В ионизационного детекторе создаются такие условия, при которых либо плотно! (концентрация) заряженных частиц, либо скорость переноса их электрическое поле зависит от состава газа.
Наиболее популярным является пламенно- ионизационный детектор (ДИ\ К преимуществам этого детектора относят высокую чувствительность органическим соединениям, широкий линейный диапазон, сравнитель малую зависимость рабочих параметров от конструкции и внешних условий: безынерционность и отсутствие жестких требований к стабильна электрического питания. Основу действия детектора составляет регистрационные изменений «ионного» тока, возникающего в результате ионизш анализируемых веществ в пламени водорода; ток насыщения возраст пропорционально количеству вещества, поступающего в детектор.
Механизм ионообразования связан с термодеструкцией (окисление) молекул последующий хемоионизацией.
Детектор представляет собой камеру, в которой поддерживается водород пламя, являющееся источником ионизации. В камеру вводятся необходимые для поддержания пламени водород и воздух. Горелка является одним электродов, она изолирована от корпуса детектора и соединена с источником стабилизированного напряжения. Второй электрод, называемый часто коллектором, расположен над горелкой. Во внешнюю цепь электрода детектора включен электрометр, измеряющий ток между электродами детектора.
Механизм ионообразования объясняет пониженную чувствительность этого детектора к соединениям, содержащим уже окисленные атомы углерода, и низкую или вообще отсутствующую чувствительность к соединениям, содержащим только окисленные атомы углерода, а также к воздуху, инертным газам, оксидам серы, углерода, оксидам азота, парам воды и к ряду других неорганических соединений.
Детектор электронного захвата (ДЭЗ) получил широкое распространение в связи с необходимостью измерения весьма малых количеств хлорсодержащих пестицидов в продуктах растительного происхождения. Он успешно применяется для определения малых концентраций галоген -, кислород-, и азотсодержащих веществ, некоторых металлорганических соединений и других веществ, содержащих атомы с явно выраженным сродством электронов. Системы детектирования по захвату электронов включают ионизационную камеру (ячейку) детектора и источник поляризующего напряжения (блок питания). Для работы детектора необходимо, прежде всего, обеспечить постоянную скорость образования свободных электронов в ионизационной камере, что достигается помещением в нее радиоактивного источника. В качестве газа - носителя используется азот, аргон, гелий и другие электроно - донорные газы, способные ионизироваться под воздействием радиации с освобождением электронов. ДЭЗ обладает высокой чувствительностью и позволяет фиксировать нано- и пикограммовые количества вещества. Термоионный детектор (ТИД), в настоящее время, является одним из наиболее высокочувствительным и селективным детектором на фосфор - и азоторганические вещества. Действие ТИД основано на увеличении ионизации солей щелочных металлов в пламени водорода при попадании в него элементорганических соединений. При введении нейтральных молекул соли щелочного металла в пламя водорода происходит их ионизация, в результате чего наблюдается резкое увеличение фонового потока. Анализируемая молекула в пламени водорода разрушается с образованием радикалов с гетероатомами, взаимодействие которых с заряженными комплексами солей щелочных металлов приводит к резкому увеличению скорости образования ионов, что в итоге вызывает дополнительное образование ионов элементорганических соединений. ТИД проявляет довольно высокую чувствительность и селективность определения соединений фосфора, азота, мышьяка, олова и серы.
Пламенно-фотометрический детектор (ПФД) также является селективным на фосфор - и серосодержащие вещества. Принцип его действия основан на изменении свечения водородного пламени, при сгорании в нем фосфор- и серосодержащих соединений. Различие условий сжигания в ПФД и ПИД состоит в том, что в ПФД пламя обогащено водородом, в то время как в ПИД оно обогащено кислородом.
Фотоионизационный детектор (ФИД) относится к высокочувствительным детекторам универсального назначения с регулируемой селективностью. Принцип действия ФИД заключается в ионизации молекул элюируемых из хроматографической колонки веществ под воздействием вакуумного УФ-излучения и изменении возникающего ионного тока. Возможность регулирования селективности отклика ФИД при использовании ламп с различными энергиями УФ - облучения открывает широкие возможности применения этих детекторов в качественном групповом газохроматографическом анализе. Детектор обладает высокой чувствительностью к ряду неорганических и органических веществ (10" ), что обуславливает все возрастающее использование этих детекторов. Детекторы подразделяются на:
• универсальные
• селективные
Селективные детекторы позволяют определить в образце только соединения определенного состава. К таким детекторам относятся электронозахватный, термоионный, пламенно-фотометрический, использование которых позволяет быстро и с высокой чувствительностью выявлять компоненты, но только определенного состава.
Универсальные детекторы позволяют определять соединения более разнообразной химической природы, что необходимо при определении полного состава смеси, содержащей компоненты различного строения.
Основные хроматографические характеристики:
• Абсолютное время удерживания ( tg ) - время от момента вода пробы до момента выхода из хроматографической колонки максимальной концентрации определяемого вещества (до появления максимума пика), измеряется в мин или сек;
• Расстояние удерживания (1ц ) - расстояние от момента ввода пробы до перпендикуляра, опущенного из вершины пика соответствующего сигнала, измеряется в см или мм;
• Объем удерживания ( Vr ) - соответствует объему газа-носителя мл, прошедшего через колонку с момента ввода пробы до момента выхода максимальной концентрации определяемого вещества;
• Площадь пика ( S ) - пропорциональна количеству анализируемого компонента в смеси, выражается в кв.см или кв.мм.
Полученная хроматограмма имеет следующий вид
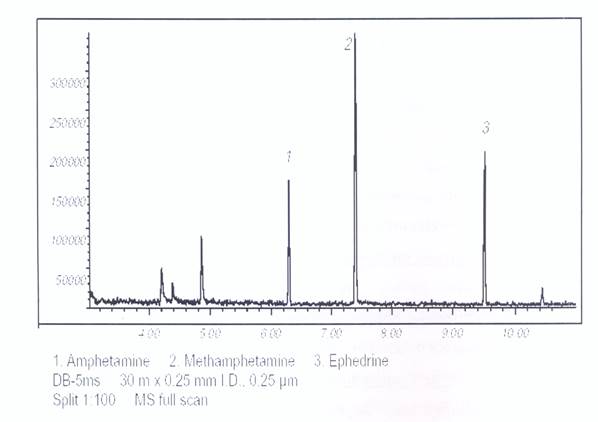
4.439 БАРБИТАЛ
4.779 Диэтил фталат
5.355 Меконин
5.577 Гидрокотарнин
5.941 Дибутил фталат
6.264 ? Инозитол гексаацетат
6.997 Бензил бутил фталат
7.264 КОДЕИН
7.455 МОРФИН
7.522 Диизооктил фталат
7.605 Ацетилкодеин
7.673 6-МАМ (Б-МОНОАЦЕТИЛМОРФИН)
7 818 Стефарин, 6-ацетат
8.029 ГЕРОИН
8.696 Папаверин
9.136 Норкодеин 2Ас
9.186 Тебаол ацетат
9 299 Сахароза октаацетат
9.548 3,6-ДИМЕТОКСИ-4-АЦЕТОКСИ-8[2-(№МЕТИЛАЦЕТАМИДО)ЭТИЛ]ФЕНАНТРЕН 9.769 НОРМОРФИН ТРИАЦЕТАТ 10857 Носкапин
Определение этанола методом ГЖХ
Определение этилового спирта в биологических жидкостях (крови и моче) методом ГЖХ при судебно-химических исследованиях было предложено в 1968 году судебным химиком В.М.Пономаревым.
Метод основан на превращении спиртов в сложные эфиры азотистой кислоты - алкилнитриты, высоколетучие соединения, которые подвергаются газохроматографическому анализу. В основе метода лежат реакции: R-OH -> R- ONO
ССЬСООН + NaN02 -> CCl3COONa + HN02 HN02 + C2H5OH -» C2H5ONOt + H20 избыток 2 HN02 -> Н20 +NO + N02
Эти реакции выполняются в герметично укупоренном флаконе. Парогазовую фазу, содержащую алкилнитриты, в количестве 0,5 - 3 мл отбирают шприцем, прокалывая пробку флакона, и вводят в колонку хроматографа.
Мне было почти 16 лет, когда я познакомилась с мальчиком, который меня позвал домой и там предложил серо-красную капсулу. Это был мескалин. Мы приняли каждый по капсуле.
Мы долго разговаривали, точнее он мне рассказывал что-то, а я смеялась. Момент, когда на меня начал действовать препарат, я, наверное, пропустила. В очередной раз мне стало очень смешно и я зачем-то посмотрела на потолок, откуда, медленно поворачиваясь в мою сторону, на меня наставил дуло какого-то плазменного ружья объемный робот женского пола. Я не придала этому значения и подумала, что мне показалось. Хотела рассказать об этом мальчику, но тут посмотрела на ковер... там творилось просто безумство... все двигалось, менялось, как будто смотришь в калейдоскоп, только цвета были гораздо ярче и не один узор не повторялся дважды.
Когда я вошла к этому мальчику в квартиру, он сказал мне "вот и моя розовая комнатка", я спросила "почему розовая?", он ответил, что скоро я узнаю, почему. И действительно, вскоре я увидела, что она розовая и ужасно красивая. Каждая вещь в этой комнате была совершенством, созданным руками человека. И казалось, что узоры на комоде сделали люди, которые тоже едят мескалин и что они знали, что мы будем его есть, и специально для нас создали такой замечательный комод, чтобы мы знали, что мы не одни (такие вот логические цепочки проносились время от времени в моей голове). Это было удивительное чувство единения со всем вокруг. Я хотела кричать о том, как всех люблю. У меня не было ни ненависти, ни злости, ни каких-либо других отрицательных эмоций. Только любовь, счастье, всепонимание и всепрощение. Единственное, что у меня никак не укладывалось в голове, это как мои друзья могут в этот момент учиться (!!!), ведь я здесь и мне так хорошо, а они учатся, работаю, делают какие-то свои дела, как они не понимают того, что все в мире прекрасно и все должно быть именно так, как я сейчас вижу. Я даже хотела позвонить маме на работу и рассказать ей, что они не правильно живут. Слава богу, я еще что-то соображала и не сделала это.
На ковре и потолке происходил самый красивый и завораживающий танец узоров, стены меняли свои цвет от красного (но не яркого агрессивного, а доброго и мягкого), до слабо розового. В воздухе, копируя малейший звук, плавали и двигались различные штучки (круги, полоски и другие фигуры, но все разные). Я ВИДЕЛА (!) МУЗЫКУ. Каждый ее новый звук. Была такая композиция, где кто-то сказал, что-то типа я уже не помню, факт в том, что он сказал по-английски "грибы", после чего был такой звук, как будто что-то очень быстро приближается ко мне. Звук нарастал и я увидела, как огромный гриб летит на меня, тогда я упала на диван, а гриб проплыл мимо к окну.
Кстати, все картинки под музыку были как бы просто обведены контуром подсвеченным, т.е. я не видела красный мухомор с белыми пятнами, например, а просто контур гриба из желто-зелено-голубого цвета, который светился.
Музыка тоже была волшебной, т.к. я понимала, что люди, ее написавшие, писали ее для нас и прибывали они в таком же состоянии, как и мы. Чувство, что все, что тебя окружает, было сделано специально для тебя и те, кто
те, кто делал это, знали о твоем состоянии, очень удивляло, но в то же время приносило неописуемое наслаждение.
Потом я поняла, что хочу пить и мы налили сок в прозрачные стаканы, но это был не сок - это были кристаллики оранжевого цвета, они снизу были тоненькие, а к верху расширялись, между ними были расстояния и они очень красиво колыхались, как будто водоросли под водой. Я хотела еще сильнее наклонить стакан, но мальчик разгадал мои намерения и вырвал его у меня, сказав, что не надо только опрокидывать стакан, чтобы посмотреть, как выльется сок. Затем появилась мысль, что мне хочется курить, а мальчик стал говорить, что это вовсе не так. Но мне все равно хотелось, а сигарет не было. Я пыталась выйти на улицу, ломилась в дверь и смеялась, но он меня не пускал и пытался успокоить, отговорить от столь глупой затеи. Потом я стала гладить дверь (она тоже была красивая, а мальчик внезапно сказал, что он, наверное, тоже курить хочет, через пару секунд вдруг выдав, что нет, после чего задумался, засмеялся и сказал, что он не знает, чего хочет. В магазин мы так и не попали, т.к. он не пустил, сказал, что я сейчас начну бегать всем в любви признаваться, забуду, зачем пошла и вообще, короче, остались мы дома.
Мои джинсы, оказывается, живые! Я видела маленькие, короткие толстенькие волокна (как червячки), они шевелились, из них состояли мои джинсы. На руках у меня тоже были какие-то молекулы или что-то типа того. Если я двигала рукой, то за ней тянулся шлейф. Все это было очень красиво и воспринималось моим мозгом, как естественные вещи, казалось, что я просто была слишком невнимательна и не замечала такие очевидные вещи, что всю жизнь окружали меня.
Мне хотелось остаться в том мире навсегда в том «всепонимании» и «всезнании» мне это ужасно нравилось и представлялось единственно правильным жизненным путем, что может быть у человека и конкретно у меня.
Потом все как-то резко закончилось, просто все прошло и стало почти обычно. Мы были голодные ужасно (в 10 утра съели, в 18 нас отпустило). Сходили в душ, т.к. очень вспотели
Дата добавления: 2018-11-24; просмотров: 374; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
