Вычисление молярности растворов
И равновесных концентраций
Пример. В системе А (г.) + 2В (г.) = С (г.) равновесные концентрации равны: [A] = 0,06 моль/л; [B] = 0,12 моль/л; [C] = 0,216 моль/л. Найти константу равновесия реакции и исходные концентрации веществ А и В.
Решение. Константа равновесия данной реакции выражается уравнением:
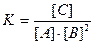
Подставляя в него данные задачи, получаем:
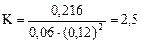
Для нахождения исходных концентраций веществ А и В учтем, что, согласно уравнению реакции, из 1 моль А и 2 моль В образуется 1 моль С. Поскольку по условию задачи в каждом литре системы образовалось 0,216 моль вещества С, то при этом было израсходовано 0,216 моль А и 0,216•2 = 0,432 моль В.
| Исходные вещества | А | В | С |
| Равновесные концентрации | [A]p = 0,06 моль/л | [B]р = 0,12 моль/л | [C]р = 0,216 моль/л |
| Соотношение реагирующих веществ | 1 | 2 | 1 |
| Количество израсходованного/обра- Зовавшегося вещества в 1 л | 0,216 | 0,216 ∙ 2 = 0,432 | 0,216 |
| Исходные концентрации | [A]0 = 0,06 + 0,216 = 0,276 моль/л | [B]0 = 0,12 + 0,432 = 0,552 моль/л | 0 |
Таким образом, исходные концентрации равны: [A]0 = 0,276 моль/л;
[B]0 = 0,552 моль/л.
Задачи для самостоятельного решения
77. Константа равновесия обратимой реакции А + В ↔ С + D pавны 1/3. Вычислить равновесные концентрации веществ А, В, C и D (моль/л), если начальные концентрации равны: [А] = 2 моль/л и [В] = 4 моль/л.
78. Обратимая реакция, выражается уравнением А + В ↔ С + D константа равновесия равна 1. Начальные концентрации; [А] = 3 моль/л и [В] = 2 моль/л. Вычислить равновесные концентрации всех участвующих в реакции веществ.
|
|
|
79. В равновесной системе А + В ↔ С + D начальные концентр веществ А и В соответственно равны 4 моль/л и 3 моль/л. Равновесная концентрация [А] = 2 моль/л. Найти равновесные концентрации веществ В, С и D и константу равновесия. Сколько молей вещества В надо ввести в систему для того, чтобы прореагировало ещё 50% от равновесного количества вещества А? Как смещается при этом равновесие реакции и отвечает ли его направление смещения принципу Ле-Шателье?
80. Константа paвновесия системы СО + H2O ↔ СO2 + H2 пpи некоторой температуре равна 1. Вычислить процентный состав смеси в состоянии равновесия если начальные концентрации СО и H2 составляли по 1 моль/л.
81. При некоторой температуре равновесные концентрации реакции
2SО2 + О2 ↔ 2SО3 составляли соответственно [SО2] = 0,04 моль/л, [О2] = 0,06 моль/л, [SО3]= 0,02 моль/л. Вычислить константу равновесия и исходные концентрации оксида серы (IV) и кислорода.
82. Равновесие реакции 4HCl (г) + O2 ↔ 2H2O (г) + 2С12 установилось при следующих концентрациях: [Н2O](г) = [Сl2] = 0,14, [НCl](г) = 0,2 и [О2]= 0,32 моль/л. Вычислить константу равновесия и начальную концентрацию кислорода.
83. Константа равновесия системы 2N2 + O2 « 2N2O равна 1,21. Равновесные концентрации: [N2] = 0,72 и [N2О] = 0,84 моль/л. Найти начальную и равновесную концентрации кислорода.
|
|
|
84. Равновесные концентрации веществ в обратимой реакции N2 + 3H2 « 2NH3 составляют (моль/л): [N2] = 4; [Н2] = 9; [NH3] = 6. Вычислить исходные концентрации азота и водорода и константу равновесия.
85. Равновесные концентрации веществ обратимой реакции 2SО2 + О2 ↔ 2SО3 составляют (моль/л): [SО2]= 0,0002; [О2]= 0,004; [SО3]= 0,003. Найти исходные концентрации кислорода и сернистого газа. Вычислить константу равновесия.
86. Вычислить начальные концентрации хлора и оксида углерода, а также константу равновесия реакции СО + Сl2 « СОСl2, если равновесные концентрации (моль/л): [С12] = 0,3, [СО] = 0,2; [СОСl2] = 1,5.
87. Определить равновесную концентрацию водорода в системе 2HJ « H2 + J2, если исходная концентрация HJ составляла 0,05 моль/л, а константа равновесия равна 0,02.
88. Константа равновесия реакции N2 + 3H2 « 2NH3 равна 0,1. Рвновесные концентрации [Н2] = 0,2 моль/л и [NH3] = 0,08 моль/л. Вычислить начальную и равновесную концентрации азота.
89. Найти равновесные концентрации водорода и йода в системе H2 + J2 « 2HJ, если их начальные концентрации составляли соответственно 0,5 и 1,5 моль/л соответственно, а равновесная концентрация [HI] равна 0,8 моль/л.
|
|
|
90. Константа равновесия реакции СО + H2O ↔ СO2 + H2 при 10900С равна 0,51. Найти состав реакционной смеси в момент достижения равновесия, если в реакцию введено по одному моль оксида углерода (II) и водяного пара.
91. Равновесная концентрация HJ в системе H2 + J2 « 2HJ равна 0,04 моль/л, а равновесные концентрации водорода и йода составляют по 0,08 моль/л. Вычислить константу равновесия.
92. Исходные концентрации окиси углерода (ІІ) и паров воды равны и составляют по 0,03 моль/л. Вычислить равновесные концентрации СО, H2O и Н2 в системе СО + H2O ↔ СO2 + H2, если равновесная концентрация СO2 оказалась равной 0,01.
Дата добавления: 2018-11-24; просмотров: 921; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
