Л а б о р а т о р н а я р а б о т а. Определение массы гидроксида натрия в растворе
Цель работы: Приобрести навыки выполнения титриметрического анализа.
Оборудование и реактивы: Бюретка вместимостью 25 мл, пипетка Мора вместимостью 5 мл, мерная колба вместимостью 100 мл, коническая колба вместимостью 250 мл, конические колбы вместимостью 50 – 100 мл, растворы кислоты и щелочи, раствор фенолфталеина, вода дистиллированная.
Сущность работы:
Ацидиметрическое определение массы щелочи в растворе по реакции:
NaOH + HNO3 ¾® NaNO3 + H2O
Концентрация щелочи в контрольном растворе рассчитывается по результатам кислотно-основного титрования:
с(HNO3)×V(HNO3)
с(NaOH) = ¾¾¾¾¾¾
Vа(NaOH)
Масса вещества в растворе рассчитывается по формуле:
m (NaOH) = c(NaOH)× V(NaOH)× M(NaOH)
Ход работы.
1. Бюретку заполняют стандартизованным раствором HNO3.
2. Контрольный раствор NaOH переносят из пробирки в мерную колбу, объем раствора доводят до метки дистиллированной водой.
3. Раствор перемешивают и переносят в коническую колбу (250 мл), из которой берут пробы для титрования (аликвотные доли) с помощью пипетки Мора.
4. Каждую аликвотную долю переносят в 5 сухих конических колб для титрования. В каждую колбу добавляют по 2 капли индикатора.
5. Титруют растворы в колбах по очереди до изменения окраски индикатора. Перед каждым последующим титрованием доливают титрант в бюретку до нулевого деления.
|
|
|
Обработка результатов.
Концентрация титранта с(HNO3) = ______________ моль/л
Объем анализируемого раствора
после разбавления V(NaOH) = __________ мл
Аликвотная доля анализируемого раствора
после разбавления Vа(NaOH) = _________ мл
Результаты титрования V(HNO3), мл 1 _________________
2 _________________
3 _________________
Среднее значение V(HNO3), мл _________________
Расчеты.
Вывод:
Задания для самостоятельной работы
1) Вычислите объем раствора азотной кислоты с концентрацией 0,065 моль/л, необходимый для титрования раствора, содержащего 0,1 г гидроксида калия.
2) Раствор муравьиной кислоты массой 2,32 г разбавлен водой до 100 мл. На титрование 10 мл разбавленного раствора затрачено 7,2 мл раствора гидроксида калия с концентрацией 0,15 моль/л. Рассчитайте массовую долю муравьиной кислоты в исходном растворе.
|
|
|
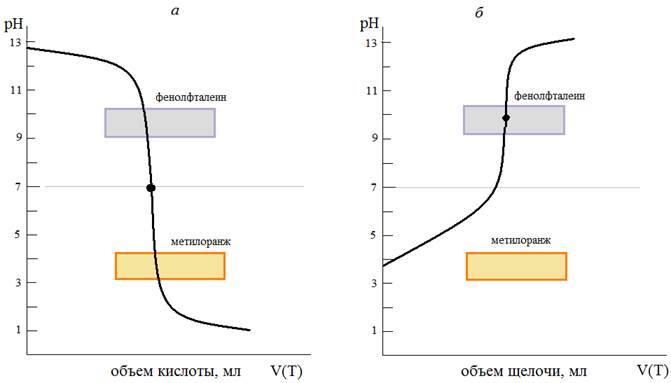
Рис.1. Кривые титрования: сильного основания (щелочи) сильной кислотой (а) и слабой кислоты сильным основанием (б).

Рис.2. Оборудование для титриметрического анализа: а – бюретки; б – пипетки; в – мерная колба; г – коническая колба.

Рис.3. Этапы выполнения титриметрического анализа (пояснения в тексте).
Дата добавления: 2018-11-24; просмотров: 203; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
