Электронов на квантовых уровнях и подуровнях
| Энергети-ческий уровень | Энергети-ческий подуровень | Возможные значения магнитного квантового числа m | Число орбиталей | Максимальное число электронов | ||
| в под-уровне (2l + 1) | в уровне n2 | на под-уровне 2(2l + 1) | на уровне 2n2 | |||
| K (n = 1) | s (l = 0) | 0 | 1 | 1 | 2 | 2 |
| L (n = 2) | s (l = 0) p (l = 1) | 0 -1; 0; +1 | 1 3 | 4 | 2 6 | 8 |
| M (n = 3) | s (l = 0) p (l = 1) d (l = 2) | 0 -1; 0; +1 -2; -1; 0 +1; +2 | 1 3 5 | 9 | 2 6 10 | 18 |
| N (n = 4) | s (l = 0) p (l = 1) d (l = 2) f (l = 3) | 0 -1; 0; +1 -2; -1; 0 +1; +2 -3; -2; -1; 0; +1; +2; +3 | 1 3 5 7 | 16 | 2 6 10 14 | 32 |
|
|
Рис. 1 Формы s-, p- и d-электронных облаков (орбиталей)
Пример 2. Составьте электронные формулы атомов элементов с порядковыми номерами 16 и 22. Покажите распределение электронов этих атомов по квантовым (энергетическим) ячейкам.
Решение. Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов п l Z, где п— главное квантовое число, l — орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение — s , p , d , f) z — число электронов на данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией — меньшая сумма п+ l(правило Клечковского). Последовательность заполнения энергетических уровней и подуровней следующая:
|
|
|
1s ® 2s ® 2р ® 3s ® Зр ® 4s ® 3d ® 4р ® 5s ® 4d ® 5p ® 6s ® (5d1) ® 4f ® 5d ® 6р ® 7s ® (6d1-2) ® 5f ® 6d ® 7p
Так как число электронов в атоме элемента равно его порядковому номеру в таблице Д.И. Менделеева, то для элементов № 16 (сера) и № 22 (титан) электронные формулы имеют вид
16S 1s22s22p63s23p4 ; 22Ti 1s22s22p63s23p63d24s2.
Электронная структура атома может быть изображена также в виде схем размещения электронов в квантовых (энергетических) ячейках, которые являются схематическим изображением атомных орбиталей (АО).
Квантовую ячейку обозначают в виде прямоугольника, кружка или линейки, а электроны в этих ячейках обозначают стрелками.
 | |||||
 | |||||
 | |||||
В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами. Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда):
| 16 S | s | ssss | ||||||||
| n = 1 | ↑↓ | p | ||||||||
| n = 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | d | |||||
| n = 3 | ↑↓ | ↑↓ | ↑ | ↑ | ||||||
1s22s22p63s23p4
| 22 Ti | s | 1s22s22p63s23p63d24s2. | ||||||||||||||||
| n = 1 | ↑↓ | p | ||||||||||||||||
| n = 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | d
| |||||||||||||
| n = 3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | f | |||||||||||
| n = 4 | ↑↓ | |||||||||||||||||
Пример З. Изотоп 101-го элемента — менделевия (256) был получен бомбардировкой a-частицами ядер атомов эйнштейния (253). Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
Решение. Превращение атомных ядер обусловливается их взаимодействием с элементарными частицами или друг с другом. Ядерные реакции связаны с изменением состава ядер атомов химических элементов. С помощью ядерных реакций можно из атомов одних элементов получить атомы других.
Превращение атомных ядер как при естественной, так и при искусственной радиоактивности записывают в виде уравнений ядерных реакций. При этом следует помнить, что суммы массовых чисел (цифры, стоящие у символа элемента вверху слева) и алгебраические суммы зарядов (цифры, стоящие у символа элемента внизу слева) в левой и правой частях равенства должны быть равны. Данную ядерную реакцию выражают уравнением
 Es +
Es +  He =
He =  Md +
Md +  n.
n.
Часто применяют сокращенную форму записи. Для приведенной реакции она имеет вид 253Es (a, n) 256Md. В скобках пишут бомбардирующую частицу, а через запятую — частицу, образующуюся в данном процессе. В сокращенных уравнениях частицы 42He; 11H; 21D; 10n обозначают соответственно α, р, d , п.
|
|
|
Пример 4. Исходя из сокращенных уравнений ядерных реакций
(табл. 2), напишите их полные уравнения.
Решение. Ответ на вопрос см. в табл. 2.
Таблица 2. Сокращенные и полные уравнения ядерных реакций
| Сокращенные уравнения | Полные уравнения |
| 27Al(p,a) 24Mg |  Al + Al +  H = H = 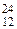 Mg + Mg +  He He
|
| 9Be(a,n) 12C | 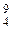 Be + Be +  He = He =  C + C + 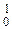 n n
|
| 59Co(n,a) 56Mn |  Co + Co + 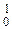 n = n = 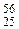 Mn + Mn +  He He
|
| 14N(n,p) 14C |  N + N + 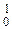 n = n =  C + C + 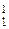 H H
|
| 32S(d,a) 30P | 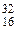 S + S + 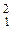 D = D =  P + P +  He He
|
КОНТРОЛЬНЫЕ ВОПРОСЫ
21. Напишите электронные формулы атомов элементов порядковыми номерами 9 и 28. Покажите распределение элементов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
22. Напишите электронные формулы атомов элементов с порядковыми номерами 16 и 26. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
23. Какое максимальное число электронов могут иметь s -, р-, d - и f -орбитали данного энергетического уровня? Почему? Напишите электронную формулу атома элемента с порядковым номером 31.
|
|
|
24. Напишите электронные формулы атомов элементов с порядковыми номерами 25 и 34. К какому электронному семейству относится каждый из этих элементов?
25. Какие орбитали атома заполняются электронами раньше: 4 s или 3d; 5 s или 4р? Почему? Напишите электронную формулу атома элемента с порядковым номером 21.
26. Изотоп никеля-57 образуется при бомбардировке α-частицами ядер атомов железа-54. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
27. Какие орбитали атома заполняются электронами раньше: 4 d или 5 s ; 6 s или 5р7 Почему? Напишите электронную формулу атома элемента с порядковым номером 43.
28. Что такое изотопы? Чем можно объяснить, что у
большинства элементов периодической системы атомные массы выражаются дробным числом? Могут ли атомы разных элементов иметь одинаковую массу? Как называются подобные атомы?
29. Изотоп кремния-30 образуется при бомбардировке α-частицами ядер атомов алюминия-27. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
30. Напишите электронные формулы атомов элементов с порядковыми номерами 14 и 40. Сколько свободных З d -орбиталей у атомов последнего элемента?
31. Изотоп углерода-11 образуется при бомбардировке протонами ядер атомов азота-14. Составьте уравнение этой ядерной реакции и напишите его в сокращенной форме.
32. Напишите электронные формулы атомов элементов с порядковыми номерами 15 и 28. Чему равен максимальный спин p-электронов у атомов первого и d -электронов у атомов второго элемента?
33. Напишите электронные формулы атомов элементов с порядковыми номерами 21 и 23. Сколько свободных З d-орбиталей в атомах этих элементов?
34. Сколько и какие значения может принимать магнитное квантовое число m 1 при орбитальном числе l = 0, 1, 2 и 3? Какие элементы в периодической системе называют s —, p -, d - и f - элементами? Приведите примеры.
35. Какие значения могут принимать квантовые числа п, l , m 1ms ,характеризующие состояние электронов в атоме? Какие значения они принимают для внешних электронов атома магния?
36. Какие из электронных формул, отражающих строение невозбужденного атома некоторого элемента, неверны:
а) 1 s 2 2 s 2 2 p 5 3 s 1 б) Is 2 2 s 2 2 p 6 ; в) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 4 ; г) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 ;
д) Is 2 2 s 2 2 p 6 3 s 2 3 d 2 ? Почему? Атомам каких элементов отвечают
правильно составленные электронные формулы?
37. Напишите электронные формулы атомов элементов c порядковыми номерами 24 и 33, учитывая, что у первого происходит «провал» одного
4s-электрона на Зd-подуровень. Чему равен максимальный спин
d-электронов у атомов первого и р-электронов у атомов второго элемента?
38. Квантовые числа для электронов внешнего энергетического
уровня атомов некоторых элементов имеют следующие значения:
п = 4;l = 0; т l = 0; ms = ± 1/2. Напишите электронные формулы атомов этих элементов и определите, сколько свободных 3d- орбиталей содержит каждый из них.
39. В чем заключается принцип Паули? Может ли быть на каком-нибудь подуровне атома р7- или d12-электронов? Почему? Составьте электронную формулу атома элемента с порядковым номером 22 и укажите его валентные электроны.
40. Составьте электронные формулы атомов элементов с порядковыми номерами 32 и 42, учитывая, что у последнего происходит «провал» одного 5s-электрона на 4 d-подуровень. К какому электронному семейству относится каждый из этих элементов?
Дата добавления: 2018-11-24; просмотров: 381; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

