При твердении протекает реакция 5 страница
Таблица 5. Стандартная энергия Гиббса образования ΔG°298 некоторых веществ
| Вещество | Состояние | ΔG° 298, кДж/моль | Вещество | Состояние | ΔG°298, кДж/моль |
| ВаСО3 | к | -1138,8 | FeO | к | -244,3 |
| СаСО3 | к | -1128,75 | Н2О | ж | -237,19 |
| Fe3O4 | к | -1014,2 | Н2О | г | -228,59 |
| ВеСО3 | к | -944,75 | PbO2 | к | -219,0 |
| СаО | к | -604,2 | СО | г | -137,27 |
| ВеО | к | -581,61 | СН4 | г | -50,79 |
| ВаО | к | -528,4 | NO2 | г | +51,84 |
| СО2 | г | -394,38 | NO | г | +86,69 |
| NaCl | к | -384,03 | С2Н2 | г | +209,20 |
| ZnO | к | -318,2 | NaF | - 585,59 |
Пример 1. В каком состоянии энтропия 1 моль вещества больше: в кристаллическом или в парообразном состоянии при той же температуре?
Решение. Энтропия есть мера неупорядоченности состояния вещества. В кристалле частицы (атомы, ионы) расположены упорядоченно и могут находиться лишь в определенных точках пространства, а для газа таких ограничений нет. Объем 1 моль газа гораздо больше, чем объем 1 моль кристаллического вещества; возможность хаотичного движения молекул газа больше. А так как энтропию можно рассматривать как количественную меру хаотичности атомно-молекулярной структуры вещества, то энтропия 1 моль паров вещества больше энтропии 1 моль его кристаллов при одинаковой температуре.
Пример 2. Прямая или обратная реакция будет протекать при стандартных условиях в системе
СН4 (г) + СО2 (г) ↔ 2СО (г) + 2Н2 (г)
Решение. Для ответа на вопрос следует вычислить ΔG0298 прямой реакции. Значения ΔG0298 соответствующих веществ приведены в табл. 6. Зная, что ΔG есть функция состояния и что ΔG для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны нулю, находим ΔG0298 процесса:
|
|
|
ΔG0298 = 2 (-137,27) + 2 (0) – (-50,79 – 394,38) = +170,63 кДж
То, что ΔG0298 > 0, указывает на невозможность самопроизвольного протекания прямой реакции при Т = 2980К и равенстве давлений взятых газов 1,013∙105 Па (760 мм рт. ст. = 1 атм).
Таблица 6. Стандартные абсолютные энтропии S ° 298 некоторых веществ.
| Вещество | Состояние | S°298, Дж/(моль∙К) | Вещество | Состояние | S°298, Дж/(моль∙К) |
| C | Алмаз | 2,44 | H2O | г | 188,72 |
| C | Графит | 5,69 | N2 | г | 191,49 |
| Fe | к | 27,2 | NH3 | г | 192,50 |
| Ti | к | 30,7 | CO | г | 197,91 |
| S | Ромб. | 31,9 | C2H2 | г | 200,82 |
| TiO2 | к | 50,3 | O2 | г | 205,03 |
| FeO | к | 54,0 | H2S | г | 205,64 |
| H2O | ж | 69,94 | NO | г | 210,20 |
| Fe2O3 | к | 89,96 | CO2 | г | 213,65 |
| NH4Cl | к | 94,5 | C2H4 | г | 219,45 |
| CH3OH | ж | 126,8 | Cl2 | г | 222,95 |
| H2 | г | 130,59 | NO2 | г | 240,46 |
| Fe3O4 | к | 146,4 | PCl3 | г | 311,66 |
| CH4 | г | 186,19 | PCl5 | г | 352,71 |
| HCl | г | 186,68 |
Пример 3. На основании стандартных теплот образования (табл. 4.) и абсолютных стандартных энтропий веществ (табл.6.) вычислите DGo298 реакции, протекающей по уравнению:
|
|
|
CO (г.) + H2O (г.) = CO2 (г.) + H2 (г.)
Решение. DGo298 = DHo – T DSo ; DH и DS – функции состояния, поэтому
DHoх.р.= S DHoпрод.- S DHoисх.; DSoх.р.= S Soпрод.- S DSoисх.;
DS х.р.= (213,65 + 130,59) – ( 197,91 + 69,94) = +76,39 = 0,07639 кДж / (моль·К);
DGo = +2,85 – 298 · 0,07639 = -19,91 кДж.
Пример 4. Реакция восстановления Fe2O3 водородом протекает по уравнению:
Fe2O3(кр.) + 3H2(г.) = 2Fe(кр.) + 3H2O(г.); DH = +96,61 кДж.
Возможна ли эта реакция при стандартных условиях, если изменение энтропии DS = 0,1387 кДж / (моль· К)? При какой температуре начнется восстановление Fe2O3?
Решение. Вычисляем DGo реакции:
DG = DH – T DS = 96,61 – 298 · 0,1387 = + 55,28 кДж.
Так как DG > 0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой DG = 0:
DH = T DS; T = 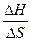 =
= 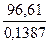 =696,5 К.
=696,5 К.
Следовательно, при температуре 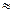 696,5К начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
696,5К начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
Пример 5. Вычислите DHo, DSo, и DGoТ реакции протекающей по уравнению
Fe2O3(кр.) + 3С(кр.) = 2Fe(кр.) + 3СO(г.);
Возможна ли реация восстановления Fe2O3(кр.) углеродом при температурах 500 и 1000 К?
Решение. DHoх.р. и DSoх.р находим из соотношений (1) и (2) так же, как в примере 3:
DHoх.р. = [3(-110,52) + 2·0]-[-822,10 + 3·0] = -331,56 + 822,10 = +490,54 кДж;
DSoх.р = (2· 27,2 + 3·197,91) – (89,96 + 3· 5,69) = 541,1 Дж/К.
|
|
|
Энергию Гиббса при соответствующих температурах находим из соотношения DGoТ = =DHo – T DSo:
DGo500 = 490,54 - 500· 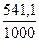 = +219,99 кДж;
= +219,99 кДж;
DGo1000 = 490,54 - 1000· 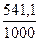 = -50,56 кДж;
= -50,56 кДж;
Так как DGo500 > 0, а DGo1000 < 0, то восстановление Fe2O3 углеродом возможно при 1000 К и невозможно при 500 К.
Контрольные вопросы
101. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите ΔG0298 реакции, протекающей по уравнению 4NН3(г) + 5О2(г) = 4NО(г) + 6Н2О(г). Возможна ли эта реакция при стандартных условиях? Ответ: —957,77 кДж.
102. На основании стандартных теплот образования и абсолютных стандартных энтропии соответствующих веществ вычислите ΔG0298 реакции, протекающей по уравнению СО2 (г) + 4Н2 (г) = СН4(г) + 2Н2О(ж)
Возможна ли эта реакция при стандартных условиях? Ответ: —130,89 кДж.
103. Вычислите ∆Н, ΔS и ΔGТ реакции, протекающей по уравнению
Fe2O3 (к) + 3Н2 (г) = 2Fe (к) + 3Н2О(г) Возможна ли реакция восстановления Fe2O3 водородом при температурах 500 и 2000 К? Ответ: +96,61 кДж; 138,83 Дж/К; 27,2 кДж; -181,05 кДж.
104. Какие из карбонатов: ВеСО3, СаСО3 или ВаСО3 — можно получить по реакции взаимодействия соответствующих оксидов с СО2? Какая реакция идет наиболее энергично? Вывод сделайте, вычислив ΔG°298 реакций. Ответ: +31,24 кДж; -130,17 кДж; -216,02 кДж.
|
|
|
105. На основании стандартных теплот образования и абсолютных стандартных энтропии соответствующих веществ вычислите ΔG0298 реакции, протекающей по уравнению СО (г) + 3Н2 (г) = СН4(г) + Н2О(г). Возможна ли эта реакция при стандартных условиях? Ответ: —142,16 кДж.
106. Вычислите ∆Но, ΔSо и ΔGо реакции, протекающей по уравнению
ТіО2 (к) + 2С (к) = Ті (к) + 2СО(г). Возможна ли реакция восстановления ТіО2 углеродом при температурах 1000 и 3000 К? Ответ: +722,86 кДж; 364,84 Дж/К; +358,02 кДж; -371,66 кДж.
107. На основании стандартных теплот образования и абсолютных стандартных энтропии соответствующих веществ вычислите ΔG0298 реакции, протекающей по уравнению С2Н4(г) + 3О2 (г) = 2СО2 + 2Н2О(ж)
Возможна ли эта реакция при стандартных условиях? Ответ: —1331,21 кДж.
108. Определите, при какой температуре начнется реакция восстановления Fe3O4 , протекающая по уравнению
Fe3O4 (к) + СО (г) = 3FeО (к) + СО2 (г) ∆Н = +34,55 Кдж
Ответ: 1102,4 К.
109. Вычислите, при какой температуре начнется диссоциация пентахлорида фосфора, протекающая по уравнению
РС15(г) = РС13(г) + С12(г) ∆Н = + 92,59 Кдж
Ответ: 509 К.
110. Вычислите изменение энтропии для реакций, протекающих по уравнениям:
2СН4(г) = С2Н2(г) + 3Н2 (г)
N2(г) + 3Н2 (г) = 2NН3 (г)
С(графит) + О2(г) = СО2 (г)
Почему в этих реакциях ΔSо > 0; < 0; ≈ 0?
Ответ: 220,21 Дж/К; -198,26 Дж/К; 2,93 Дж/К.
111. Вычислите ΔG0298 для следующих реакций:
а) 2NaF (к) + Cl2 (г) = 2NaCl (к) + F2 (г)
б) PbO2 (к) + 2Zn (к) = Pb (к) + 2ZnO (к)
Можно ли получить фтор по реакции (а) и восстановить РЬО2 цинком по реакции (б)? Ответ: + 313,94 кДж; -417,4 кДж.
112. При какой температуре наступит равновесие системы
4НС1 (г) + О2 (г) ↔ 2Н2О (г) + 2С12 (г); ∆Н = -114,42 кДж
Хлор или кислород в этой системе является более сильным окислителем и при каких температурах? Ответ: 891 К.
113. Восстановление Fe3O4 оксидом углерода идет по уравнению
Fe3O4 (к) + СО (г) = 3FeO (к) + СО2 (г). Вычислите ΔG0298 и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно ΔS0298 в этом процессе? Ответ: +24,19 кДж; +31,34 Дж/ (моль · К).
114. Реакция горения ацетилена идет по уравнению
С2Н2 (г) + 5/2О2 (г) = 2СО2 (г) + Н2О (ж)
Вычислите ΔG0298 и ΔS0298. Объясните уменьшение энтропии в результате этой реакции. Ответ: -1235,15 кДж; -216,15 Дж/(моль · К)
115. Уменьшается или увеличивается энтропия при переходах: а) воды в пар; б) графита в алмаз? Почему? Вычислите ΔS0298 каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях. Ответ: а) 118,78 Дж/(моль·К); б) -3,25 Дж/(моль·К).
116. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция Н2(г) + СО2 (г) = СО (г) + Н2О (ж); ∆Н = -2,85 кДж
Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите ΔG0298 этой реакции. Ответ: +19,91 кДж.
117. Прямая или обратная реакция будет протекать при стандартных условиях в системе 2NО (г) + О2 = 2NО2 (г). Ответ мотивируйте, вычислив ΔG0298 прямой реакции. Ответ: -69,70 кДж.
118. Исходя из значений стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, вычислите ΔG0298 реакции, протекающей по уравнению NН3(г) + НС1(г) = NН4С1(к). Может ли эта реакция при стандартных условиях идти самопроизвольно? Ответ: -92,08 кДж.
119. При какой температуре наступит равновесие системы
СО (г) + 2Н2(г) = СН3ОН (ж) ∆Н = -128,05 кДж
Ответ: 385,5 К.
120. При какой температуре наступит равновесие системы
СН4(г) + СО2 (г) = 2СО (г) + 2Н2 (г) ∆Н = +247,37 кДж
Ответ: 961,9 К.
ТЕМА: Химическая кинетика и равновесие
Кинетика — учение о скорости различных процессов, в том числе химических реакций. Критерием принципиальной осуществимости реакций является неравенство ΔGР,Т < 0. Но это неравенство не является еще полной гарантией фактического течения процесса в данных условиях, не является достаточным для оценки кинетических возможностей реакции.
Так, ΔGо298,Н2О = -228,59 кДж/моль, а ΔGо298,А1С13 = -313,8 кДж/моль и, следовательно, при Т = 298 К и Р = 1,013 • 105 Па возможны реакции, идущие по уравнениям:
Н2(г) + ½О2(г) = Н2О(г)
2А1 (к) + 3I2 (к) = 2А1I3(к)
Однако эти реакции при стандартных условиях идут только в присутствии катализатора (платины для первой и воды для второй). Катализатор как бы снимает кинетический "тормоз", и тогда проявляется термодинамическая природа вещества.
Скорость химических реакций зависит от многих факторов, основные из которых — концентрация (давление) реагентов, температура и действие катализатора. Эти же факторы определяют и достижение равновесия в реагирующей системе.
Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе
2SO2(г) + O2(г) = 2SO3(г),
если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Решение. Обозначим концентрации реагирующих веществ: [SO2] = а; [O2] = b; [SO3] = с. Согласно закону действия масс скорости V прямой и обратной реакции до изменения объема
Vпр = К а2b; Vобр = К1 с2;
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3а; [O2] = 3b; [SO3] = 3с. При новых концентрациях скорости V прямой и обратной реакции изменились
V`пр = К (3а)2 3b = 27∙Ка2b; V`обр = К1 (3с)2 = 9∙К1 с2 ;
Отсюда
V`пр /Vпр = 27∙Ка2b/К а2b =27; V`обр /Vобр = 9∙К1 с2 /К1 с2 = 9
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной — только в девять раз. Равновесие системы сместилось в сторону образования SO3.
Пример 2. Вычислите, во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70° С, если температурный коэффициент реакции равен 2.
Решение. Зависимость скорости химической реакции от температуры определяется эмпирическим правилом Вант-Гоффа по формуле
Vt(2)/Vt(1) = γΔt/10,
Где: Δt = t2 – t1 = 70 – 30 = 40оС.,
Vt(1) – скорость реакции при температуре t1;
Vt(2) - скорость реакции при температуре t2;
γ – температурный коэффициент, который показывает, как изменится скорость реакции при изменении температуры на 10 оС.
Vt(2)/Vt(1) = γΔt/10 = 240/10 =24 = 16.
Следовательно, скорость реакции Vt(2) при температуре 70º С больше скорости реакции Vt(1) при температуре 30° С в 16 раз.
Пример 3. Константа равновесия гомогенной системы
СО (г) + Н2О(г) = СО2 (г) + Н2(г)
при 850 С равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]исх = 3 моль/л, [Н2О]исх = 2 моль/л.
Дата добавления: 2018-11-24; просмотров: 243; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
