Краткие теоретические сведения
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОУ ВПО ЧЕРЕПОВЕЦКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Факультет общих математических и естественнонаучных дисциплин

Кафедра химии
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
ПО ДИСЦИПЛИНЕ
«ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ»
(Для студентов заочной формы обучения)
Часть 4
Учебно-методическое пособие
Специальности: 240301 Химическая технология
неорганических веществ; 280201 Охрана окру-
жающей среды и рациональное использование
природных ресурсов; 240801 Машины и аппара-
ты химических производств
Череповец
2007
Примеры решения задач по дисциплине «Общая и неорганическая химия» для студентов заочной формы обучения: В 4 ч. Ч. 4: Учеб.-метод. пособие. – Череповец: ГОУ ВПО ЧГУ, 2007. – с.
Рассмотрено на заседании кафедры химии, протокол № ___ от_________ .
Одобрено редакционно-издательской комиссией факультета общих математических и естественнонаучных дисциплин ГОУ ВПО ЧГУ, протокол № ___ от ________.
Составители: О.А. Калько – канд. техн. наук, доцент;
|
|
|
Ю.С. Кузнецова;
Н.В. Кунина
Рецензенты: С. Н. Балицкий – канд. хим. наук, доцент (ГОУ ВПО ЧГУ);
Л.Ю. Кудрявцева – канд. техн. наук, доцент (ГОУ ВПО ЧГУ)
Научный редактор: Г.А. Котенко – канд. хим. наук, профессор
© Калько О.А., Кунина Н.В.,
Кузнецова Ю.С., 2007
©ГОУ ВПО Череповецкий государст-
 венный университет, 2007
венный университет, 2007
ВВЕДЕНИЕ
Данное учебно-методическое пособие содержит краткие теоретические сведения и примеры решения задач по следующим темам курса «Общая и неорганическая химия»: окислительно-восстановительные реакции, электрохимические процессы, коррозия металлов. Пособие предназначено для студентов заочной формы обучения в качестве вспомогательного руководства при выполнении домашних контрольных работ. Содержание учебно-методического пособия соответствует государственному стандарту дисциплины «Общая и неорганическая химия» для химических специальностей.
|
|
|
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Краткие теоретические сведения
Окислительно-восстановительными реакциям называют такие химические процессы, в результате которых изменяются степени окисления одного или нескольких элементов.
Степенью окисления элемента (С.О.) называют число электронов смещенных к данному атому от других (отрицательная С.О.) или от данного атома к другим (положительная С.О.) в химическом соединении или ионе. Таким образом, степень окисления показывает условный заряд атома или иона в соединении.
Степень окисления обозначается арабскими цифрами с предшествующим знаком «+» или «–» над символом элемента. Например, в соединении хлорид бария 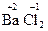 .
.
При определении С.О. элементов в различных веществах можно использовать следующие правила:
1. С.О. элемента в простом веществе равна нулю. Например: 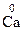 ,
, 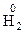 .
.
2. С.О. элемента в виде одноатомного иона в ионном соединении равна заряду иона, например: 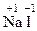 ,
, 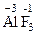 ,
, 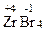 .
.
3. В соединениях с ковалентными полярными связями отрицательную С.О. имеет атом с наибольшим значением электроотрицательности (ЭО), причем для некоторых элементов характерны следующие С.О.:
|
|
|
- для фтора – «–1» во всех соединениях;
- для кислорода – «–2», за исключением пероксидов, где его С.О. = –1, надпероксидов (С.О. = –1/2), озонидов (С.О. = –1/3) и в соединении ОF2 (С.О. = +2);
- для водорода – «+1», за исключением солеобразных гидридов (С.О. = –1), например 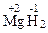 ;
;
- для щелочных и щелочно-земельных металлов С.О. = +1 и +2 соответственно.
4. Алгебраическая сумма С.О. всех элементов в нейтральной молекуле равна нулю, а в ионе – заряду иона.
Большинство элементов в веществах способны проявлять различные степени окисления. Например, определим С.О. азота в следующих веществах:
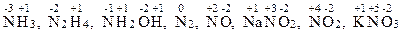 .
.
Любая окислительно-восстановительная реакция (ОВР) состоит из двух сопряженных процессов:
1. Окисление – это процесс отдачи электронов частицей, который приводит к повышению С.О. элемента
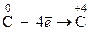
2. Восстановление – это процесс приема электронов частицей, который сопровождается уменьшением С.О. элемента
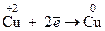
Вещества, отдающие свои электроны в процессе окисления, называются восстановителями, а вещества, принимающие электроны в процессе восстановления, являются окислителями. Если обозначить через Ох окисленную форму вещества, а через Red – восстановленную, то любая ОВР может быть представлена в виде суммы двух процессов:
|
|
|
Red1 – n ē ® Ox1 (окисление);
Ox2 + n ē ® Red2 (восстановление).
Проявление тех или иных окислительно-восстановительных свойств атомов зависит от многих факторов, важнейшие из которых – положение элемента в периодической системе, его С.О. в веществе, характер свойств, проявляемых другими участниками реакции. По окислительно-восстановительной активности вещества принято делить на три группы:
1. Типичные восстановители – это простые вещества, атомы которых имеют не высокие значения ЭО, например металлы, водород, углерод, а также частицы, в которых имеются атомы в минимальной (низшей) для них степени окисления, например хлор в соединении 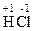 .
.
2. Типичные окислители – это простые вещества, атомы которых характеризуются высокой ЭО, например фтор и кислород, а также частицы, в составе которых имеются атомы в высшей (максимальной) С.О., например хром в соединении 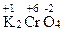 .
.
3. Вещества, обладающие окислительно-восстановительной двойственностью свойств – это многие неметаллы, например сера и фосфор, а также вещества, содержащие элементы в промежуточной С.О., например марганец в соединении 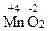 .
.
Типы ОВР
Реакции, в которых окислители и восстановители представляют собой различные вещества, называются межмолекулярными. Например
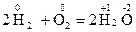
В некоторых реакциях окислителем и восстановителем являются атомы различных по природе элементов одной и той же молекулы, такие ОВР называются внутримолекулярными. Например
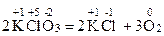
Реакции, в ходе которых окислителем и восстановителем является атом одного и того же элемента, находящегося в составе одного и того же вещества, называются реакциями диспропорционирования (иначе самоокисления-самовосстановления или дисмутации). Например
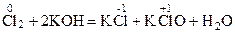 .
.
Расчет молярных эквивалентных масс МЭ окислителя или восстановителя в ОВР следует осуществлять по формуле
МЭ = 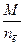 (1)
(1)
где М – молярная масса вещества, г/моль; n ē – число электронов, принятых окислителем или отданных восстановителем.
Существует несколько способов подбора коэффициентов в уравнениях ОВР, из которых наиболее распространены метод электронного баланса и метод ионно-электронных уравнений (иначе метод полуреакций). Оба метода основаны на реализации двух принципов:
1. Принцип материального баланса – число атомов всех элементов до и после реакции должно быть одинаковым;
2. Принцип электронного баланса – число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем.
Метод электронного баланса является универсальным, то есть им можно пользоваться для уравнивания ОВР, протекающих в любых условиях. Метод полуреакций применим для составления уравнений только таких окислительно-восстановительных процессов, которые протекают в растворах. Однако он имеет ряд преимуществ по сравнению с методом электронного баланса. В частности, при его использовании нет необходимости определять степени окисления элементов, кроме того, учитывается роль среды и реальное состояние частиц в растворе.
Основные этапы составления уравнений реакций по методу электронного баланса состоят в следующем:
1. Записывают схему реакции, определяют С.О. элементов, выявляют окислитель и восстановитель. Например:
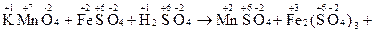 …
…
Очевидно, что С.О. изменяется у марганца (уменьшается) и у железа (увеличивается), таким образом, KMnO4 – окислитель, а FeSO4 – восстановитель.
2. Составляют полуреакции окисления и восстановления
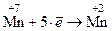 (восстановление)
(восстановление)
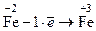 (окисление)
(окисление)
3. Балансируют количество принятых и отданных электронов путем переноса коэффициентов, стоящих перед электронами, в виде множителей, поменяв их местами
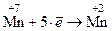 ½´ 1½´ 2
½´ 1½´ 2
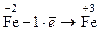 ½´ 5½´ 10
½´ 5½´ 10
Если коэффициенты кратны друг другу, их следует уменьшить, поделив каждый на наибольшее общее кратное. Если коэффициенты нечетные, а формула хотя бы одного вещества содержит четное количество атомов, то коэффициенты следует удвоить.
Так, в рассматриваемом примере коэффициенты перед электронами нечетные (1 и 5), а формула Fe2(SO4)3 содержит два атома железа, поэтому коэффициенты увеличиваем в два раза.
4. Записывают суммарную реакцию электронного баланса, при этом количество принятых и отданных электронов должно быть одинаковым и сократиться на данном этапе уравнивания
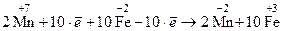
5. Расставляют коэффициенты в молекулярном уравнении реакции и вносят недостающие вещества. При этом коэффициенты перед веществами, которые содержат атомы элементов изменявших С.О., берутся из суммарной реакции электронного баланса, а атомы остальных элементов уравнивают обычным способом, соблюдая следующую последовательность:
- атомы металлов;
- атомы неметаллов (кроме кислорода и водорода);
- атомы водорода;
- атомы кислорода.
Для рассматриваемого примера
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O.
При уравнивании реакций методом ионно-электронных уравнений следует соблюдать следующую последовательность действий:
1. Записывают схему реакции, определяют С.О. элементов, выявляют окислитель и восстановитель. Например:
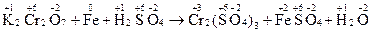
С.О. изменяется у хрома (уменьшается) и у железа (увеличивается), таким образом, K2Сr2O7 – окислитель, а Fe – восстановитель.
2. Записывают ионную схему реакции. При этом сильные электролиты записываются в виде ионов, а слабые электролиты, нерастворимые и малорастворимые вещества, а также газы оставляют в молекулярном виде. Для рассматриваемого процесса
K+ + Cr2O 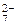 + Fe + H+ + SO
+ Fe + H+ + SO 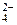 ® Cr3+ + SO
® Cr3+ + SO 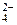 + Fe2+ + H2O
+ Fe2+ + H2O
3. Составляют уравнения ионных полуреакций. Для этого сначала уравнивают количество частиц, содержащих атомы элементов, изменявших свои С.О.
Cr2O 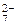 ® 2Cr3+
® 2Cr3+
Fe ® Fe2+
Далее уравнивают кислород и водород, используя частицы, определяющие характер раствора. Возможны три случая:
1) реакция в среде сильных кислот (рН < 7). В этом случае в уравнениях полуреакций рационально применять только ионы Н+ или молекулы Н2О. Если необходимо уменьшить количество атомов кислорода, то его связывают в молекулы воды, а если требуется добавить атом кислорода, то добавляют молекулу воды, при этом освобождается два иона водорода;
2) реакция в среде сильных оснований (рН > 7). Если необходимо отнять у соединения атом кислорода, то добавляют молекулу воды и освобождают два гидроксид иона, а если требуется добавить один атом кислорода, то вносят два иона ОН– и получают одну молекулу воды.
3) реакция в нейтральной среде (рН = 7). В таких реакциях рекомендуется в левую часть полуреакции добавлять только воду. При этом если нужно отдать кислород, то добавляют молекулу воды и получают два гидроксид иона, а если нужно добавить атом кислорода, то добавляют молекулу воды и получают два иона водорода.
Для рассматриваемого примера
Cr2O 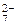 + 14Н+® 2Cr3+ + 7Н2О
+ 14Н+® 2Cr3+ + 7Н2О
Fe ® Fe2+
Затем уравнивают заряды с помощью прибавления или отнятия определенного количества электронов
[Cr2O 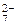 + 14Н+]12+ + 6 ē ® [2Cr3+ + 7Н2О]6+
+ 14Н+]12+ + 6 ē ® [2Cr3+ + 7Н2О]6+
Fe0 – 2 ē ® Fe2+
4. Балансируют количество принятых и отданных электронов так, как это описано в методе электронного баланса
[Cr2O 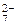 + 14Н+]12+ + 6 ē ® [2Cr3+ + 7Н2О]6+ ½´2½´1
+ 14Н+]12+ + 6 ē ® [2Cr3+ + 7Н2О]6+ ½´2½´1
Fe0 – 2 ē ® Fe2+ ½´6½´3
5. Записывают суммарную реакцию ионно-электронного баланса
Cr2O 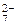 + 14H+ + 6 ē + 3Fe – 6 ē ® 2Cr3+ + 7H2O + 3Fe2+
+ 14H+ + 6 ē + 3Fe – 6 ē ® 2Cr3+ + 7H2O + 3Fe2+
6. Расставляют коэффициенты в молекулярном уравнении реакции
K2Cr2O7 + 3Fe + 7H2SO4 = Cr2(SO4)3 + 3FeSO4 + K2SO4 + 7H2O
Возможность и полноту самопроизвольного протекания ОВР в изобарно-изотермических условиях, как и любого другого химического процесса, можно оценить по знаку изменения свободной энергии Гиббса системы D G в ходе процесса.
Самопроизвольно при Р,Т = const в прямом направлении могут протекать реакции, для которых D G < 0.
Изменение энергии Гиббса окислительно-восстановительного процесса также равно электрической работе Аэлект, которую совершает система по перемещению электронов от восстановителя к окислителю, то есть
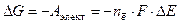 (2)
(2)
где DЕ – ЭДС окислительно-восстановительного процесса, В; F – постоянная Фарадея (F = 96485 » 96500 Кл/моль); n ē – число электронов, участвующих в данном процессе.
Из уравнения (2) вытекает, что условием самопроизвольного протекания ОВР в прямом направлении является положительное значение ЭДС окислительно-восстановительного процесса (DЕ > 0). Расчет ЭДС ОВР в стандартных условиях следует вести по уравнению
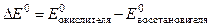 (3)
(3)
где Е 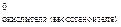 - стандартные окислительно-восстановительные потенциалы систем. Их значения определяются экспериментально и приведены в справочной литературе [8].
- стандартные окислительно-восстановительные потенциалы систем. Их значения определяются экспериментально и приведены в справочной литературе [8].
Примеры решения задач
Пример 1.Уравнять реакцию методом ионно-электронного баланса, вычислить молярные эквивалентные массы окислителя и восстановителя
As2S3 + HNO3 ® H3AsO4 + H2SO4 + NO
Р е ш е н и е
Определяем степени окисления элементов, выявляем окислитель и восстановитель
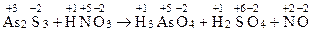
В данном процессе окислитель – НNO3, восстановитель – As2S3.
Составляем ионную схему реакции
As2S3¯ + H+ + NO 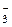 ® H+ + AsO
® H+ + AsO 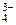 + SO
+ SO 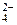 + NO
+ NO
Записываем ионно-электронные полуреакции и балансируем количество принятых и отданных электронов
[As2S3 + 20H2O]0 – 28ē ® [2AsO 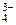 + 3SO
+ 3SO 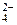 + 40H+]28+ ½´3
+ 40H+]28+ ½´3
[NO 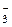 + 4H+]3+ + 3ē ® [NO + 2H2O]0 ½´28
+ 4H+]3+ + 3ē ® [NO + 2H2O]0 ½´28
Складываем полуреакции и упрощаем суммарную схему
3As2S3 + 60H2O + 28NO 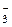 + 112H+ ® 6AsO
+ 112H+ ® 6AsO 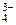 + 9SO
+ 9SO 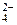 + 120H+ + 28NO + 56H2O
+ 120H+ + 28NO + 56H2O
3As2S3 + 4H2O + 28NO 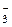 ® 6AsO
® 6AsO 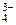 + 9SO
+ 9SO 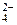 + 8H+ + 28NO
+ 8H+ + 28NO
Переносим коэффициенты в молекулярное уравнение и уравниваем количество атомов каждого элемента
3As2S3 + 28HNO3 + 4Н2О = 6H3AsO4 + 9H2SO4 + 28NO
Вычисляем молярные эквивалентные массы окислителя и восстановителя по формуле (1)
МЭ, окислителя = 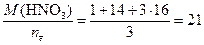 г/моль;
г/моль;
МЭ, восстановителя = 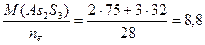 г/моль.
г/моль.
Пример 2.Определите направление протекания ОВР, ионная схема, которой следующая
Fe3+ + Cl– « Fe2+ + Cl2
Р е ш е н и е
В данном процессе ион Fe3+ - окислитель, а ион Cl– - восстановитель. По справочнику [8] находим потенциалы соответствующих полуреакций
Fe3+ + 1ē = Fe2+, E 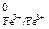 = 0,77 В
= 0,77 В
Cl2 + 2ē = 2Cl–, E 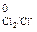 = 1,36 В
= 1,36 В
По формуле (3) вычислим ЭДС данного процесса
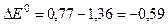 В.
В.
Так как значение DЕ0 < 0, то реакция идет самопроизвольно в обратном направлении.
Пример 3.Уравняйте окислительно-восстановительную реакцию, используя метод электронного баланса и ионно-электронных уравнений. Вычислите молярные эквивалентные массы окислителя и восстановителя, ЭДС и DG реакции, а также укажите направление протекания данной ОВР:
KMnO4 + KBr + H2O = MnO2 + Br2 + KOH.
Р е ш е н и е
Метод электронного баланса
Записываем схему реакции, определяем С.О. элементов, выявляем окислитель и восстановитель
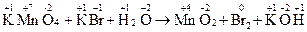
Степень окисления изменяется у марганца (уменьшается) и у брома (увеличивается), таким образом, KMnO4 – окислитель, а КBr – восстановитель.
Составляем полуреакции окисления и восстановления
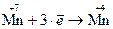 (восстановление)
(восстановление)
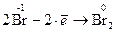 (окисление)
(окисление)
Балансируем количество принятых и отданных электронов

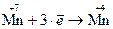 ´ 2
´ 2
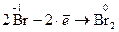 ´ 3
´ 3
Записываем суммарную реакцию электронного баланса
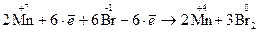
Расставляем коэффициенты в молекулярном уравнении реакции и уравниваем количество всех атомов
2KMnO4 + 6KBr + 4H2O = 2MnO2 + 3Br2 + 8KOH
Метод ионно-электронных уравнений
Молекулярная схема реакции
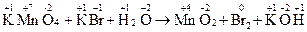
Ионная схема процесса
K+ + MnO 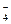 + K+ + Br – + H2O ® MnO
+ K+ + Br – + H2O ® MnO 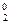 + Br
+ Br 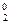
 + K+ + OH–
+ K+ + OH–
Составляем уравнения ионных полуреакций
MnO 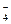 + 2Н2O0® MnO
+ 2Н2O0® MnO 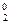 + 4OH–
+ 4OH–
2Br – ® Br 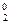
Затем уравниваем заряды
[MnO 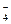 + 2Н2O0]1– + 3 ē ® [MnO
+ 2Н2O0]1– + 3 ē ® [MnO 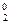 + 4OH–]4–
+ 4OH–]4–
[2Br –]2– – 2 ē ® Br 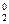
Балансируют количество принятых и отданных электронов
 [MnO
[MnO 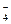 + 2Н2O0]1– + 3 ē ® [MnO
+ 2Н2O0]1– + 3 ē ® [MnO 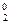 + 4OH–]4– ´ 2
+ 4OH–]4– ´ 2
[2Br –]2– – 2 ē ® Br 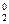 ´ 3
´ 3
Записываем суммарную реакцию ионно-электронного баланса
2MnO 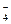 + 4Н2O0 + 6 ē + 2Br – – 6 ē ® 2MnO
+ 4Н2O0 + 6 ē + 2Br – – 6 ē ® 2MnO 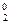 + 8OH– + 3Br
+ 8OH– + 3Br 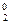
Расставляем коэффициенты в молекулярном уравнении реакции
2KMnO4 + 6KBr + 4H2O = 2MnO2 + 3Br2 + 8KOH.
Вычисляем молярные эквивалентные окислителя и восстановителя массы по формуле (1)
МЭ, окислителя = 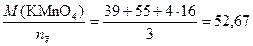 г/моль;
г/моль;
МЭ, восстановителя = 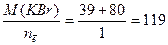 г/моль.
г/моль.
По справочнику [8] находим потенциалы полуреакций
MnO 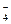 + 2Н2O0 + 3 ē ® MnO
+ 2Н2O0 + 3 ē ® MnO 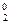 + 4OH–, E
+ 4OH–, E  = 0,60 В
= 0,60 В
Br 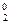 + 2ē = 2Br –, E
+ 2ē = 2Br –, E 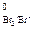 = 1,09 В
= 1,09 В
По формуле (3) вычисляем ЭДС данной ОВР
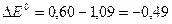 В.
В.
По формуле (2) рассчитываем DG процесса
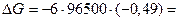 283710 Дж =283,71 кДж
283710 Дж =283,71 кДж
Так как значение DЕ0 < 0 и DG > 0, то реакция идет самопроизвольно в обратном направлении.
Пример 4. Можно ли с помощью FeCl3 окислить H2S до элементарной серы?
Р е ш е н и е
Составим ионную схему реакции
Fe3+ + H2S ® Fe2+ + S + H+
Ион Fe3+ в данном процессе выполняет роль окислителя, а молекула H2S – роль восстановителя.
Находим окислительно-восстановительные потенциалы соответ-ствующих полуреаций
E 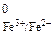 = 0,77 В; E
= 0,77 В; E 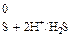 = 0,17 В.
= 0,17 В.
Потенциал окислителя больше потенциала восстановителя, следовательно, сероводород можно окислить при помощи хлорида железа (III) до элементарной серы.
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Краткие теоретические сведения
Процессы взаимного превращения химической и электрической форм энергии называются электрохимическими. Их принято делить на две основные группы: 1) процессы превращения химической энергии в электрическую (реализуются в химических источниках тока); 2) процессы превращения электрической энергии в химическую (наблюдаются при электролизе).
Простейшая электрохимическая система состоит из двух электродов (иначе полуэлементов) и ионного проводника. Полуэлемент чаще всего представляет собой металл, помещенный в раствор, содержащий ионы, способные восстанавливаться или окисляться, а ионным проводником, как правило, служит раствор или расплав электролита.
Каждый электрод, характеризуется определенным значением условного электродного потенциала Е, который в стандартных условиях определяется экспериментально относительно потенциала стандартного водородного электрода (СВЭ). СВЭ – это газовый электрод, который состоит из платины, контактирующей с газообразным водородом (Р 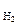 = 1 атм.) и раствором, в котором активность ионов водорода а
= 1 атм.) и раствором, в котором активность ионов водорода а 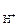 = 1 моль/дм3. Равновесие в водородном электроде отражается уравнением
= 1 моль/дм3. Равновесие в водородном электроде отражается уравнением
Н+ +  « ½ Н2
« ½ Н2
Абсолютное значение потенциала СВЭ неизвестно, но условно его считают равным нулю (Е 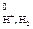 = 0 В).
= 0 В).
По свойствам веществ, участвующих в потенциалопределяющих процессах, принята следующая классификация электродов: электроды первого и второго рода, газовые, окислительно-восстановительные, ионообменные.
К электродам первого рода в первую очередь относятся металлические электроды, обратимые относительно катиона. Это полуэлемент, в котором металл Ме погружен в раствор, содержащий ионы данного металла Меn+: Меn+ ½ Ме. Потенциалопределяющая реакция электрода выражается схемой
Меn +раствор + n ∙  « Метв.
« Метв.
Потенциалы полуэлементов рассчитывают по уравнению Нернста, которое при температуре 298 К для данного вида электродов имеет вид:
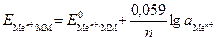 (4)
(4)
где Е 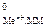 - стандартный электродный потенциал металла, В; а
- стандартный электродный потенциал металла, В; а 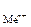 - активность ионов металла в растворе, моль/дм3.
- активность ионов металла в растворе, моль/дм3.
Значения стандартных электродных потенциалов практически для всех полуэлементов определены экспериментально и содержатся в справочной литературе. При расчетах потенциалов металлических электродов активность ионов металла можно считать приблизительно равной их молярной концентрации а 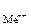 » [Меn+].
» [Меn+].
К электродам первого рода относятся также газовые, которые создаются по схеме: раствор ½газ, металл. Металл в газовых электродах необходим для создания электропроводящего контакта между газом и раствором, при этом сам металл должен оставаться инертным по отношению к веществам находящимся в растворе. Наиболее подходящим металлом, отвечающим всем условиям, является платина.
Самым распространенным газовым электродом является водородный электрод. Уравнение Нернста в этом случае имеет вид
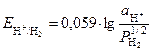 , (5)
, (5)
где а 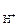 – активность ионов водорода в растворе, моль/дм3; Р
– активность ионов водорода в растворе, моль/дм3; Р 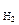 – парциальное давление водорода над раствором, атм.
– парциальное давление водорода над раствором, атм.
Если давление водорода считать равным 1 атм., то уравнение Нернста примет вид
 , (6)
, (6)
где рН – водородный показатель среды.
Кислородный электрод по устройству аналогичен водородному. В щелочной среде электродное равновесие имеет вид
О2 + 2Н2О + 4×  « 4ОН– .
« 4ОН– .
Уравнение для расчета потенциала
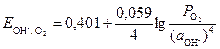 , (7)
, (7)
где а 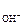 – активность гидроксид-ионов в растворе, моль/дм3; Р
– активность гидроксид-ионов в растворе, моль/дм3; Р 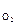 – парциальное давление кислорода над раствором, атм.
– парциальное давление кислорода над раствором, атм.
В кислой среде электродное равновесие кислородного полуэлемента и уравнение для расчета потенциала передаются выражениями
О2 + 4Н+ + 4×  « 2Н2О
« 2Н2О
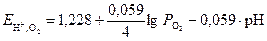 . (8)
. (8)
На практике потенциал кислородного электрода не соответствует уравнению (8), так как механизм реакций, протекающих на данном электроде сложнее из-за протекания побочных процессов.
Электродом второго рода называют систему, в которой металл покрыт слоем его труднорастворимого соединения (соли, оксида или гидроксида), а в растворе находятся анионы, одноименные с анионами, содержащимися в этом труднорастворимом соединении: Аn – ½ MeA, Ме. Электродное равновесие имеет вид
MeAтв + n×  « Метв + Аn –раствор.
« Метв + Аn –раствор.
Уравнение Нернста для этого случая передается формулой
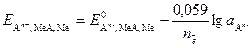 , (9)
, (9)
где 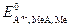 - стандартный потенциал электрода второго рода, В;
- стандартный потенциал электрода второго рода, В;  - активность анионов в растворе, моль/дм3.
- активность анионов в растворе, моль/дм3.
К окислительно-восстановительным (иначе редокси-электродам) относят электроды, в потенциалопределяющих реакциях которых не участвую простые вещества – металлы, газы. Они состоят из инертного вещества, обладающего электронной проводимостью (чаще всего платины), погруженного в раствор, содержащий частицы (ионы или молекулы) способные окисляться и восстанавливаться. В общем виде схема электрода и уравнение реакции записывают так
О x, Red ½ Pt; О x + n×  « Red.
« Red.
Редокси-электроды бывают простые и сложные. К простым редокси-электродам относят полуэлементы, у которых окисленная и восстановленная формы представляют собой ионы, причем электродная реакция состоит в перемене их заряда. Например, системе Sn4+, Sn2+ ½ Pt соответствует реакция
Sn4+ + 2×  « Sn2+ .
« Sn2+ .
Потенциал простого окислительно-восстановительного полуэлемента рассчитывают по формуле
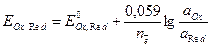 , (10)
, (10)
где 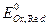 – стандартный потенциал редокси-электрода,В; а Ox, aRed – активности окисленной и восстановленной форм, моль/дм3.
– стандартный потенциал редокси-электрода,В; а Ox, aRed – активности окисленной и восстановленной форм, моль/дм3.
В основе работы сложного редокси-электрода лежит потенциалопределяющая реакция, в которой участвуют ионы Н+ и молекулы воды. Например, системе 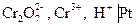 отвечает электродная реакция
отвечает электродная реакция
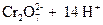 + 6×
+ 6×  «
« 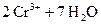 .
.
Расчет потенциала данного электрода производится по уравнению
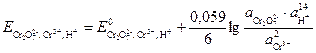 .
.
К химическим источникам тока (ХИТ) относятся гальванические элементы, аккумуляторы и топливные элементы.
Гальваническим элементом называют устройство для прямого преобразования энергии химической реакции в электрическую, в котором реагенты (окислитель и восстановитель) входят непосредственно в состав элемента и расходуются в процессе его работы. После расхода реагентов элемент не может больше работать, то есть это ХИТ одноразового действия.
Если окислитель и восстановитель хранятся вне элемента и в процессе его работы подаются к электродам, которые не расходуются, то такой элемент может работать длительное время и называется топливным элементом.
В основе работы аккумуляторов лежат обратимые ОВР. Под действие внешнего источника тока ОВР протекает в обратном направлении, при этом устройство накапливает (аккумулирует) химическую энергию. Этот процесс называется зарядом аккумулятора. Затем аккумулятор может превратить накопленную химическую энергию в электрическую (процесс разряда аккумулятора). Процессы заряда и разряда аккумулятора осуществляются многократно, то есть это ХИТ многоразового действия.
Любой гальванический элемент состоит их двух полуэлементов, соединенных между собой металлическим проводником. В этом случае электрод, имеющий меньшее значение потенциала, называется анодом и обозначается знаком «–». На аноде идет окисление частиц восстановителя. Электрод, обладающий большим потенциалом, называется катодом и обозначается знаком «+». На катоде происходит восстановление частиц окислителя. Переход электронов с восстановителя на окислитель происходит по металлическому проводнику, который называют – внешняя цепь. ОВР, лежащая в основе работы гальванического элемента, называется токообразующей реакцией.
Основной характеристикой работы элемента является его ЭДС D Е, которая вычисляется как разность между потенциалами катода и анода
DЕ = Екатод - Еанод (11)
Поскольку потенциал катода всегда больше потенциала анода, то из формулы (11) следует, что в работающем гальваническом элементе DЕ > 0.
Гальванические элементы принято записывать в виде схем, в которых одна вертикальная линия изображает границу раздела фаз (металл – раствор), а две вертикальные линии – границу между двумя растворами.
Например, Zn | Zn2+ || Cu2+ | Cu или с учетом анионов Zn | ZnSO4 || CuSO4 | Cu
Электролизом называют окислительно-восстановительный процесс, протекающий при прохождении постоянного электрического тока через раствор или расплав электролита. При электролизе происходит превращение электрической энергии в химическую, что позволяет осуществлять такие ОВР, которые не могут протекать самопроизвольно.
Ячейка, в которой осуществляют электролиз, называется электролизёр и состоит из двух электродов и электролита. Электрод, подключенный к положительному полюсу внешнего источника тока, называется анодом – на нем происходит окисление. Электрод, подключенный к отрицательному полюсу – катод, на нем идет восстановительный процесс.
Минимальное напряжение электрического тока, приложенное к электродам, при котором начинается электролиз вещества, называется потенциалом разложения U разл. Теоретически Uразл должен быть равен разности окислительно-восстановительных потенциалов процессов, протекающих на электродах
Uразл = Еанодного процесса – Екатодного процесса (12)
Однако на практике, чтобы начался электролиз, к электродам приходится прикладывать напряжение, заметно превышающее потенциал разложения вещества.
Характер протекания электродных процессов при электролизе зависит от многих факторов, важнейшими из которых являются состав электролита, материал электродов и режим электролиза (температура, напряжение, плотность тока и др.). Различают электролиз расплавов и электролиз водных растворов.
Электролиз расплавов электролитов обычно ведут с использованием инертных (неактивных, не расходуемых) электродов, то есть электродов, выполненных из материалов, которые в процессе электролиза химически не изменяются, а служат лишь для передачи электронов. Инертные электроды обычно изготовляются из графита, угля, платины. Кроме инертных анодов различают также растворимые (активные, расходуемые) аноды. Это аноды, выполненные из активных материалов (меди, цинка, никеля, железа и др. металлов). У таких анодов в процессе электролиза окисляется в первую очередь сам материал анода.
Рассмотрим процессы, протекающие при электролизе расплава хлорида магния. При плавлении MgCl2 (как и любого другого ионного соединения) происходит его термическая диссоциация по уравнению
MgCl2 ® Mg2+ + 2Cl–.
Если в такой расплав погрузить инертные электроды и пропускать электрический ток, то в электролите начнется направленное движение ионов: положительно заряженные ионы (катионы) будут двигаться к отрицательному электроду (катоду), а отрицательно заряженные ионы (анионы) направятся к аноду. Схематично эти процессы на примере MgCl2 можно представить так
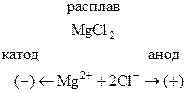
На электродах будут протекать следующие процессы:
1) восстановление катионов на катоде
Mg2+ + 2ē ® Mg
2) окисление анионов на аноде
2Cl– – 2ē ® Cl2
Суммарная реакция электролиза расплава хлорида магния
MgCl2 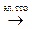 Mg + Cl2
Mg + Cl2
Электролиз водных растворов электролитов более сложен, так как кроме ионов электролита на электродах могут претерпевать изменение молекулы воды:
1. восстанавливаться на катоде по схеме
2Н2О + 2ē ® Н2 + 2ОН–;
2. окисляться на аноде по схеме
2Н2О – 4ē ® О2 + 4Н+.
Таким образом, при электролизе водных растворов электролитов на каждом из электродов принципиально возможно протекание двух или большего числа процессов. Из ряда конкурирующих процессов на электроде в первую очередь реализуется тот процесс, осуществление которого связано с меньшими затратами энергии. Это означает:
1. На катоде восстанавливаются в первую очередь окисленные формы систем с наибольшим значением окислительно-восстановительного потенциала;
2. На аноде в первую очередь окисляются восстановленные формы систем, которые имеют меньшее значение окислительно-восстановительного потенциала.
При реализации данных принципов на практике следует вычислить потенциалы всех возможных процессов и сравнить их между собой.
На катоде могут возникнуть три случая:
1. Потенциал восстановления катиона Е 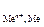 больше потенциала восстановления воды Е
больше потенциала восстановления воды Е 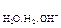 , причем абсолютная разность между потенциалами конкурирующих процессов ½DЕ½превышает 0,1 В. В этом случае, на катоде восстанавливаются катионы металла
, причем абсолютная разность между потенциалами конкурирующих процессов ½DЕ½превышает 0,1 В. В этом случае, на катоде восстанавливаются катионы металла
Mеn+ + n × ē ® Me
2. Е 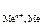 < Е
< Е 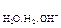 , причем
, причем 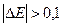 В, тогда на катоде идет процесс восстановления молекул воды.
В, тогда на катоде идет процесс восстановления молекул воды.
3. Е 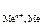 » Е
» Е 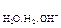 , то есть
, то есть  В, тогда на катоде идут сразу оба восстановительных процесса
В, тогда на катоде идут сразу оба восстановительных процесса
Mеn+ + 2Н2О + (2 + n)×ē ® Me + Н2 + 2ОН–
Для процессов на аноде в первую очередь следует определить тип анода. Если анод растворимый, то тогда независимо от состава электролита будет происходить окисление материала анода. Например, для железного анода
Fe – 2ē ® Fe2+
Если анод инертный, то окислению будет подвергаться одна из частиц электролита. В реальных процессах порядок разряда частиц на инертном электроде зависит не только от окислительно-восстановительного потенциала системы, но и от перенапряжения. Анодное перенапряжение при окислении молекул воды (кислородное перенапряжение), то есть сдвиг потенциала окисления Н2О в положительную сторону, связано с кинетическими затруднениями при образовании молекулы О2. В результате теоретически выделение кислорода должно начинаться при потенциале +0,815 В, а практически это происходит только при напряжении более +1,5 В.
При реализации процессов окисления на инертном аноде выполняются следующие правила:
1. В первую очередь на инертных анодах в разбавленных водных растворах окисляются простые анионы в порядке возрастания их стандартных потенциалов, не превышающих +1,5 В, то есть S2-, I–, Br–, Cl–. Вода при этом не окисляется.
2. При электролизе водных растворов, содержащих анионы кислородсодержащих кислот (СО 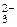 , NO
, NO 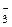 , SO
, SO 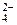 и др.), данные анионы не окисляются, вместо них на аноде окисляются молекулы воды по схеме
и др.), данные анионы не окисляются, вместо них на аноде окисляются молекулы воды по схеме
2Н2О – 4×ē ® О2 + 4Н+,
а в щелочных растворах ионы ОН– по схеме
4 ОН– – 4ē ® О2 + 2Н2О.
Зависимость между количеством электричества и массой вещества, испытавшего превращение на электроде, устанавливается законами Фарадея:
Первый закон Фарадея: масса вещества, испытавшего электрохимические превращения на электроде, прямо пропорциональна количеству прошедшего электричества
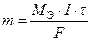 , (13)
, (13)
где m – масса вещества, г; MЭ – молярная эквивалентная масса вещества, г/моль; I – сила тока, А; t - время, с.
Если на электроде испытывает превращение газообразное вещество, то удобнее определять его объем V (дм3), а не массу, тогда первый закон Фарадея можно представить формулой
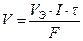 , (14)
, (14)
где VЭ – молярный эквивалентный объем выделяющегося или поглощающегося газа, моль/дм3.
Второй закон Фарадея: массы (объемы) веществ, прореагировавших на электродах, при постоянном количестве электричества относятся друг к другу как молярные массы (объемы) их эквивалентов
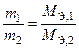 или
или 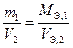 (15)
(15)
Для оценки эффективности работы электролизера пользуются понятием выход продукта по току h. Иначе, это коэффициент полезного действия электролизера
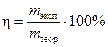 , (16)
, (16)
где mэксп - масса вещества, испытавшего превращение на электроде, при прохождении определенного количества электричества, найденная экспериментально, г; mтеор - масса вещества, вычисленная по закону Фарадея, при том же количестве электричества, г.
Примеры решения задач
Пример 1. Определите потенциал никелевого электрода, если концентрация ионов Ni2+ в растворе составляет 0,02 н.
Р е ш е н и е
Определим молярную концентрацию ионов никеля в растворе
[Ni2+] = 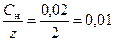 моль/дм3
моль/дм3
где z = 2 – число эквивалентности ионов Ni2+.
По справочнику [8] выбираем Е 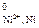 = –0,250 В. По формуле (4) вычисляем потенциал никелевого электрода
= –0,250 В. По формуле (4) вычисляем потенциал никелевого электрода
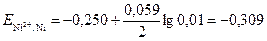 В.
В.
Пример 2. Определите концентрацию ионов ОН– в растворе, если потенциал водородного электрода, помещенного в данный раствор равен ‑0,786 В.
Р е ш е н и е
Из формулы (6) определим рН раствора
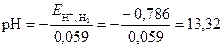
Тогда гидроксильный показатель воды
рОН = 14 – рН = 14 – 13,32 = 0,68
Отсюда концентрация ионов ОН–
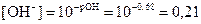 моль/дм3.
моль/дм3.
Пример 3. Определите рН водного раствора соли с 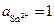 моль/л, при котором будет растворяться олово.
моль/л, при котором будет растворяться олово.
Р е ш е н и е 


Растворение олова описывается уравнением
Sn − 2ē → Sn2+.
Это анодный процесс и олово выступает как восстановитель. Катодным будет являться процесс, описываемый реакцией
2Н+ + 2 ē → Н2.
Стандартный потенциал оловянного полуэлемента берем в справочнике [8]: Е  = –0,141 В, а потенциал катодной реакции следует оценить по формуле (6).
= –0,141 В, а потенциал катодной реакции следует оценить по формуле (6).
Для реализации любого окислительно-восстановительного процесса необходимо, чтобы потенциал окислителя был больше потенциала восстановителя, то есть 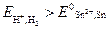 . Или
. Или
−0,059·рН > −0,141B.
Решая это неравенство относительно рН, получим рН < 2,39.
Пример 4.Рассчитайте потенциал свинцового электрода, помещенного в насыщенный раствор йодида свинца ( 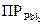 = 8,7·10-9,
= 8,7·10-9, 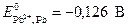 ).
).
Р е ш е н и е 


Йодид свинца (II) – труднорастворимое соединение, сильный электролит. Равновесие между твердой фазой и ионами, перешедшими в раствор, передается схемой
PbI2 ↔ Pb2+ + 2 I–.
Тогда выражение для произведения растворимости имеет вид
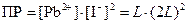 ,
,
так как [Pb2+] = L, а [I−] = 2 L, где L – растворимость соли, моль/дм3.
Из данного выражения следует, что
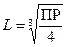 .
.
Подставив это выражение в уравнение Нернста для свинцового электрода, получаем
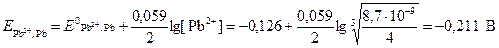 .
.
Пример 5. Составьте схему, напишите уравнения электродных процессов и вычислите ЭДС и DG для гальванического элемента, составленного из свинцового и медного электродов, погруженных в растворы их солей с концентрациями ионов Pb2+ и Cu2+ равными 0,1 М и 0,05 М соответственно.
Р е ш е н и е
По справочнику выбираем стандартные потенциалы для данных металлов и по формуле (4) вычисляем их потенциалы в указанных растворах
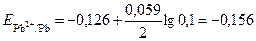 В.
В.
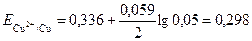 В.
В.
Потенциал медного электрода больше потенциала свинцового электрода, значит Pb – анод, а Cu – катод. Следовательно, в элементе протекают процессы
На аноде: Pb – 2  ® Pb2+
® Pb2+
На катоде: Cu2+ + 2  ® Cu
® Cu
Токообразующая реакция: Pb + Cu2+ = Pb2+ + Cu.
Схема элемента: (-) Pb½Pb2+½½Cu2+½Cu (+)
По формуле (11) определяем ЭДС данного гальванического элемента
DЕ = 0,298 – (–0,156) = 0,454 В.
По уравнению (2) вычислим DG данного процесса
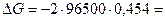 –87622 Дж = –87,6 кДж.
–87622 Дж = –87,6 кДж.
Пример 6.При температуре 298 К определите ЭДС гальванического элемента, один из электродов которого кислородный со стандартным давлением кислорода и рН раствора равным 4, а второй – алюминиевый массой 4,5 г с активностью ионов алюминия 1×10–3 моль/дм3. Приведите уравнения электродных процессов и токообразующей реакции, а также рассчитайте при н.у. объём поглощенного кислорода, если алюминиевый электрод растворится полностью. Коэффициент выхода по току примите равными единице. 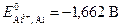 ;
; 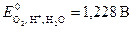 .
.
Р е ш е н и е 


По значениям стандартных электродных потенциалов определяем, что алюминиевый электрод является анодом, на котором идет процесс окисления
(−) А: Al − 3ē → Al3+,
а кислородный электрод – катодом, на котором идет реакция восстановления
(+) К: О2 + 4Н+ + 4ē → 2Н2О.
Уравнение токообразующего процесса с учётом равенства числа отданных и принятых электронов
4Al + О2 + 12Н+ → 6Н2О + 4Al3+.
Потенциалы электродов рассчитаем по формулам (4) и (8)
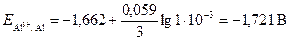 ;
;
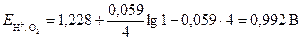 .
.
ЭДС гальванического элемента определяем по соотношению (11)
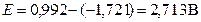 .
.
Для определения объема поглощенного кислорода воспользуемся вторым законом Фарадея [формула (15)]
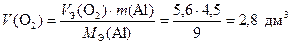 .
.
Пример 7.Вычислите стандартную ЭДС и теоретическое время работы серебряно-цинкового элемента, в котором протекает токообразующая реакция Ag2O + Zn → ZnO + 2Ag, если при постоянном токе 0,2 А израсходовано 13,8 г цинка. 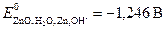 ;
; 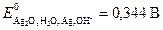 .
.
Р е ш е н и е 


Электродные процессы могут быть представлены уравнениями
(−) А: Zn + 2OH− − 2ē → ZnO + H2O
(+) К: Ag2O + H2O +2ē → 2Ag + 2OH−
Стандартную ЭДС рассчитываем по разности стандартных потенциалов между катодом и анодом
Е0 = 0,344 – (−1,246) = 1,590 В.
Используя уравнение (13), находим время работы элемента до полного расходования цинка
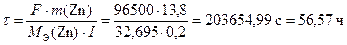 .
.
Пример 8. Запишите реакции, протекающие на графитовых электродах при электролизе водного раствора бромида никеля, если концентрация соли в растворе равна 0,1 моль/дм3, а рН раствора равен 8.
Р е ш е н и е
Бромид никеля NiBr2 - сильный электролит, то есть в растворе распадается на ионы по схеме
NiBr2 ® Ni2+ + 2Br–
У катода будут находиться частицы Ni2+ и Н2О, которые могут восстановиться следующим образом
а) Ni2+ + 2 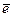 ® Ni б) 2Н2О + 2ē ® Н2 + 2ОН–
® Ni б) 2Н2О + 2ē ® Н2 + 2ОН–
Определим потенциалы конкурирующих процессов по уравнению Нернста (формулы 4 и 6 соответственно)
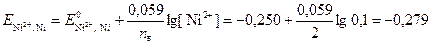 В;
В;
Е 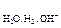 = – 0,059×рН = – 0,059×8 = – 0,472 В.
= – 0,059×рН = – 0,059×8 = – 0,472 В.
Окислительно-восстановительный потенциал никеля больше потенциала восстановления воды более чем на 0,1 В, значит на катоде происходит восстановление только ионов Ni2+.
На инертном аноде будут окисляться ионы брома, так у молекул воды окислительно-восстановительный потенциал с учетом кислородного перенапряжения выше, чем потенциал выделения брома. Таким образом, при электролизе раствора NiBr2 на графитовых электродах реализуются процессы
На катоде: Ni2+ + 2  ® Ni;
® Ni;
На аноде: 2Br– – 2  ® Br2;
® Br2;
Суммарная реакция: NiBr2 ® Ni + Br2.
Пример 9.Какие вещества и в каких количествах выделяться на железных электродах при электролизе водного раствора NaOH в течение 2 часов при силе тока 1,5 А, если выход по току принять равным 100 %?
Р е ш е н и е
У катода будет происходить восстановление молекул воды, так как потенциал восстановления ионов Na+ гораздо более отрицательнее, чем у Н2О. На железном (активном) аноде будет происходить окисление материала анода. Таким образом:
На катоде: 2Н2О + 2ē ® Н2 + 2ОН– ;
На аноде: Fe – 2 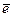 ® Fe2+ ;
® Fe2+ ;
Суммарная реакция: Fe + 2H2O ® H2 + Fe(OH)2.
По формуле (13) определим массу гидрооксида железа (II)
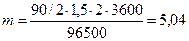 г.
г.
По формуле (14) определяем объем водорода при нормальных условиях
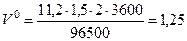 дм3.
дм3.
Пример 10. Постоянный ток проходит через три последовательно соединенных электролизёра, в каждом из которых находятся водные растворы следующих электролитов: в первом – сульфата никеля, втором – сульфата железа (III), в третьем – хлорида железа (II). Определите массы выделившихся на катодах металлов, если на аноде последнего электролизёра выделилось 1,12 л хлора, измеренных при н.у.
Р е ш е н и е 


Для определения масс металлов, выделившихся на электродах, воспользуемся вторым законом Фарадея [формула (15)], зная, что эквивалентный объем хлора при н.у. равен 11,2 л/моль. Тогда в первом электролизере
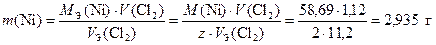 ,
,
где число эквивалентности z = 2, так как на восстановление каждого иона Ni2+ требуется два электрона.
Во втором электролизере на катоде идет процесс Fe3+ + 3e ® Fe, поэтому число эквивалентности z = 3, а масса железа, выделившегося на электроде
 .
.
В третьем электролизере реализуется процесс Fe2+ + 2e ® Fe, значит
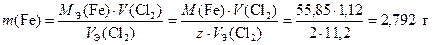 .
.
Пример 11. При электролизе водного раствора нитрата висмута на катоде в течении 1,5 ч выделилось 18 г висмута. Выход по току составил 97%. При какой силе тока осуществлялся процесс?
Р е ш е н и е 


Нитрат висмута Bi(NO3)2 – сильный электролит, в водном растворе распадается на ионы по схеме
Bi(NO3)3 ® Bi3+ + 3NO 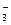 .
.
У катода будут находиться частицы Bi3+ и Н2О, которые могут восстановиться следующим образом
а) Bi3+ + 3 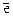 ® Bi,
® Bi,  = 1,215B;
= 1,215B;
б) 2Н2О + 2ē ® Н2 + 2ОН–, 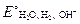 = –0,413В (при рН=7).
= –0,413В (при рН=7).
Окислительно-восстановительный потенциал висмута больше потенциала восстановления воды более чем на 0,1 В, значит на катоде происходит восстановление только ионов Вi3+.
На инертном аноде будут окисляться молекулы воды, так как окислительно-восстановительный потенциал нитрат ионов с учетом кислородного перенапряжения выше, чем потенциал окисления молекул воды. Таким образом, при электролизе раствора Bi(NO3)3 на графитовых электродах реализуются процессы
На катоде: Вi3+ + 3  ® Вi
® Вi
На аноде: 2Н2О – 4ē ® О2 + 4Н+
Суммарная реакция: 4Вi2+ + 6Н2О ® 4Вi + 3О2 + 12Н+
4Bi(NO3)3 + 6Н2О ® 4Вi + 3О2 + 12НNO3.
По формуле (16) определим теоретическую массу выделившегося висмута
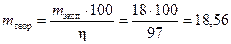 г.
г.
По уравнению (13) определим силу тока
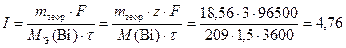 А.
А.
КОРРОЗИЯ МЕТАЛЛОВ
Дата добавления: 2018-11-24; просмотров: 201; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
