Решение (один из возможных вариантов)
Отборочный этап
Класс
Задача 1. (15 баллов)
В ампулу объемом 50 мл поместили 10 г карбоната магния (насыпная плотность 1,50 г/мл). Ампулу вакуумировали, запаяли и выдержали в трубчатой печи при температуре 300 оС в течение 2 дней. При этом в ампуле установилось давление в 1 атм. В параллельном опыте вместо 10 г взяли 15 г карбоната магния. Каким будет давление в этом случае?
Решение
При нагревании карбонат магния разлагается по обратимой реакции
MgCO3 = MgO + CO2
Найдем количество карбоната магния: n=0,12 моль и максимальное количество углекислого газа, который может быть в этой ампуле при данных условиях: n=PV/RT=0,01 моль.
Из найденных количеств видно, что карбонат магния остался в избытке, следовательно, при данной температуре установилось химическое равновесие. Так как карбонат магния и оксид магния твердые, то константа данного равновесия зависит только от давления углекислого газа:
K = p(CO2)
Увеличение количества карбоната магния не приведет к изменению константы равновесия, которая зависит только от температуры, следовательно, и давление в системе изменится.
Ответ: 1 атм.
Задача 2. (10 баллов)
Одним из методов анализа структуры соединений с двойной связью углерод-углерод является процесс озонолиза. При окислении таких соединений образуются альдегиды или кетоны, в зависимости от строения углеродного скелета и положении двойной связи.
|
|
|
В результате озонолиза некоторого углеводорода Х образовался только альдегид янтарной кислоты. Назовите углеводорода Х по систематической номенклатуре IUPAC и напишите уравнение окисления этого соединения подкисленным раствором перманганата калия (в уравнении реакции можете использовать молекулярную формулу исходного углеводорода Х). Есть ли цис-/ транс-изомерия у углеводорода Х?
Решение
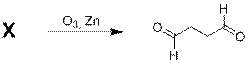
Альдегид янтарной кислоты имеет формулу СНО-СН2-CH2-СНО. Поскольку в реакции озонолиза он является единственным продуктом и содержит две карбонильных группы, то исходное вещество должно иметь циклическую структуру. Длинна углеродной цепи в янтарном альдегиде составляет 4 углеродных атома, поэтому возможно несколько структур для углеводорода Х – циклобутен и циклоокта-1,5-диен (циклооктадиен-1,5).

В случае циклобутена цис-/ транс-изомерия невозможна из-за геометрических ограничений, а у циклоокта-1,5-диена подобного ограничения нет.
Задача 3 (15 баллов)
Смесь 100 мл паров некоторого соединения, содержащего углерод, водород и еще какой-то элемент (плотность паров по углекислому газу примерно 4,85 сожгли с 2.00 л кислорода. При этом образовалось белое твердое вещество и 2.30 л смеси газов с плотностью по углекислому газу около 0,70. После конденсации паров воды объем смеси уменьшился до 1,55 л, а после пропускания оставшихся веществ через избыток известковой воды объем непоглощенного газа составил 0,85 л. Определите состав исходного соединения, приведите не менее пяти возможных структурных формул. Все объемы измерены при одинаковых условиях.
|
|
|
Решение .
Очевидно, что при пропускании через известковую воду поглотился углекислый газ. Непоглощенным газом в данных условиях может быть либо кислород, либо угарный газ. Если бы это был угарный газ, то плотность газовой смеси после сгорания исходного вещества составляла бы (0,75*18 + 0,7*44+0,85*28)/(2,3*44) = 0,672. Если оставшийся газ – кислород, то плотность газовой смеси составила бы 0,703. Следовательно, оставшийся газ – кислород.
Согласно закону Авогадро соотношения объемов равны соотношению количеств газов (в молях). Следовательно, формула исходного вещества – ЭхС7Н15.
Определим металл. В реакцию вступило 2 – 0,85 = 1,15 л кислорода. Из них на образование твердого белого вещества (оксида) израсходовалось 0,075 л кислорода. Формула образовавшегося оксида – Э2О3 (ЭО1,5), а формула исходного вещества – ЭС7Н15. Поскольку плотность паров соединения по углекислому газу составляет 4,85, его молярная масса около 213,4 г/моль, следовательно, в состав соединения входит элемент с молярной массой около 114,4 г/моль, трехвалентный элемент с молярной массой, близкой к этому значению, – индий. Формула соединения – InC7H15. Изомерия связана с изомерией углеводородных заместителей.
|
|
|
Задача 4. (10 баллов)
При прокаливании без доступа воздуха некоторого количества кристаллогидрата соли, в котором массовая доля кристаллизационной воды составляла 6,5%, образовалось 0,669 г оксида двухвалентного металла, 0,072 г воды и 44,8 мл (н.у.) газообразного оксида некоторого четырехвалентного элемента (плотность этого оксида по азоту равна 1,57). Определите формулу исходного кристаллогидрата, если известно, что массовая доля кислорода в нем равна 21,23%.
Решение.
Определим неизвестный оксид. Его молярная масса составляет:
М = 32*1,57 = 44 г/моль – искомый оксид – углекислый газ
X·nH2O → MeO + H2O + CO2
0,669 г - 0,072 г – 0,088 г
Тогда на 0,004 моль воды приходится 0,002 моль углекислого газа
Общая масса кристаллогидрата составляла 0,669 + 0,072 + 0,088 = 0,829 г
Масса кислорода в нем – 0,829*60% = 0,176 г
Образовавшаяся вода содержит 0,004*16 = 0,064 г кислорода, углекислый газ – 0,002*32 = 0,064 г кислорода. Тогда масса кислорода в оксиде металла – 0,048 г.
|
|
|
Получаем:
0,048 г кислорода соединяется с 0,669 – 0,048 = 0,621 г металла
16 г кислорода – с х г металла
Х = 207 г. Искомый металл – свинец
Определяем формулу соли.
Соль: PbXCYHZOP X : Y : Z : P = 0,003 :0,002 : 0:008 : 0,011 = 3:2:8:11
Искомая соль – Pb3(OH)2(CO3)2· 3H2O
Задача 5. (10 баллов)
Через водный раствор, содержащий 200 г 30% раствора бромида калия, пропустили 30.0 л хлора (н.у.), после чего раствор нагрели до полного испарения жидкости. В каких пределах может находиться масса полученного твердого остатка?
Решение
При пропускании хлора через раствор иодида калия могут протекать следующие реакции:
2KBr + Cl2 = 2KCl + Br2
KBr + 3Cl2 + 3H2O = KСl + HBrO3 + 5HCl
(растворимость хлорида калия не велика – он будет выпадать в осадок при концентрировании раствора)
Таким образом, минимальная масса твердого остатка будет наблюдаться в случае полного превращения бромида калия в хлорид, а максимальная – при его превращении в хлорид калия и бромноватую кислоту.
Количество бромида калия составляло 0,504 моль, количество хлора – 1,34 моль. Таким образом, хлор был взят в избытке в первой реакции и в недостатке во второй. По первой реакции получается 0,504 моль хлорида калия (37.55 г), по второй – 0,45 моль хлорида калия (33,53 г) и 0,054 моль бромида калия останется в избытке (6,43 г). Таким образом, масса твердого остатка должна составлять от 37,55 г до 39,96г.
Задача 6. (15 баллов)
В пяти пронумерованных пробирках находятся: следующие индивидуальные сухие вещества хромат калия, иодид серебра, иодид свинца, хлорид железа(III) и сульфид кадмия. Все вещества окрашены в желтый цвет. Как, используя дополнительно не более одного реактива, определить содержимое пробирок? Приведите уравнения соответствующих реакций.
Решение (один из возможных вариантов)
Добавим к веществам разбавленную серную кислоту и нагреем пробирки:
Иодид серебра – не растворится
Хромат калия – поменяет окраску на оранжевую:
2K2CrO4 + H2SO4 = K2Cr2O7 + K2SO4 + H2O
Хлорид железа – останется без изменений
Сульфид кадмия – выделится сероводород:
CdS + H2SO4 = CdSO4 + H2S
Иодид свинца – при нагревании растворится, но затем вновь выпадут золотистые кристаллы
Задача 7. (10 баллов)
1. Имеется набор реакций, схематически представленный, следующими уравнениями реакций:
4АБ2+11В2 = 2А2В3+8БВ2
2БВ2+В2=2БВ3
БВ3+Г2В=Г2БВ4
Определите элементы А, Б, В и Г, запишите уравнения реакций.
Составьте уравнение реакции конечного продукта с алюминием при повышенной температуре.
Решение
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
2SO2 + O2 = 2SO3
SO3 + H2O = H2SO4
2Al + 6H2SO4 = Al2(SO4)3 + 3SO2 + 6H2O
Задача 8. (15 баллов)
1.
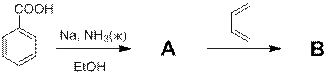
Какое из нижеперечисленных утверждений верно (несколько ответов):
1) Вещества А и В содержат ароматическое кольцо.
2) Вещество В относится к классу спиртов.
3) Вещество А содержит 3 двойных связи.
4) Вещество В содержит 3 двойных связи.
5) Вещество А содержит 4 атома углерода в sp2 гибридном состоянии.
6) Вещество А не обесцвечивает бромную воду.
7) Вещество B не обесцвечивает бромную воду.
2.
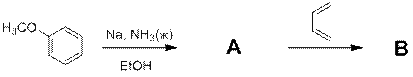
Какое из нижеперечисленных утверждений верно (несколько ответов):
1) Вещества А и В содержат ароматическое кольцо.
2) Вещество В относится к классу спиртов.
3) Вещество А содержит 2 двойных связи.
4) Вещество В содержит 2 двойных связи.
5) Вещество А содержит 2 атома углерода в sp2 гибридном состоянии.
6) Вещество А не обесцвечивает бромную воду.
7) Вещество B не обесцвечивает бромную воду.
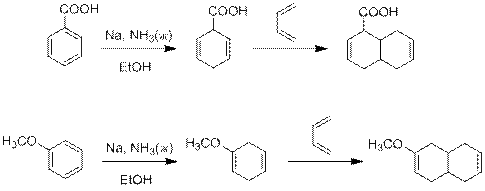
Решение
Дата добавления: 2018-11-24; просмотров: 552; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
