Описание установки и методика измерений.
Лабораторная работа № 6
«Определение коэффициента внутреннего трения жидкости по методу Стокса»
Цель работы: Определить коэффициент внутреннего трения (вязкость) жидкости по методу Стокса.
Приборы и принадлежности:
1. Стеклянный цилиндр с исследуемой жидкостью.
2. Масштабная линейка.
3. Секундомер.
4. Металлические шарики.
5. Микрометр.
Краткая теория.
Вязкость, или внутреннее трение – это явление возникновения силы трения между слоями жидкости или газа, перемещающимися параллельно друг другу с разными по величине скоростями.
Чтобы понять происхождение силы внутреннего трения, рассмотрим два соприкасающихся слоя жидкости (газа) А и В некоторой малой толщины dz каждый (рис.1). Слои движутся в одну сторону с различными по величине скоростями  и
и  (пусть
(пусть  >
>  ). Каждая молекула жидкости участвует в двух движениях: хаотическом, средняя скорость которого
). Каждая молекула жидкости участвует в двух движениях: хаотическом, средняя скорость которого  , и направленном движении со скоростью
, и направленном движении со скоростью  , которая по величине намного меньше, чем
, которая по величине намного меньше, чем  . За счет хаотического движения молекулы из слоя в слой переносят разные импульсы:
. За счет хаотического движения молекулы из слоя в слой переносят разные импульсы:  из слоя А в слой В,
из слоя А в слой В,  из слоя В в слой А. Если
из слоя В в слой А. Если  >
>  , то слой А замедляется, а слой В ускоряется, и через некоторое время направленные скорости слоев выравниваются. Таким образом явление вязкости относится к явлениям переноса и также, как и диффузия и теплопроводность, обусловлено молекулярным механизмом – хаотическим движением и перемешиванием молекул. В явлении вязкости между слоями жидкости возникают силы внутреннего трения, направленные по касательной к поверхности слоев. Направление, в котором отсчитывается расстояние между слоями
, то слой А замедляется, а слой В ускоряется, и через некоторое время направленные скорости слоев выравниваются. Таким образом явление вязкости относится к явлениям переноса и также, как и диффузия и теплопроводность, обусловлено молекулярным механизмом – хаотическим движением и перемешиванием молекул. В явлении вязкости между слоями жидкости возникают силы внутреннего трения, направленные по касательной к поверхности слоев. Направление, в котором отсчитывается расстояние между слоями 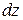 (ось
(ось  ), перпендикулярно скорости движения слоев. В этом же направлении изменяется и величина скорости
), перпендикулярно скорости движения слоев. В этом же направлении изменяется и величина скорости  направленного движения слоев. Изменение величины этой скорости на единице расстояния называется градиентом величины скорости:
направленного движения слоев. Изменение величины этой скорости на единице расстояния называется градиентом величины скорости:  .
.
|
|
|

Импульс  , переданный одному слою другим, тем больший, чем больше выбрана площадь
, переданный одному слою другим, тем больший, чем больше выбрана площадь  переноса импульса соприкасающихся слоев, время
переноса импульса соприкасающихся слоев, время  переноса импульса и изменение величины скорости
переноса импульса и изменение величины скорости  между слоями, то есть, чем больше
между слоями, то есть, чем больше  :
:
 . (1)
. (1)
Коэффициент пропорциональности  называют коэффициентом внутреннего трения или коэффициентом вязкости, или просто динамическая вязкость жидкости (газа). Знак «минус» указывает, что импульс переносится в направлении слоя с меньшей скоростью.
называют коэффициентом внутреннего трения или коэффициентом вязкости, или просто динамическая вязкость жидкости (газа). Знак «минус» указывает, что импульс переносится в направлении слоя с меньшей скоростью.
Выражение (1) перепишем как
 ,
, 

 (2)
(2)
которое называется эмпирическим уравнением вязкости или уравнением Ньютона.
|
|
|
Величина  называется плотностью потока импульса и показывает величину импульса переносимого из одного слоя в другой за единицу времени через единичную площадку перпендикулярно этой площадке.
называется плотностью потока импульса и показывает величину импульса переносимого из одного слоя в другой за единицу времени через единичную площадку перпендикулярно этой площадке.
Согласно второму закону Ньютона  , в данном случае
, в данном случае 
 - сила трения между слоями жидкости (газа). Тогда уравнение (2) перепишется
- сила трения между слоями жидкости (газа). Тогда уравнение (2) перепишется
 . (3)
. (3)
Коэффициент вязкости
 . (4)
. (4)
Из последнего выражения (4) следует физический смысл коэффициента вязкости  : коэффициент вязкости численно равен силе трения, возникающей между двумя слоями жидкости (газа) вдоль поверхности их соприкосновения на единицу площади (
: коэффициент вязкости численно равен силе трения, возникающей между двумя слоями жидкости (газа) вдоль поверхности их соприкосновения на единицу площади (  ) при градиенте величины скорости направленного движения слоев равном единице (
) при градиенте величины скорости направленного движения слоев равном единице (  ).
).
В формулах (3) и (4) знак «минус» перед правой частью нельзя писать, так как сила трения  представляет одинаковый модуль двух противоположно направленных сил, с которыми слои действуют друг на друга согласно третьему закону Ньютона.
представляет одинаковый модуль двух противоположно направленных сил, с которыми слои действуют друг на друга согласно третьему закону Ньютона.
Исходя из молекулярно–кинетической теории газов коэффициент вязкости
|
|
|
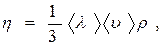
 (5)
(5)
где  - средняя длина свободного пробега молекул,
- средняя длина свободного пробега молекул,  - средняя скорость теплового (хаотического) движения молекул,
- средняя скорость теплового (хаотического) движения молекул,  - плотность газа.
- плотность газа.
Из формул (4) и (5) определяется единица измерения в СИ коэффициента вязкости:
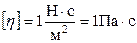 (паскаль-секунда).
(паскаль-секунда).
Описание установки и методика измерения.
Лабораторная установка состоит из стеклянного цилиндра, наполненного исследуемой жидкостью. Метод Стокса по определению коэффициента вязкости жидкости состоит в измерении скорости падения шарика в жидкости. Путь, проходимый шариком, измеряют миллиметровой линейкой, наклеенной на цилиндр, а время падения – секундомером.
При падении шарика в жидкости к нему прилипает слой жидкости, движущийся вместе с ним. Следующие слои движутся с меньшей скоростью, и эта скорость по модулю будет тем меньше, чем дальше находится слой от движущегося шарика. Между этими слоями вдоль их поверхности и возникает сила трения. Стокс определил силу трения, действующую на шары, при сравнительно небольших скоростях его движения:
 , (6)
, (6)
|
|
|
где  - скорость движения шарика,
- скорость движения шарика,  - радиус шарика,
- радиус шарика,  - коэффициент вязкости жидкости.
- коэффициент вязкости жидкости.
 Рассмотрим силы, действующие на шарик, падающий вертикально в жидкости (рис.2)
Рассмотрим силы, действующие на шарик, падающий вертикально в жидкости (рис.2)
1. Сила тяжести  , направленная вертикально вниз; масса шарика
, направленная вертикально вниз; масса шарика  (
(  - плотность вещества шарика,
- плотность вещества шарика,  - радиус шарика);
- радиус шарика); 
2. Выталкивающая сила (сила Архимеда), направленная вертикально вверх.
 ,
,  , где
, где 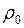 - плотность жидкости.
- плотность жидкости.
3. Сила трения  , направленная в сторону, противоположную направлению движения, то есть вертикально вверх.
, направленная в сторону, противоположную направлению движения, то есть вертикально вверх.
Сила тяжести  и сила Архимеда
и сила Архимеда  не зависят от скорости движения шарика, а сила трения
не зависят от скорости движения шарика, а сила трения  возрастает с увеличением скорости. В начале, когда
возрастает с увеличением скорости. В начале, когда  >
>  , шарик движется с ускорением, увеличивая скорость, а, следовательно, и увеличивается
, шарик движется с ускорением, увеличивая скорость, а, следовательно, и увеличивается  . По достижении некоторой определенной скорости, сила трения и выталкивающая сила в сумме уравновешивают силу тяжести и с этого момента шарик начнет двигаться равномерно, то есть с постоянной скоростью
. По достижении некоторой определенной скорости, сила трения и выталкивающая сила в сумме уравновешивают силу тяжести и с этого момента шарик начнет двигаться равномерно, то есть с постоянной скоростью 
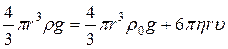 ,
,
откуда  .
.
Подставляя скорость равномерного движения  , получим формулу:
, получим формулу:
 , (7)
, (7)
где  - путь,
- путь,  - время равномерного движения шарика в жидкости.
- время равномерного движения шарика в жидкости.
Выполнение работы.
1. Измерить микрометром диаметр шарика. Измерения для каждого шарика проделать несколько раз (не менее трех) в разных положениях. Найти среднее значение радиуса  шарика.
шарика.
2. Опустить шарик в цилиндр с исследуемой жидкостью так, чтобы он падал посередине сосуда. С помощью секундомера измерить время  падения шарика, начиная с расстояния 3 – 5 см от поверхности жидкости и до дна сосуда. Сначала падение шарика в жидкости ускоренное, а, начиная с глубины 3 – 5 см, становится равномерным. Время
падения шарика, начиная с расстояния 3 – 5 см от поверхности жидкости и до дна сосуда. Сначала падение шарика в жидкости ускоренное, а, начиная с глубины 3 – 5 см, становится равномерным. Время  записать в таблицу.
записать в таблицу.
3. Измерить путь  , пройденный шариком при равномерном движении в жидкости.
, пройденный шариком при равномерном движении в жидкости.
4. Аналогичные измерения проделать с другими шариками.
5. По формуле (7) вычислить коэффициенты вязкости  для каждого опыта. Определить среднее значение
для каждого опыта. Определить среднее значение  .
.
6. Найти для каждого опыта по среднему значению абсолютную погрешность  , а затем среднее значение
, а затем среднее значение  .
.
7. Результаты измерений и вычислений занести в таблицу.
8.Записать выводы и результат в виде:  .
.
Таблица измерений и вычислений
|
| ||||||||
| № п/п | 
| 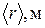
| 
| 
| 
| 
| 
| 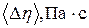
|
| 1 |
|
|
| |||||
| 2 | ||||||||
| 3 | ||||||||
Контрольные вопросы
1. Какие явления относятся к явлениям переноса? Почему они объединены одним названием?
2. Что называется вязкостью?
3. Как возникают силы внутреннего трения и как они направлены?
4. Каков физический смысл коэффициента вязкости и единица его измерения в СИ?
5. Записать коэффициент вязкости через микроскопические характеристики и по этой формуле проверить его единицу измерения в СИ.
6. В чем состоит метод Стокса по определению вязкости жидкости?
7. Во сколько раз будут отличаться скорости равномерного падения двух шариков из одного материала, у которых радиусы отличаются вдвое (  )?
)?
Лабораторная работа №7
«Определение коэффициента Пуассона»
Цель работы: экспериментально определить коэффициент Пуассона для воздуха и сравнить полученное значение с теоретическим.
Приборы и принадлежности:
1. Закрытый баллон с краном.
2. Водяной манометр.
3. Ручной насос.
Краткая теория
Системой тел или просто системой называется совокупность рассматриваемых тел или частиц. Некоторое количество газа состоящего из определенного числа молекул (частиц) представляет собой термодинамическую систему.
Всякая система может находиться в различных состояниях, характеризующихся определенными параметрами. Основными параметрами, однозначно определяющими состояние газа, являются: объем  , давление
, давление  , температура
, температура  . Эти величины связаны между собой уравнением состояния, которым для идеального газа является уравнение Менделеева - Клапейрона:
. Эти величины связаны между собой уравнением состояния, которым для идеального газа является уравнение Менделеева - Клапейрона:
 ,
,
где R = 8,31  - универсальная газовая постоянная,
- универсальная газовая постоянная, 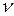 - число молей газа, которое в данном случае параметром не является, так как определенно задано.
- число молей газа, которое в данном случае параметром не является, так как определенно задано.
Равновесным называется такое состояние системы, при котором:
a) параметры во всех точках системы с течением времени не меняются;
b) нет внешних воздействий, которые поддерживали бы эти параметры неизменными.
Если хотя бы одно из этих условий не выполняется, то состояние системы является неравновесным.
Графически равновесное состояние системы можно изобразить точкой, отложив по осям координат значения двух параметров (третий параметр однозначно определяется из уравнения состояния).
Термодинамическим процессом называется изменение состояния рассматриваемой системы, например, данного количества газа 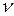 , характеризующееся изменением ее параметров. Процесс, состоящий из совокупности последовательных равновесных состояний, называется равновесным.
, характеризующееся изменением ее параметров. Процесс, состоящий из совокупности последовательных равновесных состояний, называется равновесным.
Известны следующие равновесные процессы:
1. Изохорический процесс (  ).Уравнение
).Уравнение  = const.
= const.
2. Изобарический процесс (  ).Уравнение
).Уравнение  = const.
= const.
3. Изотермический процесс (  ).Уравнение
).Уравнение 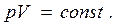
4. Адиабатический процесс – процесс, протекающий без теплообмена с внешней средой, (при этом процессе энтропия  , изоэнтропийный процесс). Уравнение
, изоэнтропийный процесс). Уравнение  Пуассона pV
Пуассона pV  = const.
= const.
Эти процессы можно графически изобразить на диаграммах непрерывными линиями, которые соответственно называют изохорой, изобарой, изотермой, адиабатой. Равновесные процессы являются обратимыми, так как их можно провести в обратном направлении через те же промежуточные состояния системы, что и при прямом ходе.
Одним из фундаментальных законов термодинамики есть закон сохранения энергии с учетом механической и тепловой энергии. Такая общая формулировка закона сохранения энергии называется первым законом (началом) термодинамики:
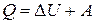
Количество тепла  , сообщенное системе, идет на изменение (увеличение) ее внутренней энергии
, сообщенное системе, идет на изменение (увеличение) ее внутренней энергии 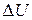 и на совершение системой работы
и на совершение системой работы  .
.
Внутренняя энергия идеального газа определяется суммарной кинетической энергией поступательного и вращательного движений составляющих его молекул:
 ,
,
где  - число степеней свободы молекул газа .
- число степеней свободы молекул газа .
Напомним, что числом степеней свободы 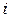 молекулы называется наименьшее число независимых координат, определяющих положение молекулы в пространстве, или число независимых движений, которые может совершать молекула. Для одноатомной молекулы
молекулы называется наименьшее число независимых координат, определяющих положение молекулы в пространстве, или число независимых движений, которые может совершать молекула. Для одноатомной молекулы 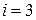 (три степени свободы поступательного движения), для двухатомной жесткой молекулы
(три степени свободы поступательного движения), для двухатомной жесткой молекулы  (три поступательные и две вращательные степени свободы), для трехатомной и более сложной жесткой молекулы
(три поступательные и две вращательные степени свободы), для трехатомной и более сложной жесткой молекулы  (три поступательные и три вращательные степени свободы).
(три поступательные и три вращательные степени свободы).
Для характеристики тепловых свойств газа (тела) пользуются физической величиной, называемой теплоемкостью (удельной  и молярной
и молярной  ).
).
Удельная теплоемкость  - это физическая величина, численно равная количеству тепла, необходимого для нагревания единицы массы вещества на один Кельвин:
- это физическая величина, численно равная количеству тепла, необходимого для нагревания единицы массы вещества на один Кельвин:
 ,
,
 - масса вещества,
- масса вещества,  .
.
Молярная теплоемкость  - это физическая величина, численно равная количеству тепла, необходимого для нагревания одного моля вещества на один Кельвин:
- это физическая величина, численно равная количеству тепла, необходимого для нагревания одного моля вещества на один Кельвин:
 ,
,
 - число молей вещества, [
- число молей вещества, [  ] =
] =  .
.
Между удельной  и молярной
и молярной  теплоемкостями существует очевидная связь
теплоемкостями существует очевидная связь
 ,
,
где  - молярная масса данного вещества (
- молярная масса данного вещества (  ).
).
Поскольку количество тепла  зависит от процесса, то для газов различают теплоемкости в зависимости от того, как идет нагревание: при постоянном объеме (
зависит от процесса, то для газов различают теплоемкости в зависимости от того, как идет нагревание: при постоянном объеме (  ) или при постоянном давлении (
) или при постоянном давлении (  ).
).
Применяя первый закон термодинамики к изохорическому и изобарическому процессам и учитывая определение молярной теплоемкости, получим значения:
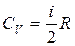 ,
,
 - формула Майера,
- формула Майера,
или  .
.
Отношение теплоемкостей при постоянном давлении и при постоянном объеме:

зависит только от числа степеней свободы  молекулы и, следовательно, представляют собой характерную для каждого газа величину. Эта величина называется коэффициентом Пуассона, или показателем адиабаты, так как входит в уравнение адиабатического процесса (уравнение Пуассона):
молекулы и, следовательно, представляют собой характерную для каждого газа величину. Эта величина называется коэффициентом Пуассона, или показателем адиабаты, так как входит в уравнение адиабатического процесса (уравнение Пуассона):
 .
.
Описание установки и методика измерений.
Установка представляет собой закрытый баллон, соединенный с водяным манометром и насосом (рис.1).
 Если с помощью насоса накачать в баллон воздух, то его давление внутри баллона станет выше атмосферного, что отмечается разностью уровней воды в обоих коленах манометра. При нагнетании воздуха внешние силы совершают над газом работу, за счет которой увеличивается внутренняя энергия газа и, следовательно, его температура станет выше комнатной. По истечении трех - четырех минут в результате теплообмена температура воздуха в баллоне понизится до комнатной, давление в баллоне за счет этого станет немного меньше, и разность уровней манометра сократится до установившегося значения
Если с помощью насоса накачать в баллон воздух, то его давление внутри баллона станет выше атмосферного, что отмечается разностью уровней воды в обоих коленах манометра. При нагнетании воздуха внешние силы совершают над газом работу, за счет которой увеличивается внутренняя энергия газа и, следовательно, его температура станет выше комнатной. По истечении трех - четырех минут в результате теплообмена температура воздуха в баллоне понизится до комнатной, давление в баллоне за счет этого станет немного меньше, и разность уровней манометра сократится до установившегося значения  . На диаграмме
. На диаграмме  (рис.2) это состояние обозначим точкой 1, параметры которого
(рис.2) это состояние обозначим точкой 1, параметры которого  . При этом давление
. При этом давление
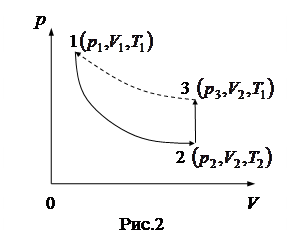
 , (1)
, (1)
где  - атмосферное давление,
- атмосферное давление,  - коэффициент пропорциональности. При быстром открывании на короткое время крана часть воздуха выходит, а оставшийся в баллоне воздух также быстро расширяется, и за это короткое время не успевает произойти теплообмен с окружающей средой, так что этот процесс можно считать адиабатическим расширением (кривая 1-2). Состояние 2 воздуха в баллоне характеризуется параметрами
- коэффициент пропорциональности. При быстром открывании на короткое время крана часть воздуха выходит, а оставшийся в баллоне воздух также быстро расширяется, и за это короткое время не успевает произойти теплообмен с окружающей средой, так что этот процесс можно считать адиабатическим расширением (кривая 1-2). Состояние 2 воздуха в баллоне характеризуется параметрами  . При этом
. При этом 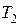 <
<  , так как при адиабатном расширении газ совершает работу за счет его внутренней энергии. При этом давление
, так как при адиабатном расширении газ совершает работу за счет его внутренней энергии. При этом давление  (атмосферному). Для адиабатического перехода из состояния 1 в состояние 2 справедливо уравнение Пуассона
(атмосферному). Для адиабатического перехода из состояния 1 в состояние 2 справедливо уравнение Пуассона
 . (2)
. (2)
После закрытия крана через три – четыре минуты воздух в баллоне нагреется до комнатной температуры  и его давление повысится до значения
и его давление повысится до значения  , что отмечается установившейся разностью уровней
, что отмечается установившейся разностью уровней  в коленах манометра. Так что
в коленах манометра. Так что
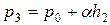 (3)
(3)
Нагревание воздуха происходит при постоянном объеме  , поэтому процесс 2 - 3 является изохорическим. Конечное состояние 3 характеризуется параметрами
, поэтому процесс 2 - 3 является изохорическим. Конечное состояние 3 характеризуется параметрами  . Так как температура в состояниях 1 и 2 одинакова и равна комнатной
. Так как температура в состояниях 1 и 2 одинакова и равна комнатной  , то пунктирная кривая 1 - 3 является изотермой, и для изотермического процесса справедлив закон Бойля – Мариотта:
, то пунктирная кривая 1 - 3 является изотермой, и для изотермического процесса справедлив закон Бойля – Мариотта:
 или
или  . (4)
. (4)
Возводим уравнение (4) в степень 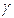 и делим на уравнение (2):
и делим на уравнение (2):
 , или
, или  , или
, или  .
.
Из последнего выражения находим показатель адиабаты:
 .
.
Так как давления  и
и  мало отличаются от давления
мало отличаются от давления  , то есть малые сжатия и разрежения воздуха, то разности логарифмов можно принять пропорциональными разности самих давлений. Тогда
, то есть малые сжатия и разрежения воздуха, то разности логарифмов можно принять пропорциональными разности самих давлений. Тогда 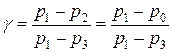 . В последнее выражение подставляем значения
. В последнее выражение подставляем значения  и
и  из равенств (1) и (3), и, сокращая коэффициент пропорциональности
из равенств (1) и (3), и, сокращая коэффициент пропорциональности  , получим
, получим
 . (5)
. (5)
Формула (5) является расчетной для определения коэффициента Пуассона  .
.
Порядок выполнения работы.
1. Осторожно, чтобы не выплеснулась вода из манометра, накачать воздух в баллон до разности уровней воды в коленах манометра в 15 - 20 см.
2. Закрыть кран и выждать три - четыре минуты, за которые температура внутри баллона понизится до комнатной, то есть воздух в баллоне будет находиться в состоянии термодинамического равновесия, и уровни воды в манометре установятся.
3. По нижним краям менисков отсчитать разность уровней  .
.
4. Быстро полностью открыть и сразу же закрыть кран. За это короткое время часть воздуха выйдет из баллона до установления в баллоне атмосферного давления  .
.
5. Подождать три - четыре минуты, пока температура в баллоне не повысится до температуры окружающей среды.
6. Отсчитать разность уровней воды в манометре  .
.
7. По формуле (5) вычислить экспериментальное значение коэффициента  .
.
8. Пункты 1 - 7 повторить несколько раз и данные измерений и вычислений записать в таблицу.
9. Определить среднее значение  .
.
10. По среднему значению  определить для каждого опыта абсолютную погрешность
определить для каждого опыта абсолютную погрешность  , а затем и ее среднее значение
, а затем и ее среднее значение  .
.
11. Результат записать в виде
 .
.
12. Сравнить полученное значение 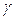 в пределах погрешности с
в пределах погрешности с  , вычисленным по формуле
, вычисленным по формуле  . Считать воздух двухатомным газом.
. Считать воздух двухатомным газом.
Таблица измерений и вычислений.
| № опыта | 
| 
| 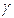
| 
| 
| 
|
| 1 | ||||||
| 2 | ||||||
| 3 |
Контрольные вопросы
1. Записать и сформулировать первый закон термодинамики.
2. Что называется внутренней энергией идеального газа?
3. Применить первый закон термодинамики ко всем изопроцессам.
4. Что называется молярной теплоемкостью газа? Единица измерения.
5. Что называется удельной теплоемкостью вещества? Единица измерения.
6. Что называется изохорной и изобарной теплоемкостями газа? Их формулы через число степеней свободы.
7. Записать формулу Майера.
8. Определить физический смысл универсальной газовой постоянной.
9. Какой процесс называется адиабатическим? Уравнение Пуассона для этого процесса.
10. Что называется коэффициентом Пуассона? Записать его формулу.
11. Изобразить и сравнить в координатах  графики изотермического и адиабатического процессов.
графики изотермического и адиабатического процессов.
12. При каком расширении, адиабатическом или изотермическом, газ совершает большую работу и почему?
13. Как выгоднее сжимать газ, адиабатически или изотермически и почему?
14. Назовите все изопроцессы, запишите их условия, уравнения и графики в координатах 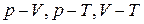 .
.
Лабораторная работа №9
«Измерение универсальной газовой постоянной.»
Цель работы: экспериментальная проверка уравнения Менделеева-Клапейрона и измерение универсальной газовой постоянной.
Приборы и принадлежности:
1. Установка ФПТ1-12.
2. Весы.
3. Колба.
4. Термометр.
Краткая теория
Для изучения физических свойств макроскопических систем, состоящих из большого числа частиц, используют два метода: статистический и термодинамический.
Статистический метод основан на законах теории вероятностей и математической статистики. Раздел теоретической физики, в которой изучают физические свойства макроскопических систем с помощью статистического метода, называется статистической физикой.
Термодинамический метод состоит в изучении физических свойств макроскопических систем путем анализа условий и количественных соотношений для процессов превращения энергии в рассматриваемых системах. Соответствующий раздел теоретической физики называется термодинамикой, а макроскопическая система в термодинамике - термодинамической системой.
Физические величины, служащие для характеристики состояния термодинамической системы, называют термодинамическими параметрами состояния системы.
К ним относятся: объём, давление, температура, концентрация и др.
Давление - физическая величина р, численно равная силе, действующей на единицу площади поверхности тела по направлению нормали к этой поверхности:
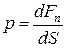 ,
,
где dFn– численное значение нормальной силы, действующей на малый участок поверхности тела площадью dS .
Единица измерения давления в СИ – Па, наиболее употребительные единицы других систем – бар, атм, мм.рт.ст.
Более сложным и менее наглядным является параметр состояния, называемый температурой. Понятие температуры имеет смысл только для равновесных состояний системы. Под равновесным состоянием понимают такое состояние системы, которое не изменяется с течением времени, причём это постоянство не связано с протеканием какого-либо процесса во внешней среде. С молекулярно-кинетической точки зрения температура равновесной системы характеризует интенсивность теплового движения частиц.
Абсолютная температура является мерой средней кинетической энергии поступательного движения молекул идеального газа:
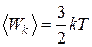 ,
,
где  Дж/К – постоянная Больцмана.
Дж/К – постоянная Больцмана.
Единица измерения температуры в СИ – К, наиболее употребительные единицы других систем – градусы Цельсия, градусы Фаренгейта, градусы Реомюра.
В молекулярно-кинетической теории пользуются моделью идеального газа, в котором:
- молекулы газа считаются материальными точками;
- столкновения молекул газа между собой и со стенками сосуда абсолютно упругие;
- потенциальной энергией взаимодействия между молекулами по сравнению с их кинетической энергией пренебрегают.
На основе экспериментов с достаточно разреженными газами были установлены законы, справедливые для идеального газа.
1. Закон Бойля - Мариотта (для изотермическогопроцесса).
pV = const. (1)
2. Закон Гей-Люссака (для изохорического процесса).
 . (2)
. (2)
3. Закон Шарля (для изобарического процесса).
 . (3)
. (3)
С помощью законов Бойля - Мариотта и Гей-Люссака легко найти связь между объёмом, давлением и температурой для произвольного равновесного состояния идеального газа:
pV0 = RT, (4)
где V0 – объем одного моля газа, R – универсальная газовая постоянная, численно равная работе, совершаемой одним молем газа при изобарном нагревании его на один градус.
Уравнение (4) называется уравнением Менделеева – Клапейрона (уравнение состояния идеального газа).
Для любой массы газа оно запишется как:
 , (5)
, (5)
где  – число молей (количество вещества).
– число молей (количество вещества).
Моль – количество вещества системы, в котором содержится столько же структурных элементов (молекул, атомов, ионов, электронов и других структурных элементов), сколько содержится атомов в 0,012 кг изотопа углерода  . Из определения моля следует, что 1 моль различных веществ (газообразных, жидких, твердых) содержит одинаковое число Авогадро NА = 6,022.1023 моль-1 структурных элементов.
. Из определения моля следует, что 1 моль различных веществ (газообразных, жидких, твердых) содержит одинаковое число Авогадро NА = 6,022.1023 моль-1 структурных элементов.
 называется молярной массой газа. Масса моля, выраженная в граммах, численно равна относительной молекулярной массе.
называется молярной массой газа. Масса моля, выраженная в граммах, численно равна относительной молекулярной массе.
Дата добавления: 2018-11-24; просмотров: 179; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

 = 11300
= 11300 
 1260
1260