Окисні властивості калій перманганату в кислому середовищі
Налийте в три пробірки по 1 мл розчину калій перманганату, підкисліть концентрованою сірчаною кислотою (1-2 краплі) і додайте: в першу пробірку – розчин натрій сульфіту, в другу – калій йодиду, в третю – ферум (ІІ) сульфату. Відзначте та поясніть зміни, які відбулися (зміну кольору розчинів, випадання осаду).
Окисні властивості калій дихромату
Проведіть дослід аналогічно попередньому, використавши як окисник розчин калій дихромату. Відзначте та поясніть зміни, що відбулися (зміна кольору розчинів, випадання осаду).
Відновлення перманганату калію в залежності від середовища
В три пробірки налийте по 1-2 мл розчину перманганату калію; в одну з пробірок додайте 2-3 краплі розчину сульфатної кислоти, в другу – 1-2 мл концентрованого розчину натрій гідроксиду. В усі три пробірки прилийте по 1-2 мл розчину натрій сульфіту.
Заняття 7
Розчини. Гідроліз солей
Програмні питання
1 Сольватна теорія розчинів Д. І. Менделєєва. Розчинність. Добуток розчинності. Способи вираження розчинності та концентрації розчинів.
2 Електролітична дисоціація. Ступінь дисоціації електролітів, його залежність від концентрації та температури. Сильні та слабкі електроліти. Константа дисоціації.
3 Реакції обміну в розчинах електролітів, йонно-молекулярні рівняння.
4 Дисоціація води, йонний добуток води. Водневий показник (рН) та способи його розрахунку.
|
|
|
Короткі теоретичні відомості
Гідролізом називають хімічну взаємодію солей з малодисоційованими молекулами води, яка призводить до утворення ще слабшого електроліту. Ця реакція є зворотною до реакції нейтралізації. Усі солі за будовою молекули можна поділити на чотири типи:
- солі І типу – утворені сильною кислотою та сильною основою (KNO3, BaCl2 тощо).
- солі ІІ типу – утворені сильною кислотою та слабкою основою (Zn(NO3)2, CuSO4 тощо).
- солі ІІІ типу – утворені слабкою кислотою та сильною основою (Na2CO3, Li2SO3 тощо).
- солі ІV типу – утворені слабкою кислотою та слабкою основою ((NH4)2CO3, (CH3COO)2Pb тощо).
Хімічну взаємодію з молекулами води здійснюють лише утворені при дисоціації відповідних солей йони слабких електролітів. Таким чином, за механізмом перебігу реакцію гідролізу можна розділити на три типи (солі І типу не гідролізують).
Гідроліз солей ІІ типу
Кількість стадій гідролізу лімітується зарядом йону слабкого електроліту (катіону), який утворюється при дисоціації солі:

Перша стадія.
ZnCl2 + H2O ↔ ZnOHCl + HCl,
Zn2+ + 2Cl– + H2O ↔ ZnOH+ + Cl– + H+ + Cl–,
Zn2+ + H2O ↔ ZnOH+ + H+.
Друга стадія.
ZnOHCl + H2O ↔ Zn(OH)2 + HCl,
ZnOH+ + Cl– + H2O ↔ Zn(OH)2 + H+ + Cl–,
ZnOH+ + H2O ↔ Zn(OH)2 + H+.
|
|
|
Надлишок йонів Н+, що утворюється під час реакції зумовлює кислу реакцію середовища (рН < 7).
Кількість стадій гідролізу дорівнює кислотності слабкої основи.
Гідроліз солей ІІІ типу
Кількість стадій гідролізу лімітується зарядом йону слабкого електроліту (аніону), який утворюється при дисоціації солі:
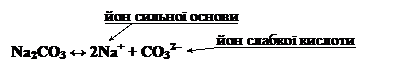
Перша стадія.
Na2CO3 + H2O ↔ NaHCO3 + NaOH,
2Na+ + CO32– + H2O ↔ Na+ + HCO3– + Na+ + OH–,
CO32– + H2O ↔ HCO3– + OH–.
Друга стадія.
NaHCO3 + H2O ↔ H2CO3 + NaOH,
Na+ + HCO3– + H2O ↔ H2CO3– + Na+ + OH–,
HCO3– + H2O ↔ H2CO3 + OH–.
Надлишок йонів OН–, що утворюється під час реакції зумовлює лужну реакцію середовища (рН > 7).
Кількість стадій гідролізу дорівнює основності слабкої кислоти.
Гідроліз солей ІV типу
Гідроліз солей ІV типу проходить в одну стадію незалежно від заряду катіону чи аніону.

(CH3COO)2Pb + 2H2O = 2CH3COOH + Pb(OH)2¯,
2(CH3COO)– + Pb2+ + 2H2O = 2CH3COOH ¯ + Pb(OH)2¯.
Гідроліз солей цього типу проходить повністю або майже повністю і записується в одну стадію, незалежно від кислотності слабкої основи чи основності слабкої кислоти. Середовище можна вважати близьким до нейтрального (рН ≈ 7).
Зразок картки контролю знань
1 Скільки мілілітрів 20% розчину К2SO3, густина якого
1,3 г/см3 необхідно взяти для приготування 2 л 2,6M р-ну?
|
|
|
2 Напишіть рівняння реакцій ступінчатої дисоціації H3PO4. Для кожного ступеню напишіть вираз для константи дисоціації.
3 Визначте рН розчину, в якому концентрація йонів ОН- дорівнює 1,67´10-13 моль/л.
4 Які з цих солей піддаються гідролізу:
CuSO4, Ba(NO3)2, K2Se, NaClO4 ?
Складіть для них молекулярні, повні та скорочені йонні рівняння реакцій гідролізу.
Для кожного випадку вкажіть реакцію середовища (кисле, лужне, приблизно нейтральне) та рН (більше, менше чи приблизно рівне 7).
Завдання для самостійної роботи
Завдання І
1 У воді масою 200 г розчинили калій гідроксид масою 11,2г. Густина одержаного розчину 1,04 г/см3. Обчисліть молярну концентрацію цього розчину.
2 Скільки грамів магній сульфату необхідно для приготування 200 мл 0,2 М розчину?
3 Визначіть молярну концентрацію розчину, 650 мл якого містить 5,6 г калій гідроксиду.
4 Яка маса HNO3 в 2 л її 0,1н розчину?
5 Визначіть молярну концентрацію розчину сульфатної кислоти з масовою часткою 44 %, густина якого 1,34 г/см3.
6 Обчисліть масу калій хлориду, необхідного для приготування розчину цієї солі об’ємом 300 мл, молярна концентрація якого становить 0,15 М.
|
|
|
7 Який об’єм 2 н нітратної кислоти можна приготувати з 50 л 100%-ної нітратної кислоти густиною 1,51 г/см3?
8 Обчисліть об’єм 5 М розчину КОН, необхідного для приготування 0,6 М розчину об’ємом 250 мл.
9 Густина 26%-го розчину КОН рівна 1,24 г/см3. Визначіть молярну концентрацію розчину.
10 Скільки мілілітрів 0,5 М розчину барій хлориду можна приготувати із 24,4 г BaCl2 . 2H2O?
11 Визначіть молярну концентрацію еквівалентів розчину алюміній сульфату, якщо у 200 мл його міститься сіль масою 11,4г.
12 Скільки грамів H3PO4 необхідно для приготування
100 мл 0,02 н розчину?
13 Визначіть молярну концентрацію розчину сульфатної кислоти з масовою часткою 10 %, густина якого 1,07 г/см3.
14 У воді розчинили хлороводень об’ємом 2,8 л (н.у.). Об’єм розчину довели до 500 мл. Обчисліть молярну концентрацію розчину хлоридної кислоти.
15 У воді масою 500 г розчинили калій сульфат масою 40г. Густина одержаного розчину 1,064 г/мл. Визначіть молярну концентрацію одержаного розчину.
Завдання ІІ
Напишіть рівняння реакцій ступінчатої дисоціації речовини А. Для кожного ступеня напишіть вираз константи дисоціації.
| В | Речовина А | В | Речовина А | В | Речовина А |
| 1 | H2SO4 | 6 | H3BO3 | 11 | Sn(OH)2 |
| 2 | Be(OH)2 | 7 | Mg(OH)2 | 12 | H2TeO4 |
| 3 | H2SiO3 | 8 | H3PO4 | 13 | Bi(OH)3 |
| 4 | Al(OH)3 | 9 | Ca(OH)2 | 14 | H2SeO3 |
| 5 | H2S | 10 | H2CO3 | 15 | Cr(OH)3 |
Завдання ІІІ
а) Визначіть рН розчину, якщо відома концентрація йонів Н+ чи ОН ¯.
б) Визначіть концентрацію йонів гідрогену, якщо відомий рН розчину.
а) б)
| В | йони | конц., моль/л | В | рН | |
| 1 | Н+ | 3,2·10-5 | 2 | 3,4 | |
| 3 | ОН- | 2,05·10-2 | 4 | 5,8 | |
| 5 | Н+ | 5,6·10-3 | 6 | ,3 | |
| 7 | ОН- | 4,3·10-7 | 8 | 9,4 | |
| 9 | Н+ | 2,1·10-8 | 10 | 14,5 | |
| 11 | ОН- | 4,8·10-10 | 12 | 0 | |
| 13 | Н+ | 2,8·10-4 | 14 | 0,4 | |
| 15 | ОН- | 7,4·10-1 |
| ||
Завдання ІV
1 Які з даних солей гідролізують? Напишіть молекулярні, повні та скорочені йонно-молекулярні рівняння реакцій гідролізу солей для вказаного варіанту. Вкажіть рН середовища.
| В | Солі | В | Солі | В | Солі |
| 1 | Na2S ZnBr2 CH3COONH4 KNO3 | 6 | Ba(CN)2 CuSO4 (NH4)2S KBr | 11 | NaNO2 MgSO4 Ba(NO3)2 (CH3COO)2Cu |
| 2 | Na2SO3 Fe2(SO4)3 (NH4)2CO3 CaCl2 | 7 | Na3BO3 ZnSO4 CH3COONH4 BaCl2 | 12 | NaI CoCl2 Na2CO3 Al2S3 |
| 3 | CH3COOK NH4Cl CuCO3 NaClO4 | 8 | KCN FeCl3 (NH4)2S BaCl2 | 13 | K2SO4 Fe(NO3)3 Cr2S3 K2CO3 |
| 4 | K2CO3 CuCl2 (NH4)2SO3 NaCl | 9 | K2S Cr(NO3)3 (CH3COO)2Zn NaNO3 | 14 | Na2SiO3 BeCl2 BaI2 NH4CN |
| 5 | BaS AlCl3 (NH4)2CO3 KCl | 10 | Ba(NO2)2 NH4Br (NH4)2SO3 NaCl | 15 | Na2S FeSO4 NaClO4 (NH4)2S |
Тест самоконтролю №1
1 Масова частка розчиненої речовини в розчині виражається:
а) відсотках (%); б) моль/л; в) г/л;
г) г/моль; д) моль/м3.
2 Загальна сума коефіцієнтів (у лівій і правій частинах) у рівнянні дисоціації натрій гідроксиду дорівнює:
а) 1; б) 2; в) 3; г) 4; д) 5.
3 В результаті дисоціації алюміній сульфату утворюються йони:
а) Al3+ і SО32−; б) Al3+ і SО42−; в) Al3+ і ОH−;
г) Al3+ і H+; д) H+ і SО42−.
4 Загальна кількість коефіцієнтів у сумарному рівнянні дисоціації кальцій гідроксиду становить:
а) 2; б) 3; в) 4; г) 5; д) 6.
5 Чому дорівнює рН розчину, якщо [H+] = 10-4 моль/л:
а) 2; б) 4; в) 6; г) -2; д) -4.
6 Вкажіть, яке скорочене йонно-молекулярне рівняння відповідає взаємодії між розчинами таких речовин: AgNO3 i FeCl3
а) Ag+ + Cl− = AgCl; б) Fe3+ + 3NO3− = Fe(NO3)3;
в) AgNO3 = Ag+ + NO3−; г) FeCl3 = Fe3+ + 3Cl−;
д) 3AgNO3 + Fe3+ = Fe(NO3)3 + 3Ag+.
7 Вкажіть, яке скорочене йонно-молекулярне рівняння відповідає взаємодії між розчинами таких речовин: CaCO3 i HCl
а) Ca2+ + 2Cl− = CaCl2;
б) CO32−+ 2H+ = H2O + CO2;
в) CaCO3 + 2H+ = Ca2+ + H2O + CO2;
г) CO32− + 2HCl = H2O + CO2+ 2Cl−;
д) CaCO3 = Ca2++ CO32−.
8 Чому дорівнює рН розчину, якщо [ОH−] = 10-3 моль/л:
а) 3; б) 7; в) 5; г) 9; д) 11.
9 Скільки грамів Na2SO4 необхідно взяти для приготування 2 л 8 %-го розчину натрій сульфату (ρ = 1,08 г/см3):
а) 172,8 г; б) 2160 г; в) 216 г;
г) 1728 г; д) 212,8 г.
10 Визначіть молярну концентрацію 36,2 %-го розчину HCl (ρ = 1,18 г/см3):
а) 11,7 моль/л; б) 23,4 моль/л; в) 35,1 моль/л;
г) 46,8 моль/л; д) 58,5, моль/л.
Відповіді
1 а, 2 в, 3 б, 4 г, 5 б, 6 а, 7 б, 8 д, 9 а, 10 а.
Тест самоконтролю №2
1 В результаті гідролізу плюмбум (ІІ) нітрату середовище стає:
а) нейтральним; б) лужним; в) кислим;
г) слаболужним; д) не змінюється.
2 В результаті гідролізу цинк хлориду середовище стає:
а) кислим; б) лужним; в) нейтральним;
г) слаболужним; д) не змінюється.
3 В результаті гідролізу калій карбонату середовище стає:
а) кислим; б) лужним; в) нейтральним;
г) слабокислим; д) не змінюється.
4 В результаті гідролізу амоній ацетату середовище стає:
а) кислим; б) лужним; в) слаболужним;
г) слабокислим; д) не змінюється.
5 У кислих розчинах рН:
а) >7; б) <7; в) =7; г) >14; д) =14.
6 Яке з наведених рівнянь відповідає реакції гідролізу ZnCl2:
а) Zn2+ + H2O = ZnOH+ + H+;
б) Cl− + H2O = HCl + OH−;
в) Cl− + H2O = HClO + H+;
г) Zn2+ + 2Cl− = ZnCl2;
д) сіль не гідролізує.
7 Яке з наведених рівнянь відповідає реакції гідролізу (NH4)2S:
а) NH4+ + H2O = NH4OH + H+;
б) 2NH4+ + S2– + 2H2O = 2NH4OH + H2S;
в) S2− + H2O = H2S + OH−;
г) NH4 + + S2− = NH4OH + H2S;
д) сіль не гідролізує.
8 Яке з наведених рівнянь відповідає реакції гідролізу Ca(NO3)2:
а) Ca2+ + 2H2O = Ca(OH)2 + H+;
б) Na+ + Cl− + H2O = NaOH + HCl;
в) сіль не гідролізує;
г) Cl− + H2O = HCl + OH−;
д) Cl− + H2O = HClO+ H+.
9 Який ряд солей піддається гідролізу з утворенням лужного середовища:
а) ZnCO3, CuCl2, KClO4; б) KI, Mg(ClO4)2, NiS;
в) Na2CO3, K2S, LiCN; г) FeCl2, CoSO4, BaI2;
д) NaCl, CdSO4, MgBr.
10 Який ряд солей піддається гідролізу з утворенням pH≈7:
а) NH4CN, NaCl, LiI;
б) BaSO4, FeCl2, Mg(NO3)2;
в) ZnI2, CuBr2, AlCl3;
г) Ca(CN)2, NH4Cl, K2CO3;
д) Cr(NO3)3, BeI2, FeBr2.
Відповіді
1 в, 2 а, 3 б, 4 д, 5 б, 6 а, 7 б, 8 в, 9 в, 10 а.
Хід роботи.
1 Гідроліз солей. Визначення pH середовища за допомогою універсального індикатора
В окремі пробірки всипте по декілька кристалів солей: алюміній хлориду, калій нітрату, натрій ортофосфату, амоній ацетату, натрій карбонату, плюмбум (ІІ) нітрату, натрій хлориду. У кожну пробірку прилийте по 5-6 крапель води і за допомогою універсального індикатора, користуючись відповідною шкалою, визначте pH кожного розчину. Які солі не гідролізують? Чому?
Дата добавления: 2018-04-05; просмотров: 1068; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
