Примеры решения типовых задач
Пример № 1. Напишите структурные формулы всех третичных аминов состава C5H13N и назовите их по рациональной номенклатуре.
Решение: Общая формула третичных аминов:
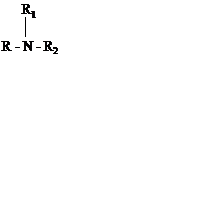
где R, R1, R2 – предельные углеродные радикалы.
Пять атомов углерода разбить на три радикала можно выделить двумя способами:
1) один радикал СН3 и два радикала С2Н5;
2) два радикала СН3 и один радикал С3Н7.
Последнему способу соответствуют два изомера, т.к. существует два радикала состава С3Н7: – СН2 – СН2 – СН3 (пропил) и – СН(СН3)2 (изопропил). Таким образом, всего существует три третичных амина состава C5H13N:
|
| |
Пример № 2. Каким образом можно осуществить превращения:
нитробензол ® анилин ® бромид фениламмония?
Приведите примеры.
Решение:
Нитробензол восстанавливается в анилин под действием различных восстановителей (реакция Зинина):

Анилин реагирует с бромоводородом с образованием бромида фениламмония:

Пример № 3 . Определите формулу третичного амина, в котором массовые доли углерода, водорода и азота равны соответственно 65,75; 15,07; 19,18 %. Назовите этот амин.
Решение:Пусть формула амина CxHуNz, где z = 1.
Тогда имеем: x : у : z = 65,75/12 : 15,07/1 : 19,187/14 = 5,479 : 15,07 : 1,37 =
= 4 : 11: 1.
Формула амина – C4H11N. Этой формуле отвечают 8 изомеров, но третичный амин один – диметилэтиламин.
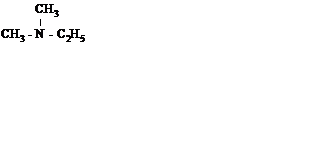
Пример № 4. Какая масса бензола потребуется для получения анилина массой 279 кг, если его выход составляет 75 %?
|
|
|
Решение:Анилин получают из бензола в две стадии. Сначала бензол подвергают нитрованию:
C6H6 + HNO3 ® C6H5NO2 + H2O (a)
Затем восстанавливают нитробензол до анилина, например, каталитическим гидрированием:
C6H5NO2 + 3H2 ® C6H5NH2 + 2H2O (б)
Определяем, какая масса анилина образовалась бы при количественном выходе, если реально получен продукт массой 279 кг:
m(C6H5NH2) =  ;
;
m(C6H5NH2) = 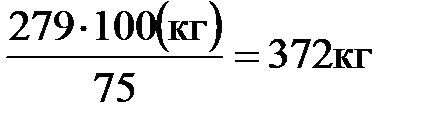
Находим количество вещества анилина:
n(C6H5NH2) = 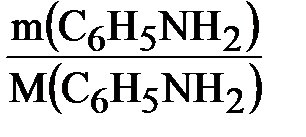 ;
;
n(C6H5NH2) = 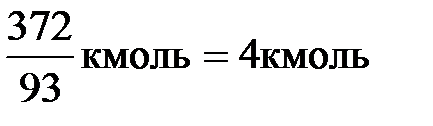
Из уравнений (а) и (б) следует:
n(C6H6) = n(C6H5NH2); n(C6H6) = 4 кмоль
Вычисляем требуемую массу бензола:
m(C6H6) = n(C6H6) × М(C6H6); m(C6H6) = 4 × 78 кг = 312 кг.
Упражнения и задачи для самостоятельной работы
281. Какой объём азота образуется при сгорании метиламина объёмом
20л, содержащего 2 % примесей?
282. Какие амины получаются при восстановлении:
| а) 2-нитробутана; | б) 4-нитротолуола; |
| в) 2- метил-2 нитропропана? | |
283. Объясните, почему анилин обладает более слабыми основными свойствами, чем метиламин.
284. Расположите в порядке возрастания основности следующие вещества:
а) метиламин; б) аммиак; в) анилин; г) диметиламин; д) дифениламин.
285. Каким образом можно осуществить превращения:
|
|
|
хлорид метиламмония ® метиламин ® азот?
Приведите уравнения реакций.
286. Напишите уравнения реакции диметиламина:
| а) серной кислотой; | б) с азотистой кислотой; |
| в) с раствором хлорида железа (III); | г) с кислородом; |
| д) с бромметаном. | |
287. Предложите схему получения изо-пропиламина из пропена и напишите уравнения соответствующих реакций.
288. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
СН4 ® С2Н2 ® С6Н6 ®C6H5NO2 ® C6H5NH2 ® C6H5NH3Cl
289. Закончите уравнения реакций:
| а) CH3NH2 + HCl ® | в) CH3NH2 + O2 ® |
| б) C6H5NO2 + HСl + Fe ® | г) C6H5NH2 + CH3J ® |
290. Напишите уравнения реакций, с помощью которых можно получить хлорид фениламмония исходя из бензола.
291. Напишите химические уравнения, соответствующие следующей схеме:
СаС2 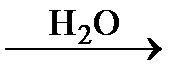 А
А 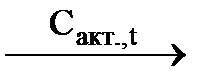 Б
Б 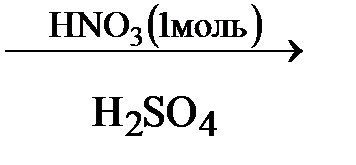 В
В 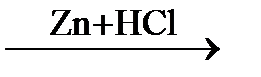 Г
Г
292. Закончите уравнения реакций:
| а) C6H5NO2 + (NH4)2S ® | в) C6H5NH2 + Br2 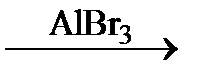
|
| б) C6H5NH3Cl + NaOH ® | г) (CH3)3N + CH3Cl ® |
293. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
CH3Cl ® C2H6 ® C2H4 ® А ® C2H5NO2 ® Б® (C2H5)2NH
Назовите вещества А и Б.
294. Предложите способ получения метиламина из неорганических соединений. Напишите уравнения реакций.
295. При нитровании 15,6 г бензола смесью концентрированных азотной и серной кислот выход мононитропроизводного составил 70 %. Сколько граммов продукта получено?
|
|
|
296. Какая масса анилина была образована при пропускании водорода через раствор нитробензола, полученного при взаимодействии железа с 0,5 М раствором хлороводородной кислоты объемом 200 мл?
297. При действии избытка раствора гидроксида натрия на раствор хлорида фениламмония массой 500 г получили анилин, на бромирование которого затратили бром массой 144 г. Массовая доля хлорида фениламмония в растворе составляет 10 %. Определите выход анилина.
298. При нитровании бензола массой 21 г образовался нитробензол, выход которого составил 85 %. Какая масса анилина получится при восстановлении нитробензола, если выход анилина составляет 80 %?
299. Какая масса 2,4,6-триброманилина может быть получена при взаимодействии анилина массой 9,8 г с бромом массой 52 г.
300. Раствор хлорида фениламмония массой 129,5 г и массовой долей 10 % обработали избытком гидроксида натрия. На бромирование полученного анилина затратили 36 г брома. Определите выход анилина, если бромирование его прошло количественно.
301. Рассчитайте массу триметиламина, который образуется при взаимодействии аммиака объёмом 5,6 л с избытком метилбромида.
|
|
|
302. Определите массу 2,4,6-триброманилина, который может быть получен при взаимодействии анилина массой 37,2 г с бромом массой 208 г.
303. При нитровании 0,2 моль бензола смесью концентрированных азотной и серной кислот при 50–60 оС было получено с 90 %-ным выходом мононитропроизводное. Сколько миллилитров амина образовалось при восстановлении этого нитросоединения железом в разбавленной соляной кислоте, если выход амина при восстановлении составляет 75 % (плотность 1,022 г/мл)?
304. Сколько граммов анилина необходимо затратить на нейтрализацию раствора хлороводородной кислоты (плотность 1,19 г/мл) объемом 20 мл с массовой долей HCl 60 %?
305. В анилиновое производство поступил бензол объёмом 4 м3 с плотностью 0,88 кг/л. Рассчитайте массу анилина, который может быть получен, если его выход составил 80 %.
306. Нитробензол массой 30 г был полностью прогидрирован. Газообразные продукты горения полученного соединения заняли объем 15 л. Каков выход реакции гидрирования?
307. На нейтрализацию смеси массой 60 г, состоящей из бензола, фенола и анилина, пошло 99,4 мл 20 % соляной кислоты (плотность 1,08 г/мл). При взаимодействии такого же количества смеси с избытком бромной воды образовался осадок массой 200 г. Вычислите массовые доли веществ в исходной смеси.
308. При пропускании смеси метана и этиламина через раствор соляной кислоты, взятый в избытке, объем смеси сократился на 30 %. Рассчитайте массовые доли компонентов в исходной смеси.
309. Имеется раствор анилина в органическом растворителе массой 25 г. К раствору добавили избыток брома, при этом выпал осадок 16,5 г. Определите массовую долю анилина в исходном растворе.
310. В 200 г смеси анилина, бензола и фенола пропустили сухой хлороводород. При этом образовалось 103,6 г осадка, который отфильтровали. Фильтрат обработали бромной водой, при этом получили 40 г осадка. Определите массовые доли веществ в исходной смеси.
311. Анилин, полученный восстановлением нитробензола массой 17 г, был полностью прогидрирован. Газообразные продукты горения полученного соединения после приведения к нормальным условиям заняли объём 7 л. Каков выход реакции восстановления нитробензола, если выходы остальных реакций равны 100 %?
312. Смесь метиламина, аминоуксусной кислоты и этилацетата массой 20 г может прореагировать с 4,93 л (н.у.) хлороводорода, а 40 г той же смеси могут прореагировать с 300 мл 1,4М раствора гидроксида калия. Вычислите массовые доли веществ в исходной смеси.
313. Установите молекулярную формулу третичного амина, если известно, что при его сгорании выделилось 0,896 л (н.у.) углекислого газа, 0,99 г воды и 0,112 л (н.у.) азота.
314. Определите молекулярную формулу вторичного амина, массовые доли углерода, водорода и азота в котором составляют 61, 15,3 и 23,7 % соответственно. Напишите его структурную формулу и название.
315. Рассчитайте массу 2,4,6-триброманилина, которая может быть получена при взаимодействии анилина массой 18,6 г с бромом массой 104 г.
АМИНОКИСЛОТЫ. ПЕПТИДЫ. БЕЛКИ
Аминокислоты – органические соединения, в состав молекул которых входят карбоксильная группа – СООНи аминогруппа – NH2, например:

|
Получение
Аминокислоты получают действием аммиака на галогензамещенные карбоновые кислоты, например:

Аминокислоты образуются при гидролизе природных соединений - белков.
Важнейшие аминокислоты
| № п/п | Наименование аминокислот | Формула |
| 1 | Глицин, аминоуксусная кислота | H2N – CH2 - COOH |
| 2 | a-Аланин, a-аминопропионовая кислота | 
|
| 3 | Валин, g- аминоизовалериановая кислота | 
|
| 4 | Лейцин, a-амино-g-метилвалериановая кислота | 
|
| № п/п | Наименование аминокислот | Формула |
| 5 | Изолейцин, a-амино-b-метилвалериановая кислота | 
|
| 6 | Фенилаланин, a-амино-b- фенилпропионовая кислота | 
|
| 7 | Аспарагиновая кислота, аминоянтарная кислота | 
|
| 8 | Глутаминовая кислота, a-амино - глутаровая кислота | 
|
| 9 | Лизин, a, e - диаминокапроновая кислота | 
|
| 10 | Серин, a-амино-b-гидроксипропионовая кислота | 
|
| 11 | Треонин, a-амино-b-гидроксимасляная кислота | 
|
| 12 | Цистеин, a-амино-b-тиопропионовая кислота | 
|
| 13 | Метионин, a-амино-g-метилтиомасляная кислота | 
|
Химические свойства
Химические свойства аминокислот обусловлены одновременным присутствием в молекулах двух функциональных групп. Карбоксильная группа, входящая в состав аминокислот, обладает кислотными свойствами (может отщеплять ион водорода), аминогруппа – основными свойствами (может присоединять ион водорода). За счёт этого аминокислоты обладают амфотерностью:
1. Реагируют с щелочами и кислотами, образуют соли, например:
H2N – CH2 – COOH + KOH ® H2N – CH2 – COOK + H2O
H2N – CH2 – COOH + HCl ® [H3N – CH2 – COOH]Cl
2. Со спиртами аминокислоты образуют сложные эфиры, например:
H2N – CH2 – COOH + C2H5OH  H2N – CH2 – CO – O – C2H5 + H2O
H2N – CH2 – CO – O – C2H5 + H2O
3. При нагревании аминокислоты разлагаются с образованием углекислого газа и амина:
H2N – CH2 – COOH ® H2N – CH3 + CO2
4. Аминокислоты могут взаимодействовать с галогенопроизводными углеводородов:
H2N – CH2 – COOH 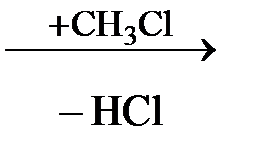 СH3NH – CH2 – COOH
СH3NH – CH2 – COOH 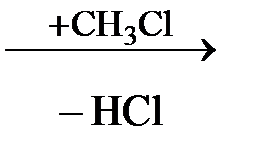
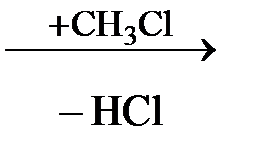 (CH3)2N – CH2 – COOH
(CH3)2N – CH2 – COOH
5. Аминокислоты вступают в реакции, в которых участвуют карбоксильная и аминогруппа различных молекул, например:
H2N – CH2 – COOH + H2N – CH2 – COOH ®
® H2N – CH2 – CO – NH – CH2 – COOH + H2O
Образующееся соединение называется пептидом (– СО – NH – пептидная связь).
Белки – природные соединения (полимерные вещества), представляющие собой продукты поликонденсации некоторых 2-аминокислот. Структуру цепи такого белкового полимера можно представить следующим образом:

где: R1, R2, R3 – боковые радикалы одинаковых или различных 2 - аминокислот.
Число остатков аминокислот, входящих в пептидную цепь, бывает очень большим, поэтому молекулярные массы белков достигают несколько миллионов. Белки образованы из более 20 аминокислот.
Важнейшее свойство белков – их способность к гидролизу. Гидролиз протекает под действием кислот или биологически активных веществ (ферментов). В результате гидролиза образуется смесь 2- аминокислот.
Дата добавления: 2018-04-05; просмотров: 2777; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

