КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
КАРБОНОВЫЕ КИСЛОТЫ– органические соединения, содержащие карбоксильную группу:
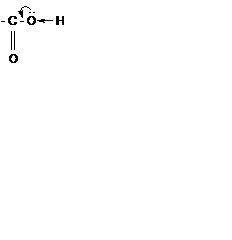
Карбоксильная группа –СООН состоит из карбонильной группы С=О и гидроксильной группы −ОН. В группе С=О атом углерода несёт частичный положительный заряд и притягивает к себе неподелённую электронную пару атома кислорода в группе ОН. При этом электронная плотность на атоме кислорода уменьшается, и связь О−Н ослабевает. В свою очередь, группа ОН ²гасит² положительный заряд на группе С=О, которая из-за этого теряет способность к реакциям присоединения, характерным для карбонильных соединений.
Получение
1. Окисление альдегидов и первичных спиртов

2. Гидролиз галогензамещённых углеводородов, содержащих три атома галогена у одного атома углерода

3. Из цианидов (нитрилов). Этот способ позволяет наращивать углеродную цепь

Метилцианид при нагревании легко гидролизуется с образованием ацетата аммония

При подкислении раствора выделяется кислота

4. Использование реакции Гриньяра по схеме

5. Гидролиз сложных эфиров

6. Гидролиз ангидридов кислот

7. Для отдельных кислот существуют специальные способы получения:
а) муравьиную кислоту получают при нагревании оксида углерода (II) с порошкообразным гидроксидом натрия под давлением с последующей обработкой формиата Na сильной кислотой

б) уксусную кислоту получают каталитическим окислением бутана кислородом воздуха
|
|
|

в) бензойную кислоту получают окислением алкилбензола

или из бензальдегида с помощью реакции Канниццаро

Химические свойства
Карбоновые кислоты более сильные кислоты, чем спирты, так как благодаря влиянию группы СО атом водорода в карбоксильной группе обладает большей подвижностью.
1. Монокарбоновые кислоты ведут себя как одноосновные кислоты. В водном растворе они диссоциируют

Тем не менее, карбоновые кислоты – это слабые кислоты.
Заместители, присутствующие в молекуле карбоновой кислоты, сильно влияют на её кислотность из-за оказываемого ими индуктивного эффекта.
Хлор или фенильный радикал оттягивают на себя электронную плотность (вызывают отрицательный индуктивный эффект –I эф.). Это приводит к повышению кислотности.
Алкильные группы обладают электронодонорными свойствами и создают положительный индуктивный эффект +I эф. Эти группы понижают кислотность. Дикарбоновые кислоты более сильные, чем карбоновые из-за взаимного влияния атомов в дикарбоновых кислотах.

2. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных (минеральных) кислот:
а) карбоновые кислоты реагируют с активными металлами, основными оксидами, основаниями и солями слабых кислот:
|
|
|

б) карбоновые кислоты – слабые кислоты, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей:

в) соли карбоновых кислот в водных растворах гидролизованы

3. Образование функциональных производных карбоновых кислот:
а) хлорангидриды получают действием фосфора (V) на кислоты

б) ангидриды образуются из карбоновых кислот при действии водоотнимающих средств

в) сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты (обратимая реакция этерификации)

или при взаимодействии хлорангидридов кислот с алкоголятами щелочных металлов

г) амиды кислот образуются при взаимодействии хлорангидридов карбоновых кислот с аммиаком

или при нагревании аммонийных солей

д) при нагревании амидов в присутствии водоотнимающих средств образуются нитрилы

Функциональные производные низших кислот – летучие жидкости. Все они гидролизуются с образованием исходных кислот:

4. Ряд свойств карбоновых кислот обусловлен наличием у них углеводородного радикала:
а) при действии галогенов на кислоты в присутствии красного фосфора образуются галогензамещённые кислоты. На галоген замещается атом водорода при соседнем с карбоксильной группой атоме углерода (a-углеродном атоме):
|
|
|

б) непредельные карбоновые кислоты способны к реакциям присоединения

в) непредельные карбоновые кислоты могут вступать в реакции полимеризации

5. Окислительно-восстановительные реакции карбоновых кислот:
а) карбоновые кислоты при действии восстановителей в присутствии катализаторов способны превращаться в альдегиды, спирты и даже в углеводороды

б) насыщенные карбоновые кислоты устойчивы к действию концентрированных серной и азотной кислот. Исключение составляет муравьиная кислота.

Муравьиная кислота отличается рядом особенностей, т. к. в её составе есть альдегидная группа

Муравьиная кислота – сильный восстановитель и легко окисляется до СО2. Она может вступать в реакцию ²серебряного зеркала²:

или

Муравьиная кислота окисляется хлором

в) в атмосфере кислорода карбоновые кислоты окисляются до СО2 и Н2О

6. Реакции декарбоксилирования:
а) насыщенные незамещённые монокарбоновые кислоты из-за большой прочности связи С − С при нагревании декарбоксилируются с трудом. Для этого необходимо сплавление солей щелочных металлов карбоновой кислоты со щёлочью
|
|
|

б) электронодонорные заместители в углеводородном радикале способствуют реакции декарбоксилирования

в) двухосновные карбоновые кислоты легко отщепляют СО2 при нагревании

Дата добавления: 2018-04-05; просмотров: 542; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
