Примеры решения типовых задач
Пример № 1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
 Укажите условия протекания реакций.
Укажите условия протекания реакций.
Решение:1. Действуя спиртовым раствором щёлочи на дибромпроизводное алкана, получаем пропин:
CHBr2 – CH2 – CH3 + 2KOH ® CHºC – CH3 + 2KBr + 2H2O
2. Пропин гидрируется до пропилена (катализатор – железо):
СН º С – СН3 + Н2 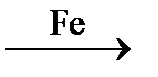 СН = СН – СН3
СН = СН – СН3
3. При взаимодействии пропина с аммиачным раствором оксида меди (I) получаем метилацетиленид меди (I):
СН º С – СН3 + Cu2O® 2CuC º С – СН3 + H2O
Пример № 2. Определить формулу алкина с плотностью 2,41 г/л при нормальных условиях.
Решение:
1. Общая формула алкина СnH2n−2.
2. Плотность d –это масса 1 литра газа при нормальных условиях. Так как 1 моль вещества занимает объём 22,4 л, то необходимо узнать, сколько весят 22,4 л такого газа:
M = (плотность d) ∙ (молярный объём Vm) = 2,41 г/л ∙ 22,4 л/моль = 54 г/моль.
Далее, составим уравнение, связывающее молярную массу и n:
14 n − 2 = 54, n = 4.
Значит, алкин имеет формулу С4Н6.
Ответ: С4Н6.
Пример №3. Технический карбид кальция массой 5 г обработали избытком воды и получили ацетилен, который с избытком аммиачного раствора оксида серебра образует ацетиленид серебра массой 15,6 г. Определите массовую долю CaC2 в техническом карбиде.
Решение: 1. Вычисляем количество вещества образовавшегося ацетиленида серебра Ag2C2:
n(Ag2C2) = 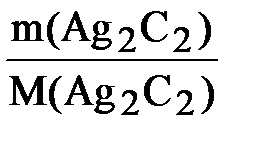 ; n(Ag2C2) =
; n(Ag2C2) = 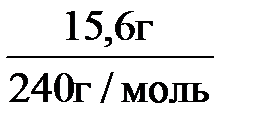 = 0,065 моль.
= 0,065 моль.
2. Составляем уравнения реакций между карбидом кальция и водой, ацетиленом и аммиачным раствором оксида серебра:
|
|
|
СаС2 + 2Н2О ®Са(ОН)2 + С2Н2
С2Н2 + Ag2О ®Ag2С2 + Н2О
n(СаС2) = n(Ag2С2); n(СаС2) = 0,065 моль.
3. Рассчитываем массу СаС2 в образце технического карбида:
m (СаС2) = n (СаС2) ×M (СаС2)
m (СаС2) = 0,065 моль × 64 г/моль = 4,16 г
4. Массовая доля СаС2 в техническом карбиде равна:
w(СаС2) = 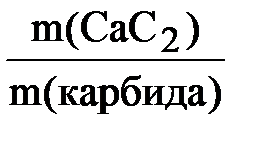 ; w(СаС2) =
; w(СаС2) = 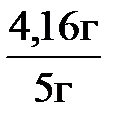 = 0,832 или 83,2 %.
= 0,832 или 83,2 %.
Пример №4. Напишите структурные формулы изомерных ацетиленовых углеводородов состава С7Н12, главная цепь которых состоит из пяти углеродных атомов, и назовите их.
Решение:
Тройная связь в главной цепи может находиться в положениях 1 и 2.
В первом случае возможны четыре структурных изомера (две группы −СН3 в положениях 3,3; 3,4; 4,4 или одна группа −С2Н5 в положении 3):

Во втором случае возможен единственный изомер, когда две метильные группы находятся в положении 4:

Ответ: 5 изомеров.
Пример № 5. При пропускании смеси пропана и ацетилена через склянку с бромной водой масса склянки увеличилась на 1,3 г. При полном сгорании такого же количества исходной смеси углеводородов выделилось 14 л (н.у.) оксида углерода (IV). Определите массовую долю пропана в исходной смеси.
Решение: Ацетилен поглощается бромной водой:
|
|
|
НC º СH + 2Вr2 → НСВr2 - СНВr2
1,3 г − это масса ацетилена; n(C2H2) = 1,3/26 = 0,05 моль. При сгорании этого количества ацетилена по уравнению
2С2Н2 + 5О2 = 4СО2 + 2Н2О
выделилось 2 ∙ 0,05 = 0,1 моль СО2. Общее количество СО2 равно
14/22,4 = 0,625 моль. При сгорании пропана по уравнению
С3Н8 + 5О2 = ЗСO2 + 4Н2О
выделилось 0,625 − 0,1 = 0,525 моль СО2, при этом в реакцию вступило
0,525/3 = 0,175 моль С3Н8 массой 0,175 ∙44 = 7,7 г.
Общая масса смеси углеводородов равна 1,3+7,7 = 9,0 г, а массовая доля пропана составляет: w(С3Н8) =7,7/9,0 = 0,856, или 85,6 %.
Ответ: 85,6 % пропана.
Пример 6. Дихлоралкан, в котором атомы хлора находятся у соседних атомов углерода, обработали избытком спиртового раствора щёлочи. Масса выделившегося газа оказалась в 2,825 раза меньше массы исходного дихлоралкана. Установите строение исходного соединения и продукта реакции.
Решение: При обработке дихлоралкана избытком спиртового раствора щёлочи отщепляются две молекулы хлороводорода и образуется алкин:
CnH2nCl2 + 2KOHспирт → CnH2n-2 + 2KCl + 2Н2О.
Согласно уравнению реакции, из 1 моль СnН2nСl2 массой (14n + 71) г выделяется 1 моль СnН2n-2 массой (14n − 2) г. По условию, (14n − 2) ∙ 2,825 = 14n + 71,
откуда n = 3. Искомый алкин − пропин, С3Н6, он образуется из 1,2-дихлор-
пропана.
Ответ:1,2-дихлорпропан; пропин.
|
|
|
Пример №7.Какой объём воздуха (н.у.) потребуется для сжигания смеси, состоящей из 5 л метана и 15 л ацетилена?
Решение:
(1) CH4 + 2O2 = CO2 + 2H2O
на 1 моль CH4 требуется 2 моль O2
(2) 2C2H2 + 5O2 = 4CO2 + 2H2O
на 2 моль C2H2 требуется 5 моль O2
Объём кислорода, который пойдёт на сжигание заданного объёма метана V1(O2) и ацетилена V2(O2), составит:
V1(O2) = 2V(CH4) = 2 ∙ 5 = 10 л;
V2(O2) = 5/2 V(C2H2) = 5/2 ∙ 15 = 37,5 л;
V(O2) = V1(O2) + V2(O2) = 10 л + 37,5 л = 47,5 л,
отсюда рассчитаем объём воздуха на сжигание (содержание кислорода в воздухе принимаем равным 21 % по объёму):
V(воздуха) = V(O2) : 0,21 = 47,5 л : 0,21 = 226 л.
Ответ: V(воздуха) = 226 л.
Дата добавления: 2018-04-05; просмотров: 954; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
