Упражнения и задачи для самостоятельной работы
36. Охарактеризуйте природу двойной связи в непредельных углеводородах.
37. Какие олефины могут быть получены при дегидрировании:
| а) изобутана; | в) 2-метилпентана; |
| б) диметилэтилметана; | г) пропана |
Напишите структурные формулы.
38. Напишите структурные формулы:
| а) 2-метилбутена- 2; | в) 2,2,6-триметил-4-этилгептена- 3; |
| б) 2,5,5-триметилгексена- 2; | г) 2,3-диметилгексена- 3. |
39. Назовите по международной номенклатуре следующие алкены:

40. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
С ® СН4 ® CH3Cl ® C2H6 ® C2H4 ® C2H5OH ® C2H4 ® CH2Br – CH2Br
41. Какие вещества образуются, если к бутену-1 присоединить бромоводород, а на полученный продукт подействовать спиртовым раствором гидроксида натрия? Составьте уравнения реакций.
42. Определите формулы веществ А, Б и В и составьте уравнения осуществляемых реакций:
CH3 – CH2 – CH2 – CH2Cl  A
A 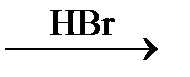 Б
Б  В
В
43. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
CH3 – CHOH – CH3 ® CH3 – CH = CH2 ® CH3 – CHCl – CH3 ®
® CH3 – CH = CH2 ® CH3 – CHBr – CH3
44. Напишите структурные формулы изомерных алкенов, имеющих формулу С6Н12. Назовите их.
45. Напишите уравнения реакций, укажите условия их проведения:
CH4 ® CH3Br ® C2H6 ® C2H5Br ® C2H4 ® C2H5Br ® C4H10
46. Закончить уравнение реакций, указать условия их проведения:
| а) СН3 – СН = СН2 + Br2 ® | в) CH2 = CH2 + [O] ® | ||
б) nCH2 = ch – ch = CH2 
| г) C2H5Br +  ® ®
| ||
| д) CH2 = CH – CH = CH2 + HBr ®
| |||
47. Напишите уравнения реакций, укажите условия их проведения:
С3Н8 ® CH3 – CHBr – CH3 ® CH3 – CH = CH2 ® CH3 – CHOH – CH3 ®
® CH3 – CH = CH2 ® C3H8
48. Закончить уравнения реакций, указать условия их проведения:
| а) СН3 – СН = СН2 + Н2О ® | в) СН2Cl – СН2Cl + Zn ® |
б) СН2 = СCl – СН = СН2 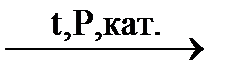
| г) СН2 = СH – СН = СН2 + H2 ® |
49. Чем объясняется факт существования цис-, транс-изомерии у соединений с двойной углерод-углеродной связью? Почему изомерия подобного рода не наблюдается у насыщенных углеводородов?
50. Установите неизвестные вещества и напишите уравнения реакций:
СН3 – СН2 – СН2 – СН2ОН ® А ® Б ® СН3 – СН = СН – СН3
51. Какой объем этилена (н.у.) необходимо пропустить через 600 г 1,2 % раствора бромной воды для её обесцвечивания?
52. В ходе каталитического гидрирования этиленового углеводорода CnH2n израсходовано 672 мл водорода. Определите формулу этого алкена, если при бромировании такого же количества этого углеводорода получено 6,48 г дибромида.
53. Алкен присоединил количественно 24,3 г бромоводорода. При нагревании полученного продукта с водным раствором гидроксида калия с выходом
60 % получено 10,8 г спирта. Определите формулу исходного алкена.
54. После завершения гидрирования смеси пропана с этиленом массой 6,4 г получили газ массой 6,6 г. Определите объемную долю пропана в исходной смеси газов.
|
|
|
55. 2-Метилпропен объёмом 0,784 л (н.у.) сожгли. Выделившийся оксид углерода (IV) полностью нейтрализовали водным раствором гидроксида натрия (массовая доля NaOH 15 %, плотность 1,17 г/моль). Рассчитайте объём раствора щёлочи, затраченного на нейтрализацию.
56. Из этилового спирта объёмом 40 мл (массовая доля примесей 6 %, плотность 0,807 г/мл) получили этилен объёмом 10,2 л (н.у.). Рассчитайте выход продукта реакции от теоретически возможного.
57. При термическом крекинге пропана объёмом 13,44 л получена смесь метана и этилена. Рассчитайте массу бромной воды, которую могут обесцветить продукты крекинга (массовая доля Br2 в бромной воде 3,2 %).
58. При гидрировании смеси этана с этиленом массой 11,6 г получен этан массой 12 г. Рассчитайте объёмную долю этилена в исходной смеси.
59. Сколько граммов галогенпроизводного образуется в результате взаимодействия пропилена объемом 2,24 л с хлороводородом.
60. Сколько литров дивинила образуется из раствора этилового спирта (плотностью 0,79 г/мл) объёмом 2 л, массовая доля С2Н5ОН в котором 95 %? Выход дивинила составляет 90 % от теоретически возможного.
61. Рассчитайте объём этилена, который можно получить из технического этилового спирта С2Н5ОН массой 300 г. Учтите, что технический спирт содержит примеси, массовая доля которых равна 8 %.
|
|
|
62. Рассчитайте объём водорода, который может присоединить смесь газов массой 15,4 г, содержащую этилен (массовая доля 54,5 %), пропилен (27,3 %) и бутилен (18,2 %).
63. К бутену-1 массой 47,6 г присоединили хлороводород. На образовавшееся хлорпроизводное подействовали спиртовым раствором щёлочи. Из реакционной смеси выделили бутен-2 объёмом 8,96 л (н.у.). Рассчитайте массовую долю выхода бутена-2. Составьте уравнения осуществляемых реакций.
64. Имеется газовая смесь объёмом 20 л, содержащая этан, этилен и водород. Эту смесь пропустили над нагретым платиновым катализатором. После приведения продуктов реакции к исходным условиям объём смеси составил 13 литров, из которых 1 л приходится на долю непрореагировавшего водорода. Определите объёмные доли газов в исходной смеси.
65. При гидрировании бутадиена-1,3 массой 8,1 г получили смесь бутана и бутена-1. При пропускании этой смеси через раствор брома образовался
1,2-дибромбутан массой 10,8 г. Определите массовые доли углеводородов в полученной смеси.
66. Алкен нормального строения содержит двойную связь при первом атоме углерода, 0,35 г этого алкена могут присоединить 0,8 г брома. Определите формулу алкена и назовите его.
|
|
|
67. Определите строение углеводорода, если известно, что его 8,4 г обесцвечивают бромную воду, присоединяют 3,36 л водорода в присутствии никелевого катализатора, а при окислении водным раствором перманганата калия на холоду образует соединение симметричного строения.
68. При реакции этиленового углеводорода с хлором в темноте образуется 42,3 г дихлорида, а при реакции образца такой же массы с бромом в тетрахлорметане – 69 г дибромида. Установите возможные структурные формулы исходного углеводорода.
69. Какой газ находится в цилиндре, если известно, что он гомолог этилена и для полного сгорания 60 см3 этого газа требуется 270 см3 кислорода (при н.у.)?
70. 10 л смеси этилена и пропана и 10 л водорода пропустили над катализатором. При этом общий объём смеси уменьшился до 16 л. Определите объёмное содержание пропана в исходной смеси.
АЛКИНЫ
АЛКИНЫ – углеводороды, молекулы которых содержат одну тройную связь. Общая формула CnH2n-2. Первый представитель – ацетилен НСºСН.
Для ацетиленовых углеводородов характерно состояние атома углерода с sp-гибридными орбиталями. Название алкинов по систематической номенклатуре производят от названий алканов с тем же числом углеродных атомов, заменяя окончание "ан" на "ин". При этом цифра после окончания показывает наименьший номер углеродного атома в цепи, который находится при тройной связи. Общая формула алкинов CnH2n –2.
Изомерия алкинов обусловлена:
1) изомерией углеродного скелета

2) изомерией положений тройной связи

Получение
1. Действием спиртового раствора щёлочи на дигалогеналканы

2. При действии галогеналканов на соли ацетиленовых углеводородов

3. Высокотемпературный крекинг метана

4. Гидролиз карбида кальция

Химические свойства
Химические свойства алкинов во многом аналогичны свойствам других непредельных соединений.
1. Галогенирование (алкины обесцвечивают бромную воду)

2. Гидрогалогенирование

В случае избытка галогеноводорода

3. Гидратация

4. Алкины обладают кислотными свойствами

5. Окисление перманганатом калия с разрывом тройной связи

6. Восстановление

Полимеризация ацетилена
1. Тримеризация на активированном угле при 500 оС с получением бензола:

2. Димеризация с получением винилацетилена:

Катализатор: водный раствор CuCl / NH4Cl.
Дата добавления: 2018-04-05; просмотров: 942; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
