Электролитическая диссациация. Сильные и слабые электролиты. Степень и константа диссоциации слабого электролита
Электролитическая диссоциация. Сильные и слабые электролиты. Степень и константа диссоциации слабого электролита
Исходя из степени диссоциации все электролиты делятся на две группы
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3).
Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов.
Между этими двумя группами четкой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом — слабого.
Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Константа диссоциации обычно обозначается Kd и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
Степенью диссоциации α называют – отношение числа молекул, распавшихся на ионы (n) к общему числу растворенных молекул (n0).
|
|
|
α = (n/n0)∙100
Степень диссоциации может изменяться от 0 до 1, от отсутствия диссоциации до полной диссоциации. В зависимости от величины степени диссоциации различают слабые и сильные электролиты. К слабым электролитам относят вещества, у которых степень диссоциации в 0,1 М растворах меньше 3%; если степень диссоциации в 0,1 М растворе превышает 30%, то такой электролит называют сильным. Электролиты, степень диссоциации которых лежит в пределах от 3% до 30%, называются электролитами средней силы.
К сильным электролитам относятся большинство солей, некоторые кислоты – НСl, НВr, НI, НNО3, НСlO4, Н2SO4 и основания щелочных и щелочноземельных металлов – щелочи LiОН, NаОН, КОН, RbОН, СsОН, Са(ОН)2, Sr(ОН)2, Ва(ОН)2.
Уравнение реакции диссоциации электролита АК на катионы К+ и анионы А– можно в общем виде представить следующим образом:
КА  К+ + А–
К+ + А–
и степень диссоциации α в данном случае можно выразить отношением молярной концентрации образовавшихся ионов [К+] или [А–] к первоначальной молярной концентрации электролита [АК]о, т.е.
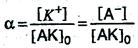
С увеличением концентрации раствора степень диссоциации электролита уменьшается.
Многоосновные кислоты и основания диссоциируют ступенчато – вначале от молекулы отщепляется один из ионов, затем другой и т.д. Каждая ступень диссоциации характеризуется своим значением константы диссоциации.
|
|
|
I ступень: Н2SO4 → Н+ + НSO4–
II ступень: НSO4– 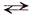 Н+ + SO42–
Н+ + SO42–
Общее уравнение: Н2SO4 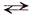 2Н+ + SO42–
2Н+ + SO42–
Процесс электролитической диссоциации характеризуют константой диссоциации(К). Так, для реакции КА 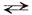 К+ + А– константа диссоциации:
К+ + А– константа диссоциации:
К = [К+]∙[ А–]/[КА]
Между константой и степенью электролитической диссоциации существует количественная связь. В приведенном примере общую концентрацию растворенного вещества обозначим с, а степень диссоциации α. Тогда [К+] = [А–] = α∙с и соответственно концентрация недиссоциированных частиц [КА] = (1 – α)с.
Подставив значения в выражение для константы диссоциации, получим соотношение
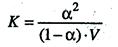 , поскольку молярная концентрация равна C = 1/V, то
, поскольку молярная концентрация равна C = 1/V, то 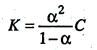
Данные уравнения является математическим выражением закона разведения Оствальда: константа диссоциации электролита не зависит от разведения раствора.
Задача.
Билет 2
Дата добавления: 2018-04-04; просмотров: 849; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
