Энергия Гиббса, физический смысл, уравнение Гиббса-Гельмгольца
Энергия Гельмгольца и Гиббса.
Свободная энергия Гиббса — это величина, показывающая изменение энергии в ходе химической реакции и дающая ответ на принципиальную возможность химической реакции; это термодинамический потенциал следующего вида:

Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Дифференциал энергии Гиббса для системы с постоянным числом частиц, выраженный в собственных переменных — через давление p и температуру T:

Для системы с переменным числом частиц этот дифференциал записывается так:

Здесь μ — химический потенциал, который можно определить как энергию, которую необходимо затратить, чтобы добавить в систему ещё одну частицу. 15. Энергия Гиббса и максимальная полезная работа.


Зависимость энергии Гиббса от давления и температуры, уравнение Гельмгольца-Гиббса.
Зависимость энергии Гиббса от температуры и давленияΔH – TΔS = U + pV– TΔS = G(7.21)
DH характеризует общее изменение энергии системы в ходе процесса, а изменение энергии Гиббса показывает, какая часть ее может быть превращена в полезную работу, поэтому раньше ее называли свободной энергией, в противоположность энтропийному члену, который характеризовал связанную энергию, недоступную для превращения в работу. а)  ; б)
; б) 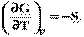 (7.20) Из уравнения 7.20а следует, что с ростом давления энергия Гиббса увеличивается, так как V> 0, но темп роста замедляется, так как объем постепенно уменьшается. Причем для разных идеальных газов эти кривые будут одинаковыми.
(7.20) Из уравнения 7.20а следует, что с ростом давления энергия Гиббса увеличивается, так как V> 0, но темп роста замедляется, так как объем постепенно уменьшается. Причем для разных идеальных газов эти кривые будут одинаковыми.
|
|
|
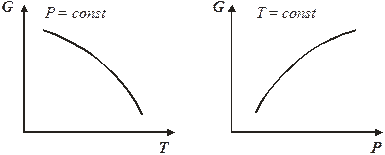
С ростом температуры энергия Гиббса убывает, так как энтропия всегда положительна, причем падение энергии Гиббса будет ускоряться из-за роста энтропии при повышении температуры.
Уравнение Гиббса - Гельмгольца.
Сочетанием уравнений  и
и  = -S и
= -S и
Гиббса  и
и 
можно получить уравнения Гиббса-Гельмгольца:
 и
и 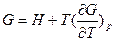
характеризующие запас свободной энергии для данного состояния системы в изотермических условиях.
На основе этих уравнений получают уравнения Гиббса-Гельмгольца для изменения термодинамических потенциалов:
 и
и 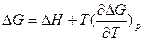 эти уравнения не используют в явном виде энтропию. Или:
эти уравнения не используют в явном виде энтропию. Или:
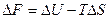 и
и 
Эти уравнения наиболее применимы для расчета изменений функций Гельмгольца и Гиббса при протекании химических реакций. Они связывают максимально полезную работу, при переходе системы из состояния 1 в состояние 2 с тепловым эффектом перехода системы из состояния 1 в состояние 2.
Легко показать, что

т.е. энергия Гиббса отличается от изменения энергии Гельмгольца на величину 
т.е. на изменение числа молей газообразных продуктов в ходе реакц.
|
|
|
Дата добавления: 2018-04-04; просмотров: 1577; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
