Контрольні запитання і завдання. 1. Яка відмінність між фенолами і ароматичними спиртами?
1. Яка відмінність між фенолами і ароматичними спиртами? Наведіть приклади.
2. Напишіть відомі вам формули одно-, двох- і трьохатомних фенолів. Які з них використовують у медицині та ветеринарії?
3. Наведіть методи розділення суміші бензолу, фенолу і динітробензолу.
4. Які методи синтезу одно-, двох- і трьохатомних фенолів ви знаєте? Напишіть необхідні рівняння хімічних реакцій.
5. Дайте коротку характеристику основних фізичних і хімічних властивостей фенолів.
6. У чому виявляється відмінність хімічних властивостей фенолів і спиртів? Проілюструйте рівняннями хімічних реакцій.
7. Дайте коротку характеристику фізичних і хімічних властивостей нафтолів.
8. Яку напрямну дію виконує група -ОН у бензольному ядрі? Проілюструйте прикладами хімічних реакцій.
9. Наведіть структурні формули фенолів та їх похідних, які використовують у хімічній промисловості.
Тема: Альдегіди і кетони
Мета: набути навичок якісного визначення альдегідів та кетонів, визначення їх хімічних властивостей.
Знати: будову альдегідів і кетонів; електронну будову карбонільної групи; хімічні властивості альдегідів (реакції приєднання, окиснення та відновлення); методи введення карбонільної групи; якісні реакції.
Вміти: складати формули ізомерів та називати їх; обґрунтовувати причини високої реакційної здатності карбонільних сполук; практично використовувати методи введення карбонільних груп; практично здійснювати якісні реакції.
|
|
|
Техніка безпеки: проявляти обережність і бути уважними при виконанні реакцій відновлення альдегідами гідроксиду купруму (ІІ), реактиву Фелінга, реакції “срібного дзеркала” під час роботи з обладнанням, хімічним посудом та реактивами.
Теоретична частина
Хімічні властивості альдегідів і кетонів мають також відмінності. Кетони менш реакційноздатні, ніж альдегіди. Вони не можуть відновлювати аміачні розчини аргентуму і купруму, не реагують з фуксинсульфітною кислотою - типовою реакцією на виявлення в розчинах альдегідів. Кетони не вступають у реакцію альдольної конденсації. Вони важче окиснюються, ніж альдегіди, а при їх окисненні утворюються дві більш низькомолекулярні кислоти чи інші оксосполуки, ніж ті, що вступали в реакцію.
Альдегіди і кетони використовують у хімічній промисловості для синтезу пластичних мас, барвників, засобів дезінфекції, медикаментів, реактивів та інших сполук. Окремі альдегіди використовують як засоби дезінфекції (наприклад, формальдегід), фіксатори анатомічних препаратів, у гістологічній та гістохімічній техніці (той самий формальдегід). Окремі кетони є органічними розчинниками (наприклад, ацетон), медикаментами (камфора). Моноцукри фактично також являють собою багатоатомні спирти, що містять у складі своїх молекул альдегідну, наприклад глюкоза, або кетонну, наприклад фруктоза, групи, завдяки чому їх називають альдозами і кетозами.
|
|
|
Хід роботи
Дослід 1. Реакція відновлення альдегідами гідроксиду купруму (II)
Реакція ґрунтується на здатності альдегідів відновлювані гідроксид купруму (II) в лужному середовищі при нагріванні.
В пробірку наливають 2 - 3 мл 10 %-го роз-чину їдкого натру і добавляють 1 мл 10 %-го розчину формаліну. Потім добавляють кілька крапель розчину сульфату купруму - випадає блакитний осад гідроксиду купруму (II). Нагрівають верхню частину суміші в пробірці і спостерігають за появою осаду оксиду купруму (І) червоного кольору.
Метаналь, на відміну від інших альдегідів, при такому нагріванні утворює на стінці пробірки «мідне дзеркало» - блискучу плівку металічної міді.
При взаємодії їдкого натру і сульфату купруму (II) утворюється гідроксид купруму (II):
2NаОН + СuSO4→Сu(ОН)2 + Nа2SO4.
У подальшому гідроксид купруму (II) взаємодіє з метаналем з утворенням форміатної кислоти:

Оксид купруму (І) може взаємодіяти з новими порціями метаналю, що зумовлює відкладання на стінках пробірки тонкого шару металічної міді:
|
|
|
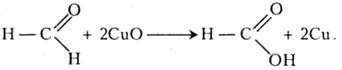
Цю реакцію часто називають реакцією Троммера на честь її автора - німецького хіміка С. А. Троммера (1806 - 1879).
Дослід 2.Реакція відновлення альдегідами реактиву Фелінга
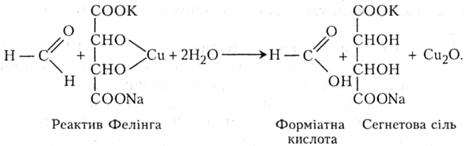
Німецький хімік-органік Г. X. Фелінг (1812 - 1885) запропонував реактив для виявлення в розчинах моноцукрів - альдоз, які містять у складі своїх молекул альдегідну групу.
В пробірку наливають 2 - 4 мл свіжоприготовленого реактиву Фелінга і добавляють 0,5-1 мл формаліну. Суміш нагрівають. Вона спочатку забарвлюється в зелений, а потім у жовтий колір. В кінці реакції на дно пробірки випадає осад оксиду купруму (І) червоного кольору.
Між метаналем і реактивом Фелінга відбувається така хімічна реакція:
Дослід 3.Реакція «срібного дзеркала»
Типовою реакцією, що дає змогу переконливо виявити альдегіди в розчинах, є реакція «срібного дзеркала». її широко використовують у хімічному аналізі для виявлення альдегідів, а також у хімічній промисловості - для виготовлення та відновлення дзеркал.
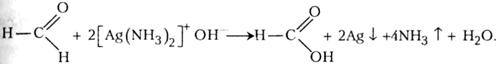
У чисту пробірку наливають 2 - 3 мл 1 - 2 %-го розчину нітрату аргентуму, після чого краплями добавляють 5 %-й розчин аміаку до розчинення бурого осаду гідроксиду аргентуму. Потім до прозорого розчину краплями добавляють 1 %-й розчин метаналю близько 1 мл. Суміш нагрівають на водяному огрівнику. Через кілька хвилин на стінці пробірки виявляється шар аргентуму у вигляді «срібного дзеркала».
|
|
|
При утворенні дзеркального шару на стінці пробірки відбуваються такі реакції:
AgNO3 + NH4OH → AgOH + NH4NO3;
2AgOH → Ag2O + H2O;
Ag2O + 4NH4OH → 2[Ag(NH3)2]+ OH- + 3H2O;
Дата добавления: 2018-02-28; просмотров: 989; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
