Контрольні запитання і завдання. 1. Напишіть структурні формули всіх відомих вам ізомерів С4H8, С5Н10, С6Н12, С6Н12, Назвіть ці речовини за раціональною номенк латурою і номенклатурою
1. Напишіть структурні формули всіх відомих вам ізомерів С4H8, С5Н10, С6Н12, С6Н12, Назвіть ці речовини за раціональною номенк латурою і номенклатурою IUРАС.
2.Напишіть структурні формули таких алкенів та назвіть їх за номенклатурою IUPAC:
а) метилетилен;б) етилетилсн; в) метилетилетилсн; г) етилізопропі-летилен; д) стиламілетилен.
3. Напишіть структурні формули таких алкенів та назвіть їх за раціо
нальною номенклатурою:
а) 2-метилпропен-1; б) 2-мстилгексен-3; в) 2,4-диметилгсксен-3; г) 2,2,3,5-тстрамстилгептсн-2.
4.Які лабораторні і промислові способи добування алкенів вам відомі? Наведіть приклади.
5.Як змінюються основні фізичні властивості алкенів у гомологічному ряду етилену?
6.Дайте коротку характеристику головних хімічних властивостей алкенів. Наведіть приклади реакцій.
7.У чому суть правила Марковникова? Поясніть його з позицій електронної будови молекул етиленових вуглеводнів.
8.Напишіть реакції взаємодії гідрогену, хлору, гідроген хлориду, сульфатної кислоти з такими алкенами і назвіть продукти реакції за номенклатурою IUРАС.
а) пропіленом; б) ізобутиленом; в) 2-метилпентеном-3.
9. Напишіть реакції окиснення за Вагнером, полімеризації таких алкенів:
а) етену; б) пропену; в) бутену-2; г) пентену-2; д) гсксену-2. Назвіть продукти реакції за номенклатурою IUРАС.
Тема: Алкіни
Мета: набути навичок добування ацетилену та вивчити його хімічні властивості
Знати: будову молекул (хімічну, електронну, просторову) алкінів; види ізомерії; фізичні властивості та їх закономірну зміну в гомологічному ряді; хімічні властивості, основні реакції, чітко розділяючи їх за типом.
|
|
|
Вміти: користуватися загальною формулою; складати скорочені структурні формули ізомерів; називати алкіни за міжнародною систематичною номенклатурою.
Техніка безпеки: проявляти обережність і бути уважними при добуванні ацетилену. Ацетилен може мати неприємний запах через наявність отруйних домішок- фосфіну, дигідрогенсульфіду тощо. Пам’ятати, що суміш ацетилену з повітрям вибуховонебезпечна! Рекомендується проводити роботу у витяжній шафі.
Теоретична частина
Ненасичені вуглеводні алкіни мають загальну формулу СnH2n-2. У складі своїх молекул мають потрійний зв'язок. Вони здатні вступати в реакції приєднання водню, галоген оводнів, води. Ці сполуки легко окислюються розчином перманганату калію (KMnO4) в кислому середовищі, вступають в реакцію заміщення (утворення ацетиленідів). Горять.
Дослід 1. Добування ацетилену
Реакція розроблена і запропонована німецьким хіміком Ф. Велером у 1862 р. Вона і нині є основним способом добування ацетилену для лабораторних і промислових потреб.
|
|
|
|

В суху пробірку вміщують кілька маленьких кусочків карбіду кальцію і закривають її пробкою, в яку вставлена пряма газовідвідна трубка. Остання сполучена з лійкою за допомогою гумової трубки, що має затискач. Прилад закріплюють у штативі (рис. 12). У лійку наливають воду. Потім краплями її випускають по трубці в карбід кальцію. Виділяється ацетилен, який використовують для проведення досліду.
Ацетилен утворюється в результаті взаємодії карбіду кальцію з водою:

Ацетилен, що утворився, може мати неприємний запах через наявність отруйних домішок - фосфіну, дигідроген сульфіду (сірководню), сполук арсену тощо. Рекомендується проводити роботу у витяжній шафі (хімічно чистий ацетилен - газ без запаху), – слід дотримуватись правил безпеки.
Дослід 2. Приєднання йоду ацетиленом
Молекула ацетилену має потрійний зв'язок. За наявності відповідних реагентів (наприклад, надлишку брому, йоду, хлору тощо) зв'язок розривається і відбувається реакція приєднання.
Газовідвідну трубку приладу, за допомогою якого добувають ацетилен, занурюють у пробірку, що містить 3 -5 мл розчину йоду в розчині йодиду калію. Через деякий час відбувається знебарвлення суміші.
|
|
|
Наявність у реагуючій суміші йоду сприяє розриванню потрійного зв'язку в молекулі ацетилену. Реакція відбувається в два етапи. Спочатку утворюється дийодетилен:
|
|
 Дийодетилен, у свою чергу, приєднує ще два атоми йоду, утворюючи насичену галогенопохідну - тетрайодетан:
Дийодетилен, у свою чергу, приєднує ще два атоми йоду, утворюючи насичену галогенопохідну - тетрайодетан:
Дослід3.Окиснення розчином перманганату калію
Наявність у молекулі ацетилену потрійного зв'язку дає йому змогу легко вступати в реакцію окисненння, що приводить до утворення різноманітних продуктів реакцій.
В пробірку наливають 2 - 3 мл 1 %-го розчину КМnO4, підлуженого розчином соди. При цьому спочатку розчин буріє, а через кілька хвилин випадає коричневий осад МnO2.
Розчин перманганату калію окиснює ацетилен у лужному середовищі до оксалатної кислоти. Реакція відбувається кілька етапів:
 |

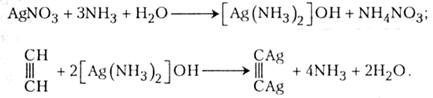
Дослід 4.Утворення-ацетиленіду аргентуму
Атоми гідрогену в молекулі ацетилену легко вступають у реакцію заміщення на атоми аргентуму, що приводить до утворення вибухової речовини - ацетиленіду аргентуму.
В пробірку наливають 2 - 3 мл 1-3 %-го розчину нітрату аргентуму, після чого добавляють концентрований водний розчин аміаку (нашатирного спирту) до зникнення каламуті й осаду. Утворюється аміачний розчин гідроксиду аргентуму. До добутого в такий спосіб розчину через газовідвідну трубку пропускають раніше одержаний ацетилен. Випадає осад - ацетиленід аргентуму. Осад відфільтровують. Фільтр разом з осадом висушують на азбестовій сітці, вміщепій на ввімкненій газовій плитці у витяжній шафі. Осад висушується, потріскує і вибухає.
|
|
|
Утворення ацетиленіду аргентуму відбувається в два етапи: спочатку утворюється аміачна сіль гідроксиду аргептуму, потім - ацетиленід аргентуму:
Дослід 5. Горіння ацетилену
Ацетилен горить. У разі нестачі кисню (у звичайному повітрі) під час горіння виникає кіптяве полум'я в результаті надлишку в молекулі вуглеводню карбону. За високого вмісту кисню в атмосфері (наприклад, у течії чистого кисню) ацетилен згоряє без кіптяви, з високою температурою горіння. Це використовують для автогенного зварювання, коли температура згоряння ацетилену в струмені чистого кисню досягає 3000 - 3500 °С.
Ацетилен через газовідвідну трубку пропускають у зовнішнє середовище і запалюють. Він горить кіптявим полум'ям.
 Інколи для проведення цієї роботи використовують спеціальний прилад (рис. 13). У пробірку з отвором у дні вміщують 2 - 3 маленьких кусочки карбіду кальцію, кусочок вати і закривають корком з відтягнутою скляною трубкою. Пробірку закріплюють у штативі, потім підводять до її скляної трубки стакан з водою. Після утворення ацетилену його підпалюють - у кінці скляної трубки виникає світне полум'я.
Інколи для проведення цієї роботи використовують спеціальний прилад (рис. 13). У пробірку з отвором у дні вміщують 2 - 3 маленьких кусочки карбіду кальцію, кусочок вати і закривають корком з відтягнутою скляною трубкою. Пробірку закріплюють у штативі, потім підводять до її скляної трубки стакан з водою. Після утворення ацетилену його підпалюють - у кінці скляної трубки виникає світне полум'я.
Для звичайного доступу кисню:
2С2Н2 + 3О2→2СО2↑ + 2Н2О + 2С.
Для посиленого доступу кисню:
СН ≡ СН + 21/2О2 → 2СО2 + Н2О + 1502,4 кДж.
Рис. 13. Прилад для горіння ацетилену: 1 - хімічний стакан; 2 - пробірка для карбіду кальцію і вати; 3 - відтягнута скляна трубка з корком.
Дата добавления: 2018-02-28; просмотров: 1534; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

