Контрольні запитання і завдання. 1.Напишіть структурні формули всіх спиртів, що відповідають таким молекулярним формулам: С4Н9ОН, СзН11ОН
1.Напишіть структурні формули всіх спиртів, що відповідають таким молекулярним формулам: С4Н9ОН, СзН11ОН, С6Н13ОН, С7Н15ОН іС 8Н]7ОН. Назвіть спирти за раціональною номенклатурою і номенклатурою IUРАС.
2.Напишіть хімічні реакції процесу перетворення первинного пропілового спирту на вторинний.
3. Накрссліть атомно-орбітальну схему будови молекули етанолу.
4. Напишіть рівняння реакцій добування первинних, вторинних і
третинних спиртів.
5.Метилат натрію і амілат натрію змішали і після цього добавили воду. Що утворилось? Як різняться між собою продукти реакцій?
6.Напишіть рівняння хімічних реакцій, за допомогою яких добувають метанол, етанол, пропанол-1 і пропанол-2.
7.Які фізичні та хімічні властивості характерні для одно-, двох і трьохатомних спиртів? Чим вони відрізняються один від одного?
8.Чим відрізняються хімічні властивості ненасичених і ароматичних спиртів від хімічних властивостей насичених спиртів? Проілюструйте прикладами.
9. Напишіть рівняння реакцій окиснення таких спиртів:
а) 2,3-диметилбутанолу-1; 6) 2,4-димстилгексанолу-1; в) 2-метил-пснтанолу-1.
10.Дайте коротку характеристику головних технологічних процесів добування етанолу з картоплі.
11.Яке значення мають спирти для народного господарства, хімічної промисловості, медицини й ветеринарії?
Тема: Феноли
Мета: ознайомитися з хімічними властивостями фенолів та їх якісним визначенням.
Знати: будову фенолів, їх класифікацію; систематичну номенклатуру; хімічні властивості фенолів; якісні реакції їх виявлення; загальні методи добування фенолів.
Вміти: на прикладі фенолу пояснювати взаємний вплив атомів у молекулах органічних речовин; передбачувати властивості речовин, до складу яких входить гідроксильна група (одна або декілька).
Техніка безпеки: проявляти обережність і бути уважними при добуванні феноляту натрію, бромуванні фенолу під час роботи з хімічним посудом та реактивами.
Теоретична частина
Хімічні реакції, в які вступають феноли, поділяють на два типи: а) реакції, що відбуваються завдяки наявності в молекулі фенолів гідроксилу (гідроксилів); б) реакції, зумовлені наявністю в молекулі фенолу бензольного ядра (бензольних ядер).
Хід роботи
Дослід 1.Добування і розкладання феноляту натрію
Феноли мають слабкокислі властивості. Ці властивості приблизно в 3300 разів слабкіші, ніж карбонатної кислоти. Феноли як кислоти реагують з лугами і утворюють солеподібні сполуки - феноляти, що добре розчиняються у воді і, на відміну від алкаиолятів, не розкладаються нею. Кислотні властивості фенолів значно вищі, ніж спиртів. Це пов'язано з впливом бензольного ядра на гідроксид. Однак ці властивості надзвичайно слабкі, про що свідчить факт, що така слабка кислота, як карбонатна, може розкладати феноляти на феноли й кислі натрієві або калієві солі.
В суху пробірку вміщують щіпку кристалів фенолу (руками не брати - будуть опіки), добавляють 1 - 2 мл води, струшують. Виникає емульсія каламутно-білого кольору. У суміш добавляють краплями розчин їдкого натру. Утворюється прозорий розчин феноляту натрію у воді. Вміст пробірки ділять на однакові частини. Одну частину виливають у чисту суху пробірку і добавляють 1 - 2 мл 10 %-го розчину хлоридної кислоти. В другу пробірку пропускають з апарата Кіппа деяку кількість вуглекислого газу. Фенолят натрію розкладається на фенол і гідрогенкарбонат натрію.
Утворення і розкладання феноляту натрію відбуваються за такими хімічними реакціями:
С6Н5ОН + NаОН → С6Н5ОNа + Н2O;
Фенол Фенолят натрію
С6Н5ОNа + НС1 → С6Н5ОН + NаСІ;
С6Н5ОNа + СO2 + Н2O → С6Н5ОН + NаНСО3.
Дослід 2.Бромування фенолу
Феноли - похідні аренів. їм властиві реакції заміщення .помів гідрогену бензольного ядра. Вони галогеиуються, нітруються і сульфуються. Гідроксильна група в молекулах фенолів є замісником першого роду і орієнтує заміщення атомів гідрогену в бензольному ядрі в о- і и-положення. Фенол легко вступає в реакцію з бромною водою, забарвлюючи її.
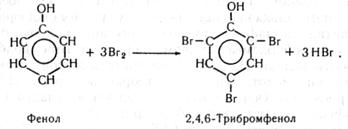
В пробірку наливають 2 - 3 мл 2 %-го розчину фенолу і добавляють 4 -5 мл бромної води, за звичайної кімнатної температури відбувається реакція заміщення помів гідрогену бензольного ядра на бром - утворюється білий осад важкорозчинного у воді 2,4,6-трибромфенолу.
Сумарна реакція бромування фенолу має такий вигляд:
Дослід 3. Кольорові реакції фенолів і нафтолів з хлоридом феруму
Феноли і різні сполуки, що містять у своїй молекулі фенольний гідроксил (фенольні гідроксили), можуть утворювати з хлоридом феруму (III) забарвлені комплексні сполуки. Це стосується і нафтолів.
Беруть сім пробірок, в кожну з них вміщують по кілька крапель одного з фенолів: в першу - 1 %-го розчину фенолу, в другу - 1 %-го розчину резорцину, в третю - 1 %-го розчину гідрохінону, в четверту - 1 %-го розчину пірокатехіну. Добавляють по 1-2 краплі 1н розчину РеС13. Виникає різноманітне забарвлення.
Кожний фенол дає певне характерне забарвлення в результаті утворення комплексної сполуки з хлоридом феруму (III). Наприклад, фенол, або карболова кислота, реагуючи з хлоридом феруму (III), утворює комплексну сполуку за такими рівнянням реакції:

Фенол і резорцин утворюють з хлоридом феруму (III) комплексні сполуки з фіолетовим забарвленням (якщо добавити розчин аміаку і бромну воду - з синім), пірокатехін - із зеленим, гідрохінон - із зеленим (воно швидко переходить у жовте - гідрохінон окиснюється в хінон).
Дата добавления: 2018-02-28; просмотров: 1914; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
