Завдання 16-30 мають кілька правильних відповідей. Оберіть правильні, на вашу думку, відповіді
16. Вкажіть формули несолетворних оксидів:
а) N2O; б) Na2O; в) CO; г) CuO; д) NO2.
17. Вкажіть всі речовини, які при нагріванні відносно легко розкладаються:
а) калій гідроксид; в) натрій гідроксид;
б) купрум (ІІ) гідроксид; г) алюміній гідроксид;
д) барій гідроксид.
18. За допомогою яких реактивів можна довести, що дана речовина є барій хлоридом:
а) арґентум нітрат; в) натрій сульфат;
б) купрум (ІІ) гідроксид; г) арґентум сульфат;
д) калій гідроксид.
19. Вкажіть сполуки, в яких валентність Сульфуру однакова:
а) SO3; б) SO2; в) H2S; г) KHSO4; д) S.
20. В результаті взаємодії з водою утворюють луги такі оксиди:
а) FeO; б) Na2O; в) CuO; г) N2O5; д) CaO.
21. Серед наведених прикладів формул виберіть формули солей:
а) HCl; б) CuOHCl; в) K2O2; г) NH4OH; д) Na3[Al(OH)6].
22. Луги добувають взаємодією:
а) металів з водою;
б) металів з кислотами;
в) оксидів металів з водою;
г) оксидів металів з кислотами.
23. До амфотерних гідроксидів відносяться:
а) Ba(OH)2; б) Zn(OH)2; в) Mn(OH)4; г) Ba(OH)2; д) Pb(OH)2.
24. Характеристиками кислот є:
а) кислотність; в) основність;
б) ступінь і константа дисоціації; г) ступінь і константа гідролізу;
д) здатність дисоціювати на гідроксид-йони і катіони.
25. Взаємодіяти між собою будуть оксиди:
а) CaO та SiO2; в) Al2O3 та Na2O;
б) SO2 та CrO3; г) K2O та FeO;
|
|
|
д) СО та CuO.
26. Нерозчині у воді основи утворюють солі:
а) AlCl3; б) K2CO3; в) NaNO3; г) Cu(NO3)2; д) Fe2(SO3)2.
27. Вкажіть пару солей, які будуть взаємодіяти:
а) AlCl3 та NaNO3; в) NaCl та AgNO3;
б) K2CO3 та BaCl2; г) K2SO3 та NaCl;
д) CaCl2 та K2SO4.
28. Вкажіть формули середніх солей:
а) Al2(SO4)3; б) CrOHCl2; в) KHCO3; г) Na3PO4; д) ZnBr2.
29. Вкажіть формули оксигеновмісних кислот:
а) HNO3; б) Ca(OH)2; в) Al(OH)3; г) CaO; д) KH.
30. Більшість кислотних оксидів взаємодіє з:
а) водою; б) кислотами; в) основними оксидами;
г) неметалами; д) основами.
Лабораторна робота № 2
Тема: Хімічний еквівалент. Визначення хімічного еквівалента металу методом витиснення їм водню.
Мета: визначити молярну масу еквіваленту магнію за об'ємом витиснутого водню.
Знати:поняття хімічний еквівалент, молярна маса еквівалента, молярний об'єм еквівалента, закон еквівалентів.
Вміти:розраховуватимолярну масу еквіваленту простих речовин,оксидів, кислот, солей, основ, молярний об'єм еквіваленту газів, розв'язувати задачі на закон еквівалентів.
Теоретичні передумови до заняття
Елементи, що входять до складу хімічних сполук, знаходяться між собою в певних співвідношеннях. Ці співвідношення відповідають їх еквівалентам.
|
|
|
У сучасному розумінні еквівалент – це частина атома, що припадає на одиницю валентності. Відповідно еквівалентна маса – це частина атомної маси, що припадає на одиницю валентності.
Існує поняття фактора еквівалентності - це число, що показує, яка частка реальної частинки речовини еквівалентна одному йону гідрогену в даній кислотно-основній реакції або одному електрону в даній окислювально-відновній реакції. Фактор еквівалентності може дорівнювати 1 або бути менше її.
Наприклад:
fекв.(НС1)=1; fекв.(Н2SО4)= 1/2;
fекв.(КМnО4)=1/5 (кисле середовище)
fекв. = 1/z(х), де z - число еквівалентності.
Молярна маса еквівалентів (Ме) – це маса речовини у грамах, що чисельно дорівнює еквівалентній масі, і має розмірність г/моль. Молярну масу еквівалента елемента визначають за формулою:

Наприклад, для карбону в СН4 еквівалент дорівнює ¼ атома карбону, молярна маса еквівалента Ме(1/4С) = 12/4 = 3 г/моль. Зі зміною валентності елемента змінюються його еквівалент і еквівалентна маса. Так, у сполуці СО, еквівалент карбону дорівнює ½ , Ме(1/2С) = 12/2 = 6 г/моль.
Знаючи еквівалентну масу елемента і його валентність (В), можна розрахувати його атомну масу:
|
|
|
А(Х) = Ме(1/zХ) · В
Задача. Розрахувати еквівалент і еквівалентну масу Сульфуру в сполуках ZnS, SO2, SO3.
Рішення. Визначаємо валентність Сульфуру в сполуках і виходячи з визначення поняття “еквівалент”, знайдемо:
для ZnS (валентність сульфуру 2)  (г/моль)
(г/моль)
для SO2 (валентність сульфуру 4)  (г/моль)
(г/моль)
для SO3 (валентність сульфуру 6)  (г/моль)
(г/моль)
Молярна маса еквіваленту дорівнює добутку фактора еквівалентності на молярну масу речовини:
Ме(х)=fекв. М(х)
Для визначення числа еквівалентності z необхідно врахувати клас неорганічних речовин і тип хімічної реакції.
Для оксидів z визначається добутком валентності елементу на число атомів елементу (n).

Наприклад: 
Для гідроксидів z визначається числом гідроксильних груп (n), тобто кислотністю:

Наприклад:

Для кислот Z визначається числом йонів гідрогену (n), здатних заміщуватися на йони металу, тобто основністю:

Наприклад:

Для солей Z визначається добутком валентності металу В на число атомів металу (n):

Наприклад:

Для реакцій окиснення-відновлення z визначається числом відданих (для відновника) або приєднаних (для окисника) електронів:
|
|
|

Наприклад:
2KMnO4+3H2SO4+5NaSO3=2MnSO4+K2SO4+5Na2SO4+3H2O

Для речовин, які знаходяться в газоподібному стані, введено поняття еквівалентного об'єму цих речовин.
Молярний об'єм еквівалента - об'єм, який займає один еквівалент газуватої речовини за нормальних умов.

Де Vm – молярний об'эм газу за нормальних умов (22,4 л/моль),
n – число атомів елемента; В – його валентність .
Для водню  ;
;
Для кисню 
Знаючи еквівалент одного елементу і визначивши, яка вагова кількість другого елементу сполучається з одним еквівалентом першого, ми тим самим встановлюємо чисельне значення еквіваленту другого елементу, використовуючи закон еквівалентів:
Закон еквівалентів: маси реагуючих речовин пропорційні їх молярним масам еквівалентів.

Молярна маса еквіваленту сполуки дорівнює сумі молярних мас еквівалентів складових її частин.
Задача. При розчиненні у воді 0,045 г тривалентного металу виділилось 56 мл водню, виміряного при нормальних умовах. Визначить еквівалентну масу і назву елементу.
Рішення. Враховуючи, що еквівалентний об'єм водню дорівнює 11,2 л, визначаємо еквівалентну масу металу за формулою:
 ;
;  (г/моль)
(г/моль)
Використовуя співвідношення: Ме(Х) = А(Х)/валентність; визначаємо атомну масу металу: А = 9 · 3 = 27, метал алюміній.
Експериментальна частина
Наважку металу помістить в одну частину склянки Лондаля, потім прилийте через маленьку лійку 5 мл розведеної сульфатної кислоти так, щоб вона не потрапила на метал. Приєднайте склянку до резинової трубки прилада (рис 1).
|
|
Рис.1. Прилад для визначення молярної маси еквіваленту металу.
1- зрівнювальна посудина;
2- бюретка;
3- резинова трубка.
Відмітьте і запишіть рівень води в бюретці. Відлік ведіть по нижньому меніску з точністю до 0,1 мл. Перехиліть склянку так, щоб кислота потрапила на метал і спостерігайте виділення водню і витиснення води із бюретки. Після закінчення реакції заплішить рівень води в бюретці.
Відміряйте і запишіть показання кімнатного термометру і барометру під час досліду. Під час досліду не залишайте пробірку з кислотою висячою. Після закінчення досліду сосуд з кислотою зніміть, вилийте вміст його в склянку для зливу кислот, промийте і помістіть на штатив з бюреткою.
Форма запису спостережень
Маса металу, г
Температура Т, K (t°С+273К) -
Атмосферний тиск Р, кПа
Тиск водяного пару, РН2О (з таблиці)
Рівень води в бюретці до реакції, a1
Рівень води в бюретці після реакції, a2
Обробка результатів
1. Визначіть об'єм водню (в мл), витісненого при температурі Т і тиску Р
V = a2 - a1
2. Приведіть даний об'єм водню. до нормальних умов за формулою
 , де
, де
Т - абсолютна температура;
РН2О - тиск водяних парів при даній температурі;
3. Визначіть масу витісненого водню m, знаючи що один моль водню
за нормальних умовах займає об'єм 22,4л.
4. Визначіть молярну масу еквіваленту металу, знаючи його масу і
масу витісненого ним водню за формулою:
 , де
, де
т(Ме) - маса взятого металу, г;
m(Н2) - маса водню, що виділився, г;
Ме(Н2) - молярна маса еквіваленту водню, г/моль.
5. Обчисліть теоретичну молярну масу еквіваленту магнію за
формулою:
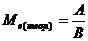 , де
, де
А - відносна атомна маса магнію; В - валентність магнію.
6. Визначіть помилку досліду:

Помилка - відносна помилка досліду, %;
Мекспер. - значення молярної маси еквіваленту металу за даними досліду, г/моль;
Мтеор. – теоретичне значення молярної маси еквіваленту металу, г/моль.
Контрольні питання
1. Що називається хімічним еквівалентом елемента і складної речовини?
2. Що називається молярною масою еквівалента, молярним об'ємом
еквівалента?
3. Сформулюйте закон еквівалентів.
4. Як обчислити молярні маси еквівалентів оксидів, кислот, гідроксидів, солей?
5. Обчислити молярну масу еквіваленту Na2СО3 для реакцій :
Na2СО3 + НСl → NaНСО3 + NaСl
Na2СО3 + 2НСl → Н2СО3 + 2NaСl
6. Визначити масу оксиду, одержаного при окисленні металу масою
Зг. Молярна маса еквівалента металу дорівнює 9г/моль.
7. На нейтралізацію кислоти масою 3,375 г потрібно гідроксид натрію
масою Зг. Визначити молярну масу еквіваленту кислоти.
8. При нагріванні 20,06г металу одержали 21,66г оксиду. Визначити
молярну масу еквівалента металу, враховуючи, що Ме(0)=8г/моль.
9. З нітрату металу масою 3,85г одержали його гідроксид масою
1,60г. Визначити молярну масу еквівалента металу Ме(Ме).
10. Скільки г металу, молярна маса еквіваленту якого 12.16г/моль,
взаємодіє з 310см3 оксигену при н.у.
11. В якій масі Са(ОН)2 міститься стільки ж еквівалентів, скільки в
312 г АІ(ОН)з?
Тестові завдання для самоперевірки та контролю засвоєння знань
Дата добавления: 2018-02-28; просмотров: 1406; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

