Дослід 1. Залежність швидкість гомогенної хімічної реакції від концентрації реагуючих речовин
У три конічні колби внесіть розчин натрій тіосульфату і дистильовану воду в об`ємах, які вказані в таблиці. По черзі в кожну колбу швидко прилийте по 15 мл сульфатної кислоти. Змішані розчини слід перемішати, щоб реакція проходила по всьому об`єму. За допомогою секундоміру виміряйте час від моменту змішування розчинів до помітного помутніння розчину.
Реакція натрій тіосульфату з сульфатною кислотою протікає за рівнянням:
Na2S2O3 + H2SO4 = Na2SO4 + H2S2O3
H2S2O3 = SO2 + S↓ + H2O
Початком реакції слід вважати момент змішування розчинів, а кінцем – момент помутніння розчину внаслідок утворення нерозчинної у воді сірки..
Результати спостережень запишіть в таблицю:
| № п/п | Oб`єм, мл | Відносна концентр. Na2S2O3
| Тривалість реакції t, с | Відносна швидкість реакції | ||
| Na2S2O3 | H2O | H2SO4 | ||||
| 1 | 5 | 10 | 15 | 1 | ||
| 2 | 10 | 5 | 15 | 2 | ||
| 3 | 15 | 0 | 15 | 3 | ||
Залежність швидкості реакції від концентрації натрій тіосульфату відобразіть у вигляді графіка. На осі абсцис відкладіть у певному масштабі відносні концентрації натрій тіосульфату, на осі ординат – відповідні значення швидкості реакції в умовних одиницях.
Дослід 2. Вплив температури на швидкість реакції.
Залежність швидкості реакції від температури вивчають на прикладі реакції:
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S↓ + H2O
В три пробірки налийте по 5 мл розчину натрій тіосульфату, а в три інші – по 5 мл розчину сульфатної кислоти.
|
|
|
Змішайте розчин натрій тіосульфату з розчином сульфатної кислоти при кімнатній температурі. За допомогою секундоміру виміряйте час від моменту змішування розчинів до помітного помутніння розчину.
Другу пару розчинів помістить у водяну баню, з температурою 40 ºС, третю пару - у водяну баню, з температурою 60 ºС. Проведіть досліди для кожної пари, результати спостережень запишіть в таблицю.
| № досліду | Температура досліду, 0C | Тривалість реакції t, с | Відносна швидкість реакції  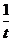 , с-1 , с-1
|
| 1 | |||
| 2 | |||
| 3 |
Намалюйте графік залежності швидкості реакції від температури. На осі абсцис відкладіть у певному масштабі температуру досліду, на осі ординат – відповідні значення швидкості реакції.
Напишіть формулу Вант-Гоффа і розрахуйте значення температурного коефіцієнта виходячи з даних досліду.
Зробіть висновки про залежність швидкості реакції від температури.
Контрольні питання і задачі
1. Вкажіть фактори, які впливають на швидкість хімічних реакцій.
2. Дайте формулювання закону діючих мас.
3. Що показує температурний коефіцієнт реакції?
4. Чому дорівнює швидкість реакції А + В = АВ, якщо концентрація речовин А і В дорівнює 2 моль/л, а k = 1,5 л/(моль · с) ?
|
|
|
5. Як зміниться швидкість реакції
2NO(г) + O2(г) = 2NO2(г)
Якщо: а) збільшити тиск у системі в 3 рази;
б) зменшити об`єм системи в 3 рази;
в) збільшити концентрацію NO в 3 рази?
6. На скільки градусів треба підвищити температуру реакційного середовища, щоб швидкість реакції, що в ній перебігає, зросла у 125 разів. Температурний коефіцієнт реакції γ = 3.
7. Сформувати принцип Ле Шательє.
8. Рівноважні концентрації речовин у реакції:
N2(г) + 3H2(г) D 2NH3(г); DН°298 = -92,4 кДж/моль
дорівнюють: С (N2) = 3 моль/л; С(H2) = 9 моль/л ; С(NH3) = 4 моль/л
Визначте: а) Початкові концентрації H2 і N2
б) В якому напрямку зміститься рівновага з підвищенням температури?
в) В якому напрямку зміститься рівновага якщо зменшити об`єм реакційної судини?
9. Рівноважні концентрації речовин у реакції: CO + Cl2 D COCl2
дорівнюють: С(СO) = 0,2 моль/л; С(Cl2)=0,3 моль/л; С(COCl2)=1,2 моль/л.
Визначте константу рівноваги.
10. Використовуючи принцип Ле Шательє, вкажіть, в якому напрямку зміститься стан рівноваги в реакціях:
1) 2SO2(г) + O2(г) D 2SO3(г) DН°298 = - 192,74 кДж/моль
2) N2O4(г) D 2 NO2(г) DН°298 = + 54,47 кДж/моль
|
|
|
а) при підвищенні температури?
б) при зниженні тиску?
Тестові завдання для самоперевірки та контролю засвоєння знань
Дата добавления: 2018-02-28; просмотров: 897; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
