Минеральные вещества. Структура и функции воды в клетке
Растения способны поглощать из окружающей среды практически все элементы периодической системы, но для нормального жизненного цикла растительного организма необходима лишь определенная группа основных питательных элементов, функции которых в растении не могут быть заменены другими химическими элементами. В эту группу входят следующие 19 элементов:

Среди этих основных питательных элементов лишь 16 являются собственно минеральными, так как С, Н и О поступают в растения преимущественно в виде С02, 02 и Н20. Необходимость Na, Si и Со для всех высших растений пока не установлена. Натрий поглощается в относительно высоких количествах некоторыми видами сем. Chenopodiaceae (маревых), в частности свеклой, а также видами, адаптированными к условиям засоления, и в этом случае является необходимым. То же справедливо для кремния, который в особенно больших количествах встречается в соломине злаковых, для риса он является необходимым элементом.
Первые четыре элемента — С, Н, О, N — называют органогенами. Углерод в среднем составляет 45% сухой массы тканей, кислород — 42, водород — 6,5 и азот—1,5, а все вместе—95%. Оставшиеся 5% приходятся на зольные вещества: Р, S, К, Са, Mg, Fe, Al, Si, Na и др. О минеральном составе растений обычно судят по анализу золы, остающейся после сжигания органического вещества растений. Содержание минеральных элементов (или их окислов) в растении выражают, как правило, в процентах по отношению к массе сухого вещества или в процентах к массе золы. По содержанию элементов в растении их делят на следующие группы:
|
|
|
1. макроэлементы, содержание которых в клетке составляет до 10-3 %. Это кислород, углерод, водород, азот, фосфор, сера, железо, кальций, натрий и магний, составляющие вместе свыше 99 % массы клетки;
2. микроэлементы, содержание которых колеблется от 10-3 % до 10-12 %.: марганец, медь, цинк, кобальт, молибден, бор, хлор. На их долю приходится менее 1,0 % массы клетки;
3. ультрамикроэлементы, составляющие менее 10-12 %.Это золото, серебро, уран, селен — в сумме менее 0,01 % массы клетки. Физиологическая роль большинства этих элементов не установлена.
Содержание того или другого элемента в тканях растений не характеризует степень его значимости, оно непостоянно и может сильно изменяться под влиянием факторов внешней среды.
Структура и функции воды в клетке
Вода является самым распространенным неорганическое соединением в клетках живых организмов. Ее содержание колеблется от 10% в сухих семенах до 98 % у водорослей. Количество воды в клетках зависит от характера обменных процессов: чем они интенсивнее, тем выше содержание воды.
В связи с тем, что атомы водорода в молекуле расположены по отношению к атому кислорода под тупым углом 104,5°, молекула воды, будучи электронейтральной, имеет на одной стороне отрицательный, а на другой — положительный заряды. Такие молекулы называют диполями (Рис.4).
|
|
|
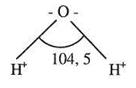
Рисунок 4. Структурная формула молекулы воды
Благодаря этому молекулы воды могут ассоциировать друг с другом, ионами и белковыми молекулами.
Каждая молекула воды, являясь диполем с тетраэдрическим распределением электронов вокруг атома кислорода, может взаимодействовать с четырьмя другими молекулами воды за счет электростатического взаимодействия атомов Н и О соседних молекул.
Водородные связи образуются следующим образом: кислород при образовании ковалентной связи в молекуле воды притягивает электрон водорода; такой «оголенный» водород способен притягивать соседние молекулы воды или сам притягиваться к молекулам веществ цитоплазмы. Водородные связи значительно слабее ковалентных связей (примерно в 24 раза). Наличие в молекуле воды двух протонов и двух одинаковых пар электронов обеспечивает формирование четырех водородных связей с окружающими молекулами воды с образованием особой решетчатой структуры.
Водородные связи непрерывно возникают и разрушаются. Время полужизни каждой из них — менее 1 10-9с. Структура жидкой воды сохраняется очень короткое время, потом распадается, снова возникает, причем эти процессы протекают в отдельных собранных вместе группах молекул воды, названных «мерцающими кластерами». Пространство между отдельными кластерами занято свободными молекулами воды либо молекулами ряда веществ и ионами солей.
|
|
|
Связывание молекул воды в электрическом поле ионов получило название электростатической гидратации.
Явления электростатической гидратации наблюдаются и с полярными группами органических веществ (между водородом воды и атомами кислорода или азота). Гидратация изменяет свойства воды, особенно это касается первого слоя гидратных оболочек – собственно гидратного слоя (прочно связанная вода), в меньшей мере – одного или нескольких диффузных слоев (рыхло связанная вода).
Гидратация имеет значение в поддержании особого состояния цитоплазмы, ее устойчивости и вместе с тем — лабильности.
В клетке различают свободную и связанную воду:
1. К свободной относят воду, которая по своим свойствам не отличается от чистой воды. Она легко передвигается в клетках и по всему растению, испаряется и участвует во многих метаболических процессах.
|
|
|
2. Связанная вода:
—Осмотически связанная вода гидратирует молекулы и ионы, находящиеся в растворе. Обеспечивает устойчивость растений к низким температурам.
—Коллоидно связанная — гидратирует коллоидные частицы. Является элементом структуры живой растительной клетки. Обеспечивает устойчивость растений к высоким температурам.
Физические свойства воды
1. Вода является универсальным растворителем для полярных веществ: солей, сахаров, спиртов, кислот и др.
2. Высокая удельная теплоемкость. Для разрыва водородных связей, удерживающих молекулы воды, требуется поглотить большое количество энергии. Это свойство обеспечивает поддержание теплового баланса при значительных перепадах температуры в окружающей среде.
3. Высокой теплопроводностью. Это позволяет организму поддерживать одинаковую температуру во всем его объеме.
4. Высокой теплотой парообразования,т.е. ее молекулы способны уносить с собой значительное количество тепла, предотвращая перегрев растений (транспирация).
5. Высокое поверхностное натяжение, что имеет очень важное значение для адсорбционных процессов и передвижения воды.
Функции воды в растении
1. Транспортная. Вода обеспечивает передвижение веществ в клетке и организме, поглощение минеральных веществ из почвы.
2. Метаболическая. Вода является средой для всех биохимических реакций в клетке. Ее молекулы участвуют во многих биохимических реакциях (дыхание, фотосинтез, реакции гидролиза).
3. Структурная. Вода поддерживает конформацию молекул белка, устойчивость структур цитоплазмы и оболочкек клеток в упругом состоянии. Гидратные оболочки, окружающие ионы, ограничивают их взаимодействие.
4. Терморегуляторная. Вода обладает высокой теплоемкостью - 1кал/град, что позволяет растению воспринимать изменения температуры окружающей среды в смягченном виде. Испарение воды растениями - транспирация служит основным средством терморегуляции у растений.
Ферменты
Общая характеристика ферментов.
Важнейшую роль в обмене веществ и трансформации энергии в клетке играют— ферменты, или энзимы, — биологические катализаторы белковой природы (фермент от лат. fermentum — закваска; энзим от греч. эн — внутри, зиме — закваска). Происхождение терминов связано тем, что первоначально ферментативные процессы были открыты и изучены в бродильном производстве.
Ферменты отличаются следующими общими особенностями.
1. По химическому строению молекулы все ферменты являются белками.
2. Большая каталитическая активность, значительно выше, чем у неорганических катализаторов (многие ускоряют реакцию в 109 -1011 ). Ферменты не входят в состав конечных продуктов реакции и не расходуются в процессе катализа.
3. Специфичность действия, под которой понимается способность фермента реагировать только с определенными веществами (субстратами) и действовать только на определенные химические связи;
4. Лабильность т. е. способностью изменять скорость реакции в зависимости от действия ряда внешних и внутренних условий;
5. Регулируемость. Через регуляцию ферментативного аппарата осуществляется скоординированность всех метаболических процессов.
6. Способность работать «в мягких условиях»: невысокая температура, давление, pH близкий к нейтральному.
7. При ферментативных реакциях в отличие от неферментативных наблюдаются лишь незначительные побочные процессы, для ферментативных реакций характерен почти 100% выход продуктов.
Все ферменты по своей химической природе разделяются на две группы:
1. однокомпонешпные (простые) - состоят исключительно из белка;
2. двухкомпонентные (сложные) - кроме белка включают небелковый компанент. Белковая часть двухкомпонентного фермента носит название апофермент. Небелковый компонент, легко диссоциирующий из комплекса с ферментативным белком, называют кофактор (если это неорганическое вещество, например Zn2+, Mg2+ и т.д.) или кофермент (коэнзим) (если это низкомолекулярное органическое вещество: витамины и их производные, никотиновая кислота и др.,).
Если небелковая часть фермента прочно связана с белком и не отсоединяется от него, она называется простетической группой (железо, медь, кобальт, марганец и др.) Металлы могут входить в состав простетических групп в виде особых соединений, например железо в соединении с 4 пиррольными группировками (геминовое железо). Функциями коферментов и простетических групп являются:
I) участие в акте катализа,
2) осуществление контакта между ферментативным белком и субстратом, 3) стабилизация апофермента.
Механизм действия ферментов
1 2 3
АВ+К→АВК→А+ВК→А+В+К
1) образование фермент-субстратного комплекса;
2) преобразование промежуточного соединения в один или несколько активных комплексов;
3) выделение продуктов реакции и регенерация молекулы фермента.
В ходе ферментативных реакций непосредственно участвует только определенная часть ферментативной молекулы, в которой происходит связывание и превращение субстрата - активный центр. В нем условно выделяют каталитическую зону - это совокупность функциональных групп, принимающих непосредственное участиев преобразовании субстрата и группировки, контактирующие с не превращаемыми фрагментами субстрата, и укрепляющие его в активном центре - зона связывания. Активные центры ферментов расположены в углублениях на поверхности ферментативной молекулы. Индивидуальные особенности строения активных центров различных ферментов обусловливают специфичность их действия, которая может быть абсолютной и относительной. В случае абсолютной специфичности ферменты катализируют превращение только одного вещества, в случае относительной — небольшой группы близких по свойствам веществ.
Принцип действия ферментов заключается в снижении энергии активации - энергия, которую необходимо придать молекулам вещества А для превращения их в В, сверх той средней, которую молекулы А уже содержат. Фермент, благодаря созданию фермент-субстратного комплекса, проводит реакцию обходным путем и тем самым снижает энергию активации или энергетический барьер.
Влияние условий на скорость ферментативных реакций
1. Концентрация фермента. Скорость ферментативной реакции прямо пропорциональна концентрации фермента.
2. Концентрация субстрата. При малых количествах субстрата скорость ферментативной реакции пропорциональна его концентрации. С возрастанием концентрации субстрата ход реакции ускоряется все меньше, а затем становится независимой от нее и будет уже определяться концентрацией фермента.
Важной характеристикой любого фермента является константа Михаэлиса, под которой понимается такая концентрация субстрата, при которой скорость ферментативной реакции составляет половину от максимально возможной.
3. Температура. С повышением температуры до определенных значений скорость ферментативной реакции возрастает, затем, достигнув максимальной величины, начинает падать.
Для каждого фермента характерен свой температурный оптимум. Начиная с 50°С и выше скорость ферментативной реакции снижается из-за потери активности фермента вследствие нарушения структуры белка, его денатурации. Большинство ферментов полностью инактивируется при температуре 60°С. При этом восстановление активности с наступлением в последующем оптимальной температуры не происходит в отличие от действия пониженных температур, когда перенесение тканей в условия с благоприятной температурой восстанавливает свойственную ферментам активность. В целом белки-ферменты более устойчивы к температуре, чем структурные белки цитоплазмы.
Встречаются и довольно устойчивые ферменты, например рибонуклеаза или пероксидаза хрена. После промораживания активность ферментов восстанавливается, поэтому в замороженном состоянии можно достаточно долго хранить ферменты вне клетки.
Как всякая химическая реакция, ферментативные реакции зависят от температуры, что принято оценивать величиной температурного коэффициента (Q10), который показывает во сколько раз данный процесс ускоряется при повышении температуры на 10 Со. Для ферментов Q10
4. pH среды. У каждого фермента имеется свой оптимум рН, при котором лучше всего проявляется его активность. Это связано с тем, что рН влияет на заряд функциональных групп фермента, составляющих его активный центр, а от заряда зависит возможность образования фермент-субстратного комплекса. Сдвиг pH среды в любую сторону вызывает снижение активности фермента.
5. Наличие эффекторов - активаторов и ингибиторов. Присоединяясь к активному центру (изостерическая регуляция) или другому участку молекулы фермента - аллостерическму центру (аллостерическая регуляция), они вызывают изменение структуры активного центра, что ведет к ослаблению или усилению активности фермента.
2. Классификация ферментов
В основуклассификации ферментов положена природа химических превращений, тип реакций, катализируемых ферментами. По этим признакам все многообразие ферментов раздельно на шесть классов:
1) оксидоредуктазы – катализирующие окислительно-восстановительные реакции;
2) трансферазы – катализирующие перенос атомных группировок от одного соединения к другому;
3) гидролазы – осуществляющие распад различных органических соединений с участием воды (гидролиз);
4) лиазы – катализирующие присоединения какой-либо атомной группировки к органическим соединениям или отщепляющие от субстратов определенную группу без участия воды;
5) изомеразы – катализирующие внутримолекулярный перенос групп с образованием изомерных форм;
6) лигазы, или синтетазы, – катализирующие синтез органических соединений, происходящий при участии АТФ (с использованием энергии этого соединения).
Ферменты, катализирующие одну и ту же реакцию, встречающиеся у одного вида организмов, но различающиеся по ряду физико-химических свойств (внутренней локализации, электрофоретической подвижности), называют изоферментами. Они различаются по реакции на внешние условия; их максимальная активность проявляется в различных условиях температуры и значений рН. По-видимому, наличие изоферментов позволяет организмам лучше приспосабливаться к меняющимся условиям среды.
3.4 Реализация наследственной информации
на примере биосинтеза белка
1. Понятие о генетической информации. Генетический код и его свойства.
Генетическая информация – это информация о первичной структуре белков, закодированная в виде определенной последовательности нуклеотидов в молекуле ДНК (Рис.5).
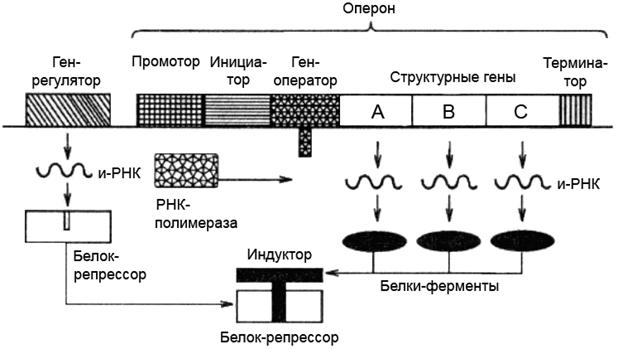
Рисунок 5 – Структура оперона прокариот
А, В, С – цистроны
Функциональный участок ДНК, в котором заключена информация о структуре одного белка, называется цистроном ила структурным геном. Между ними расположены спейсеры (прокладки) - участки, которые не считываются вообще, либо транскрибируются, но затем разрушаются. В ДНК эукариот помимо уникальных последовательностей нуклеотидов, встречающихся, как правило, один раз(большинство структурных генов), присутствует огромное количество повторяющихся последовательностей – повторов. Число повторов колеблется от десятков и сотен (среднечастотные повторы) до 106 на геном (высокочастотные повторы). У высших paстений доля уникальнах участков в геноме часто составляет всего 20 — 30%. Часть повторов необходима для синтеза тРНК, рРНК и гистонов, но большинство повторов необходимо для регуляции экспрессии генов.
Регуляторная зона включает в себя промотор и оператор, благодаря которым осуществляется регуляция транскрипции. Промотор содержит участок первоначального прочного связывания ДНК-зависимой-РНК-полимеразы с ДНК. Оператор — регуляторный участок, который связывается с репрессорами — белками, контролирующими синтез иРНК в соответствии с потребностями клетки. Последовательность нуклеотидов ДНК, ограниченная промотором и терминатором, кодирующая одну молекулу иРНК и контролируемая оператором, называется опероном.
Совокупность всех генов определенного организма представляет геном, который проявляется в совокупности наследственных признаков и свойств особи – генотипе.
Единая система записи наследственной информации в молекулах нуклеиновых кислот в виде последовательности нуклеотидов представляет собой генетический код, посредством которого записана информация о первичной структуре белков.
Свойства генетического кода:
1. Триплетность. Каждая аминокислота кодируется известным сочетанием из трех последовательно расположенных нуклеотидов, которое называется триплетом, или кодоном.
2. Множественность. Одна и та же аминокислота может кодироваться несколькими триплетами (от 2 до 6). Исключение составляют метионин и триптофан. Каждая из этих аминокислот кодируется только одним триплетом (ТАЦ и АЦЦ в ДНК и, соответственно, АУГ и УГГ — в РНК).
3. Однозначность. Каждый триплет кодирует только одну аминокислоту.
4. Неперекрываемость. Один и тот же нуклеотид не может входить одновременно в состав двух соседних триплетов.
5. Непрерывность (без знаков препинания). Если произойдет выпадение одного нуклеотида, то при считывании его место займет ближайший нуклеотид из соседнего кодона, из-за чего изменится весь порядок считывания.
6. Унивесальность. Для всех живых организмов: одинаковые триплеты кодируют одинаковые аминокислоты, что свидетельствует о единстве происхождения всех живых организмов.
Т.о., зная порядок расположения триплетов в молекуле ДНК, можно установить последовательность расположения аминокислот в белке.
2. Биосинтез белка.
Биосинтез белка происходит в два этапа (Рис 6): 1) транскрипция и 2) трансляция.
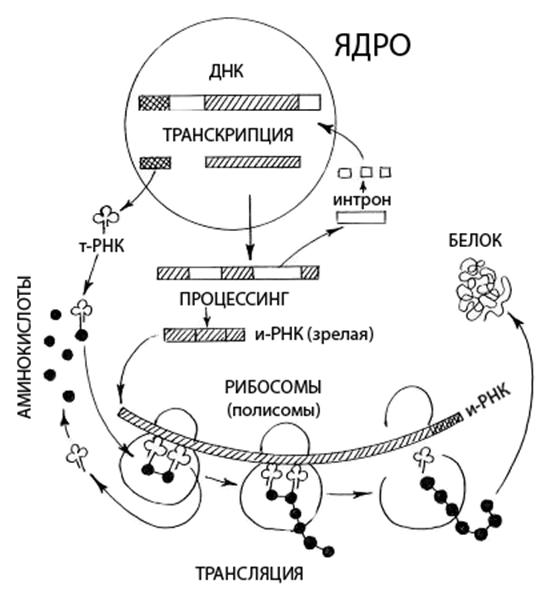
Рисунок 6. – Механизм трансляции
Транскрипция осуществляется в ядре и представляет собой «переписывание» заключенной в ДНК наследственной информации в виде определенной последовательности нуклеотидов молекулы РНК. Процесс транскрипции происходит в интерфазе лишь на части (примерно 10%) активных генов.
Молекула РНК, комплементарная одной из цепей матричной ДНК (транскрибируемая цепь), образуется в ходе сополимеризации четырех рибонуклеозидтрифосфатов (аденин-, гуанозин-, цитозин- и урацилтрифосфата) с образованием 3¢-5¢-фосфодиэфирных связей и освобождением неорганического пирофосфата.
Процесс транскрипции подразделяют на 4 стадии: связывание РНК-полимеразы с ДНК и распознавание промотора, инициация, элонгация и терминация. Предполагается, что после первоначального непрочного связывания с ДНК в случайном месте молекула РНК-полимеразы перемещается вдоль двойной спирали ДНК до тех пор, пока не обнаружит последовательность нуклеотидов промотора. В этом месте связывание молекулы фермента с ДНК становится более прочным. Инициация транскрипции начинается с образования на промоторе предъинициационного комплекса, состоящего из РНК-полимеразы и матричной ДНК. После сборки предъинициационный комплекс претерпевает конформационные изменения, которые сопровождаются расплетением двойной спирали ДНК, и комплекс становится способным к транскрипции. При наличии рибонуклеозидтрифосфатов происходит образование первых фосфодиэфирных связей в молекуле синтезируемой РНК, после чего начинается стадия элонгации, то есть последовательное удлинение синтезируемой молекулы РНК. Стадия элонгации заканчивается после достижения РНК-полимеразой терминатора (стоп-кодона) транскрипции. Затем синтезированная РНК и РНК-полимераза освобождаются из транскрипционного комплекса. Участки ДНК, несущие информацию о строении белка - экзоны, разделены неинформативными интронами. В процессе транскрипции считывается информация как с экзонов, так и с интронов. Образуется предшественник и-РНК, молекулы которой претерпевают созревание – процессинг, сущность которого заключается в вырезании интронов с последующим сплайсингом - объединением экзонов. Через поры в ядре зрелая иРНК переходит в цитоплазму, где осуществляется следующий этап биосинтеза белка.
Трансляция— это перевод информации, заложенной в последовательности нуклеотидов и-РНК, в последовательность аминокислотных остатков полипептидных цепей. В ходе трансляции синтезируются все белки клетки. Перенос аминокислот в цитоплазме к рибосомам осуществляется транспортными РНК (тРНК или 4S-РНК), состоящих из 70-80 нуклеотидов с молекулярной массой 25-30 кД. Они составляют почти 10 % от всей клеточной РНК и растворены в гиалоплазме. Каждой аминокислоте соответствует своя тРНК. Благодаря определенному расположению комплементарных нуклеотидов тРНК образует вторичную структуру, получившей название “клеверного листа”. Рентгеноструктурный анализ позволил установить третичную структуру тРНК. Она оказалась составленной из двух стеблей наподобие латинской буквы L.
Каждая тРНК имеет триплет оснований - антикодон, ответственный за прикрепление к комплементарному кодону иРНК. Для того, чтобы аминокислота присоединилась к тРНК необходима ее активация, которая осуществляется за счет ее реакции с АТФ. Реакция идет при участии фермента аминоацилсинтетазы (кодазы). Образовавшийся аминоациладенилат остается связанным с ферментом и вступает в реакцию с тРНК с образованием аминоацил-тРНК.
Синтез полипептида включает фазы инициации, элонгации и терминации. Процесс начинается с формировании инициаторного комплекса. Промежуточный комплекс инициации образуется путем взаимодействия малой рибосомальной субъединицы (40S) с инициаторной метионил-тРНКмет, которая затем связывается с иРНК (стартовый кодон АУГ). В образовании и стабилизации этого комплекса принимают участие АТФ и несколько белковых факторов (получивших название факторов инициации). Последней к инициаторному комплексу присоединяется большая рибосомальная субъединица (60S) – происходит сборка рибосомы. После этого рибосома перемещается на один кодон. В результате в малую субъединицу входит следующий кодон, кодирующий другую аминокислоту. К этому кодону с помощью антикодона присоединяется вторая тРНК со своей аминокислотой. В рибосоме оказываются две аминокислоты, ориентированные таким образом, что карбоксильная группа первой аминокислоты оказывается рядом с аминогруппой второй аминокислоты. В результате сближения этих групп и с участием фермента большой субъединицы рибосомы пептидилтрансферазы аминокислоты соединяются пептидной связью. Образовавшийся дипептид присоединен ко второй тРНК, а первая тРНК освобождается и уходит в цитоплазму. В результате дипептид со второй тРНК оказывается связанным с большой субъединицей рибосомы, а рибосома перемещается еще на один кодон. Присоединение аминокислотных остатков – элонгация протекает до тех пор, пока в малую субъединицу не попадет один из терминирующих кодонов иРНК (УАА, УАГ, УГА) – терминация. После этого большая и малая субъединицы расходятся, молекула белка приобретает свойственную ей структуру, иРНК распадается на отдельные нуклеотиды. Большое значение имеет объединение рибосом в цепочки - полисомы. В этом случае одна молекула иРНК может последовательно присоединяться к ним и служить матрицей для синтеза нескольких одинаковых молекул белка. Синтез белковой молекулы идет с большой скоростью и поэтому время жизни иРНК невелико (от нескольких секунд до 1-2 минут). Однако, на определенных фазах развития растений (например, в набухающих и прорастающих семенах) синтезируются так называемые долгоживущие молекулы иРНК.
3.5 Функции и свойства цитоплазмы
Физико-химические свойства цитоплазмы
Основными свойствами цитоплазмы являются вязкость, эластичность, движение, избирательная проницаемость, возбудимость. Они обусловливаются спецификой ее структуры — наличием микрофиламентов и пограничных мембранных слоев.
Вязкость — это способность цитоплазмы оказывать сопротивление движению частиц (ионы, молекулы, органеллы). Вязкость цитоплазмы обусловливается ее физико-химическим состоянием (золя, геля), в основе которого лежит взаимодействие между микрофиламентами. В среднем, вязкость цитоплазмы в 18-25 раз выше вязкости воды.
На разных этапах развития растений степень вязкости цитоплазмы их клеток изменяется. Этот показатель в фазе деления клетки довольно высок, в фазе растяжения он снижается в результате сильного оводнения цитоплазмы, при дифференцировке клетки снова возрастает вследствие оттока воды из коллоидов цитоплазмы в вакуоль. Степень вязкости цитоплазмы клеток различных органов зависит от их возраста. В молодом листе она очень высокая, но по мере развития листа снижается, а в полностью сформированном листе вновь возрастает. Изменение степени вязкости цитоплазмы в онтогенезе органа отражает изменение ее в онтогенезе клетки. В онтогенезе растения вязкость цитоплазмы возрастает к периоду бутонизации, к моменту цветения снижается, а после его завершения снова увеличивается. Высокая степень вязкости цитоплазмы характерна для клеток покоящихся органов (семена, луковицы, клубни).
Вязкость цитоплазмы влияет на активность метаболических процессов в клетке. При ее снижении обмен веществ активизируется, при повышении подавляется, поэтому при активном росте и цветении вязкость цитоплазмы невелика, а в состоянии покоя при обезвоживании организма возрастает.
Степень вязкости цитоплазмы зависит и от видовой принадлежности растений, т.е. от их генотипа, определяющего специфичность структуры белков микрофиламентов.
Вязкость цитоплазмы обусловливается также характером экотипа растения. У ксерофитов она высокая, у мезофитов — несколько ниже, а у водных растений — лишь незначительно превышает вязкость воды. Чем выше вязкость цитоплазмы, тем лучше растения противостоят обезвоживанию и меньше подвергаются деформирующим воздействиям, связанным с потерей воды.
На вязкость цитоплазмы влияют также и внешние факторы. При низкой температуре тепловое движение микрофиламентов замедляется. Это способствует стабилизации их молекулярной сети и повышению вязкости цитоплазмы. При повышении температуры сеть микрофиламентов разрушается и цитоплазма переходит в разжиженное состояние. При 35—40 °С и выше вязкость цитоплазмы увеличивается вследствие обезвоживания и коагуляции белков.
Вязкость цитоплазмы зависит и от присутствия в среде тех или иных катионов: одновалентные катионы (К+, N+, Li+) снижают ее, двух- и трехвалентные (Са2+, Mg2+, А13+) — повышают.
Эластичность — это способность цитоплазмы восстанавливать свою форму после деформации. Обусловливается упругостью микрофиламентов, а также способностью клеточной мембраны менять размеры своей поверхности за счет быстрой разборки и последующей самосборки отдельных участков (например, при плазмолизе). Эластичность цитоплазмы имеет приспособительное значение. Так, у ксерофитов она приблизительно в 3 раза выше, чем у мезофитов, что позволяет первым переносить длительное обезвоживание без существенных повреждений цитоплазмы.
Движение цитоплазмы свойственно практически всем живым активно функционирующим клеткам. В зависимости от строения клетки существует несколько видов движения цитоплазмы. Наиболее распространенных — ротационное (циклоз) и циркуляционное.
Циклоз свойствен клеткам, имеющим крупную центральную вакуоль. Циркуляционное движение присуще цитоплазме клеток, имеющих несколько крупных вакуолей.
В основе движения цитоплазмы лежит волнообразное сокращение микрофиламентов, происходящее в результате химического взаимодействия их белков — актина и миозина с использованием энергии АТФ.
Движение цитоплазмы активизирует превращение метаболитов и тем самым ускоряет обмен веществ и энергии в клетке. При недостатке АТФ либо нарушения структуры микрофиламентов движение цитоплазмы замедляется, а иногда и полностью останавливается.
Скорость движения цитоплазмы зависит также от внешних факторов. При повышении температуры до верхней предельной для каждого вида границы вязкость цитоплазмы снижается и движение ее ускоряется. Одновалентные ионы (К+, Na+) обводняют и разжижают цитоплазму, ускоряя тем самым ее движение, двухвалентные (Са2+, Mg2+), наоборот, замедляют и даже останавливают его. Соли меди, свинца и других тяжелых металлов, вначале ускоряют движение цитоплазмы, а затем снижают его или даже полностью подавляют, что приводит к гибели клетки.
Скорость движения цитоплазмы увеличивается под действием факторов, способствующих образованию АТФ в ходе фотосинтеза или дыхания, а именно — освещения и кислорода.
Избирательная проницаемость, т. е. способность цитоплазмы пропускать различные вещества с неодинаковой скоростью, обусловливается наличием в ней пограничных мембранных слоев, несущих тот или иной набор специфических транспортных белков. Избирательная проницаемость свойственна только живой цитоплазме. При высокой температуре, действии кислот, щелочей, растворителей липидов, вследствие коагуляции белковых компонентов мембран или вымывания их липидного матрикса она теряет это свойство и беспрепятственно пропускает вещества. Проницаемость цитоплазмы увеличивается при повышении температуры и освещения, при водном дефиците, а также при старении клетки — в результате нарушения естественной структуры мембран.
Раздражимость — это способность клетки реагировать на действие внешних и внутренних факторов – раздражителей и передавать возбуждение в другие клетки. В основе раздражимости лежит местная электрическая реакция, связанная с изменением мембранного потенциала. Возбуждение представляет собой измененное состояние клетки. В отсутствие раздражения растительная клетка имеет отрицательный потенциал покоя от -50 до -200 мВ, то есть протопласт заряжен отрицательно по отношению к наружной поверхности. Это связано с тем, что внутри клетки находится больше ионов хлора, но меньше ионов кальция, чем снаружи. В ответ на раздражение возникает потенциал противоположного знака – потенциал действия, который может распространяться и на время сравняться или превысить потенциал покоя. Потенциал действия образуется в результате выхода ионов хлора из клетки и поступления ионов кальция в клетку.
Раздражение воспринимается клеткой, если его сила превышает пороговую величину. Следующие друг за другом подпороговые раздражения могут суммироваться, если интервалы между ними незначительны. Раздражение в виде электрических импульсов передается по сети плазмодесм и проводящих пучков, что обеспечивает согласованность реакций растительного организма на внешние воздействия.
Раздражимость связана с затратами энергии АТФ. Поэтому факторы, подавляющие ее синтез (понижение температуры, недостаток кислорода, яды и др.), снижают способность цитоплазмы к восприятию раздражения.
При действии чрезмерно сильных и длительных раздражителей чувствительность клеток снижается и они могут погибнуть.
Дата добавления: 2018-02-28; просмотров: 1302; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
