Тема 5.4 Неорганические соединения. Классификация
Основные понятия и термины по теме: Кислоты, основания, соли, оксиды Их классификация, химические свойства в свете теории электролитической диссоциации, основные способы получения. Гидролиз солей.
План изучения темы (перечень вопросов, обязательных к изучению):
1. Кислоты.
2. Основания.
3. Соли.
4. Оксиды.
Краткое изложение теоретических вопросов:
1.Кислоты — это электролиты, которые при электролитической диссоциации образуют положительные ионы водорода и отрицательные ионы кислотных остатков. Классификация кислот: кислородосодержащие(H2SO4), бескислородные(HCl), одноосновные(HCl), двухосновные(H2SO4), трехосновные(H3PO4), растворимые и нерастворимые(H2SiO3), летучие и нелетучие, сильные и слабые. Химические свойства: металл, оксид металла, гидроксид металла, соль, индикатор.
2.Основ а ния, химические соединения, содержащие гидроксильную группу OH и способные диссоциировать в водном растворе с образованием гидроксильных ионов OH—. По степени диссоциации различают слабые основания, например NH4OH, и сильные основания, например NaOH, Ca (OH)2, хорошо растворимые в воде основания называются щелочами. Химические свойства щелочей: кислотный оксид, кислота, соль, амотерый оксид и гидроксид.
3.Соли — класс химических соединений, к которому относятся вещества, состоящие из катионов металла (или катионов аммония 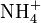 ; известны соли фосфония
; известны соли фосфония 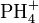 или гидроксония
или гидроксония 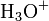 ) и анионов кислотного остатка. Соли, образованные сильным основанием и сильной кислотой (NaCl, KCl, Ba(NO3)2, Na2SO4 и др.), гидролизу в растворе не подвергаются, т.к. не образуется слабодиссоциированных соединений (катионы сильных оснований и анионы сильных кислот не могут связывать ионы воды). Реакция растворов этих солей остается практически нейтральной, рН = 7.
) и анионов кислотного остатка. Соли, образованные сильным основанием и сильной кислотой (NaCl, KCl, Ba(NO3)2, Na2SO4 и др.), гидролизу в растворе не подвергаются, т.к. не образуется слабодиссоциированных соединений (катионы сильных оснований и анионы сильных кислот не могут связывать ионы воды). Реакция растворов этих солей остается практически нейтральной, рН = 7.
|
|
|
Гидролизу подвергаются соли, образованные: а) сильным основанием и слабой кислотой; б) сильной кислотой и слабым основанием; в) слабым основанием и слабой кислотой.
а)Гидролиз солей, образованных сильным основанием и слабой кислотой протекает всегда по аниону, заряд которого определяет число теоретических ступеней гидролиза. Реакция среды их водныз растворов - щелочная (рН > 7).
б)Гидролиз солей, образованных сильной кислотой и слабым основанием протекает всегда по катиону, заряд которого определяет число теоретических ступений гидролиза. Реакция среды их водных растворов кислая (рН < 7).
в) Гидролиз солей, образованных слабым основанием и слабой кислотой протекает одновременно по катиону и по аниону, образуя сразу два слабых электролита. Химические свойства: щелочь, кислота, соль,металлы.
4.Оксид — бинарное соединение химического элемента с кислородом в степени окисления −2. Классификация: несолеобразующие(N2O, NO,CO), солеобразующие(основные, кислотные, амфотерные). Основные оксиды- это оксиды металлов со степенью окисления +1и+2.Они взаимодействуют с водой, кислотами, кислотными оксидами. Кислотные оксиды- это оксиды неметаллов и оксиды металлов со степенью окисления более +4.Они взаимодействуют с водой, щелочами, оксидами металлов. Амфотерные оксиды- это оксиды металлов со степенью окисления +3(ZnO,BeO).Взаимодействуют с кислотами, щелочами, основными и кислотными оксидами.
|
|
|
Лабораторные работы: не предусмотрены.
Дата добавления: 2015-12-21; просмотров: 18; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
