Сборка полипептидной цепи на рибосоме
Синтез полипептиднои цепи на рибосоме Показаны также транскрипция мРНК и ее перенос через ядерную мембрану в цитоплазму клетки.
Следующий кодон мРНК, расположенный вслед за АУГ-инициирующим кодоном, попадает в А-участок большой субъединицы рибосомы, где он «подставляется» для взаимодействия с амино-ацил-тРНК, имеющей соответствующий антикодон. После того как подходящая тРНК связалась с кодоном мРНК, находящимся в А-участке, происходит образование пептидной связи с помощью пептидилтрансферазы, входящей в состав большой субъединицы рибосомы, и аминоацил-тРНК превращается в пептидил-тРНК. Это заставляет рибосому продвинуться на один кодон, переместить образованную пептидил-тРНК в Р-участок и освободить А-участок, который занимает следующий по порядку кодон мРНК, готовый к соединению с аминоацил-тРНК, имеющей подходящий антикодон (рис. 3.10).
Происходит рост полипептидной цепи за счет многократного повторения описанного процесса. Рибосома движется вдоль мРНК, высвобождая ее инициирующий участок. На инициирующем участке происходит сборка следующего активного рибосомного комплекса и начинается синтез новой полипептидной цепи. Таким образом к одной молекуле мРНК может присоединиться несколько активных рибосом с образованием полисомы. Синтез полипептида продолжается до тех пор, пока в А-участке не окажется один из трех стоп-кодонов. Стоп-кодон распознается специализированным белком терминации, который прекращает синтез и способствует отделению полипептидной цепи от рибосомы и от мРНК.
|
|
|
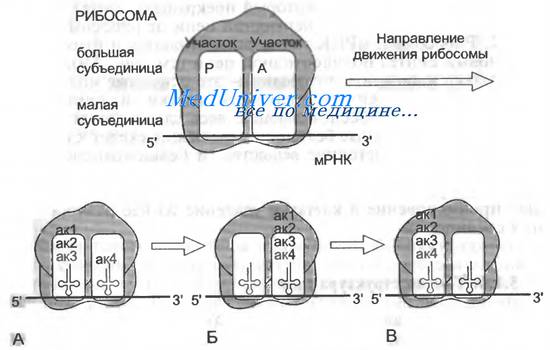
Рис. 3.10. Синтез полипептидной цепи на рибосоме. Детализованная схема присоединения к растущей полипептидной цепи новой аминокислоты и участие в этом процессе участков А и Р большой субъединицы рибосомы.
Рибосома и мРНК также разъединяются и готовы начать новый синтез полипептидной цепи (см. рис. 3.9). Остается только напомнить, что белки — это основные молекулы, обеспечивающие жизнедеятельность клетки и организма. Они и ферменты, обеспечивающие весь сложнейший обмен веществ, и структурные белки, составляющие скелет клетки и образующие межклеточное вещество, и белки-транспортеры многих веществ в организме, как, например, гемоглобин, транспортирующий кислород и белки-каналы, обеспечивающие проникновение в клетку и удаление из нее разнообразных соединений.
66 особенности синтеза и процессинга секретируемых белков(коллаген и инсулина)
Согласно современным представлениям, биосинтез инсулина осуществляется в β-клетках панкреатических островков из своего предшественника проинсулина, впервые выделенного Д. Стайнером в 1966 г. В настоящее время не только выяснена первичная структура проинсулина, но и осуществлен его химический синтез (см. рис. 1.14). Проинсулин представлен одной полипептидной цепью, содержащей 84 аминокислотных остатка; он лишен биологической, т.е. гормональной, активности. Местом синтеза проинсули-на считается фракция микросом β-клеток панкреатических островков; превращение неактивного проинсулина в активный инсулин (наиболее существенная часть синтеза) происходит при перемещении проинсулина от рибосом к секреторным гранулам путем частичного протеолиза (отщепление с С-конца полипептидной цепи пептида, содержащего 33 аминокислотных остатка и получившего наименование соединяющего пептида, или С-пепти-да). Длина и первичная структура С-пептида подвержена большим изменениям у разных видов животных, чем последовательность цепей А и В инсулина. Установлено, что исходным предшественником инсулина является препроинсулин, содержащий, помимо проинсулина, его так называемую лидерную, или сигнальную, последовательность на N-конце, состоящую из 23 остатков аминокислот; при образовании молекулы проинсулина этот сигнальный пептид отщепляется специальной пептидазой. Далее молекула проинсулина также подвергается частичному протеолизу, и под действием трипсиноподобной протеиназы отщепляются по две основные аминокислоты с N- и С-конца пептида С – соответственно дипептиды Aрг–Aрг и Лиз– –Aрг (см. рис. 1.14). Однако природа ферментов и тонкие механизмы этого важного биологического процесса – образование активной молекулы инсулина окончательно не выяснены.
|
|
|
|
|
|
Синтезированный из проинсулина инсулин может существовать в нескольких формах, различающихся по биологическим, иммунологическим и физико-химическим свойствам. Различают две формы инсулина: 1) свободную, вступающую во взаимодействие с антителами, полученными к кристаллическому инсулину, и стимулирующую усвоение глюкозы мышечной и жировой тканями; 2) связанную, не реагирующую с антителами и активную только в отношении жировой ткани. В настоящее время доказано существование связанной формы инсулина и установлена локализация ее в белковых фракциях сыворотки крови, в частности в области трансферринов и α-глобулинов. Молекулярная масса связанного инсулина от 60000 до 100000. Различают, кроме того, так называемую форму А инсулина, отличающуюся от двух предыдущих рядом физико-химических и биологических свойств, занимающую промежуточное положение и появляющуюся в ответ на быструю, срочную потребность организма в инсулине.
|
|
|
В физиологической регуляции синтеза инсулина доминирующую роль играет концентрация глюкозы в крови. Так, повышение содержания глюкозы в крови вызывает увеличение секреции инсулина в панкреатических островках, а снижение ее содержания, наоборот,– замедление секреции инсулина. Этот феномен контроля по типу обратной связи рассматривается как один из важнейших механизмов регуляции содержания глюкозы в крови. На секрецию инсулина оказывают влияние, кроме того, электролиты (особенно ионы кальция), аминокислоты, глюкагон и секретин. Приводятся доказательства роли циклазной системы в секреции инсулина. Предполагают, что глюкоза действует в качестве сигнала для активирования аденилат-циклазы, а образовавшийся в этой системе цАМФ – в качестве сигнала для секреции инсулина.
При недостаточной секреции (точнее, недостаточном синтезе) инсулина развивается специфическое заболевание – сахарный диабет (см. главу 10). Помимо клинически выявляемых симптомов (полиурия, полидипсия и полифагия), сахарный диабет характеризуется рядом специфических нарушений процессов обмена. Так, у больных развиваются гипергликемия (увеличение уровня глюкозы в крови) и гликозурия (выделение глюкозы с мочой, в которой в норме она отсутствует). К расстройствам обмена относят также усиленный распад гликогена в печени и мышцах, замедление биосинтеза белков и жиров, снижение скорости окисления глюкозы в тканях, развитие отрицательного азотистого баланса, увеличение содержания холестерина и других липидов в крови. При диабете усиливаются мобилизация жиров из депо, синтез углеводов из аминокислот (глюконеогенез) и избыточный синтез кетоновых тел (кетонурия). После введения больным инсулина все перечисленные нарушения, как правило, исчезают, однако действие гормона ограничено во времени, поэтому необходимо вводить его постоянно. Клинические симптомы и метаболические нарушения при сахарном диабете могут быть объяснены не только отсутствием синтеза инсулина. Получены доказательства, что при второй форме сахарного диабета, так называемой инсулинрезистентной, имеют место и молекулярные дефекты: в частности, нарушение структуры инсулина или нарушение ферментативного превращения проинсулина в инсулин. В основе развития этой формы диабета часто лежит потеря рецепторами клеток-мишеней способности соединяться с молекулой инсулина, синтез которого нарушен, или синтез мутантного рецептора (см. далее).
У экспериментальных животных введение инсулина вызывает гипогликемию (снижение уровня глюкозы в крови), увеличение запасов гликогена в мышцах, усиление анаболических процессов, повышение скорости утилизации глюкозы в тканях. Кроме того, инсулин оказывает опосредованное влияние на водный и минеральный обмен.
Механизм действия инсулина окончательно не расшифрован, несмотря на огромное количество фактических данных, свидетельствующих о существовании тесной и прямой зависимости между инсулином и процессами обмена веществ в организме. В соответствии с «унитарной» теорией все эффекты инсулина вызваны его влиянием на обмен глюкозы через фермент гексокиназу. Новые экспериментальные данные свидетельствуют, что усиление и стимуляция инсулином таких процессов, как транспорт ионов и аминокислот, трансляция и синтез белка, экспрессия генов и др., являются независимыми. Это послужило основанием для предположения о множественных механизмах действия инсулина.
Наиболее вероятной в настоящее время представляется мембранная локализация первичного действия почти всех белковых гормонов, включая инсулин. Получены доказательства существования специфического рецептора инсулина на внешней плазматической мембране почти всех клеток организма, а также образования инсулинрецепторного комплекса. Рецептор синтезируется в виде предшественника – полипептида (1382 аминокислотных остатка, мол. масса 190000), который далее расщепляется на α-и β-субъединицы, т.е. на гетеродимер (в формуле α2–β2), связанные дисульфидными связями. Оказалось, что если α-субъединицы (мол. масса 135000) почти целиком располагаются на внешней стороне биомембраны, выполняя функцию связывания инсулина клетки, то β-субъединицы (мол. масса 95000) представляют собой трансмембранный белок, выполняющий функцию преобразования сигнала (рис. 8.1). Концентрация рецепторов инсулина на поверхности достигает 20000 на клетку, и период их полужизни составляет 7–12 ч.
Самым интересным свойством рецептора инсулина, отличным от всех других рецепторов гормонов белковой и пептидной природы, является его способность аутофосфорилирования, т.е. когда рецептор наделен сам протеинкиназной (тирозинкиназной) активностью. При связывании инсулина с α-цепями рецептора происходит активирование тирозинкиназной активности β-цепей путем фосфорилирования их тирозиновых остатков. В свою очередь активная тирозинкиназа β-цепей запускает каскад фосфо-рилирования–дефосфорилирования протеинкиназ, в частности мембранных или цитозольных серин- или треонинкиназ, т.е. протеинкиназ и белков-мишеней, фосфорилирование в которых осуществляется за счет ОН-групп серина и треонина. Соответственно имеют место изменения клеточной активности, в частности активация и ингибирование ферментов, транспорт глюкозы, синтез полимерных молекул нуклеиновых кислот и белков и т.д. Следует подчеркнуть, однако, что тонкие молекулярные механизмы путей передачи сигнала от инсулинрецепторного комплекса на множество внутриклеточных процессов пока не раскрыты. Вполне возможно участие в подобных процессах ряда внутриклеточных вторичных мессенджеров, в частности циклических нуклеотидов, производных фосфатидилинозитолов и др. Нельзя исключить, кроме того, возможности существования внутриклеточного посредника или медиатора действия инсулина (особого внутриклеточного рецептора), контролирующего транскрипцию генов и соответственно синтез мРНК. Предполагают, что действием инсулина и участием в регуляции экспрессии генов или в транскрипции специфических мРНК может быть объяснена его роль в таких фундаментальных процессах жизнедеятельности, как эмбриогенез и дифференцировка клеток высших организмов.
Биосинтез коллагена
Предшественник коллагена (препропептид) синтезируется на рибосомах на поверхности гранул ШЭР. Прежде чем превратиться в зрелую форму белок-предшественник подвергается значительной посттрансляционной модификации в эндоплазматическом ретикулуме и аппарате Гольджи (см. рис. 225). Отщепление сигнального пептида (1) приводит к образованию проколлагена. Молекула проколлагена все еще несет на одном конце длинный пропептид. Далее следует гидроксилирование многих остатков пролина и ряда остатков лизина (2). Некоторые остатки гидроксилизина дополнительно гликозилируются (3). Окисление остатков цистеина приводит к образованию внутри- и межмолекулярных дисульфидных связей (4), которые обеспечивают правильное скручивание полипептидных цепей в тройную спираль (5). Прежде чем секретироваться в межклеточное пространство, молекула проколлагена должна пройти стадии модификации и правильной сборки. В процессе транспорта через плазматическую мембрану отщепляются N- и С-концевые пропептиды (6). Коллаген выходит из клетки и в результате ступенчатой сборки образует микрофибриллы (7). Наконец, ε-аминогруппы некоторых остатков лизина подвергаются ферментативному окислению с образованием альдегидных групп (8). Последний этап — конденсация (9) с образованием внутри- и межмолекулярных поперечных связей, в результате чего фибриллы коллагена приобретают окончательную структуру, характеризующуюся прочностью на разрыв и высокой устойчивостъю к действию протеиназ.
В организме коллагены выполняют разнообразные биологические функции (см. с. 336). О важной роли коллагенов убедительно свидетельствует множество наследственных генетических дефектов, связанных с мутациями в молекулах коллагенов или ферментов, принимающих участие в их биосинтезе. Такие дефекты могут оказывать влияние на структуру и функцию цитоскелета, связок, сухожилий, кожи, глаз, кровеносных сосудов, волос и даже размеров тела (примером служит синдром Элера-Данлоса).
Гидроксилирование остатков пролина и лизина в молекуле проколлагена катализируется проколлаген-гидроксилазами, имеющими в активном центре атомы железа. В качестве кофермента используется аскорбат (витамин С, см. с. 356). Симптомы дефицита витамина С, такие, как выпадение зубов, кровоточивость десен или повреждения кожи (цинга), объясняются нарушением биосинтеза коллагенов.
Клетки мишени
Клетка-Мишень - (в гематологии) аномальная красная клетка крови (эритроцит), внутри которой при окрашивании образца крови наблюдаются сменяющие друг друга темные и светлые кольца. Существование клеток-мишеней в крови наблюдается при некоторых видах анемий, в том числе и при железодефицитной анемии, заболеваниях печени и нарушениях в структуре гемоглобина.
G-белки (англ. G proteins) — это семейство белков, относящихся к ГТФазам и функционирующих в качестве вторичных посредников во внутриклеточных сигнальных каскадах. G-белки названы так, поскольку в своём сигнальном механизме они используют замену GDP на GTP как молекулярный функциональный «выключатель» для регулировки клеточных процессов.
ипы G-белков
G-белки делятся на две основных группы — гетеротримерные («большие») и «малые». Гетеротримерные G-белки — это белки с четвертичной структурой, состоящие из трёх субъединиц: альфа(α), бета (β) и гамма (γ). Малые G-белки — это белки из одной полипептидной цепи, они имеют молекулярную массу 20—25 кДа и относятся к суперсемейству Ras малых ГТФаз. Их единственная полипептидная цепь гомологична α-субъединице гетеротримерных G-белков. Обе группы G-белков участвуют во внутриклеточной сигнализации.
[править]
Гетеротримерные G-белки
У всех гетеротримерных G-белков сходный механизм активации: они активируются при взаимодействии со специфическими рецепторами, сопряженными с G-белками, при этом обменивая ГДФ на ГТФ и распадаясь на α- и βγ-субъединицы. α-субъединица, связанная с ГТФ, воздействует на следующее звено в цепи передачи сигнала. βγ-субъединица также может вызывать собственные эффекты. Инактивация G-белков происходит в результате медленного гидролиза ГТФ до ГДФ α-субъединицей, после чего происходит реассоциация (объединение) субъединиц.
[править]
Белки-помощники G-белков
В работе многих G-белков участвуют вспомогательные белки. GAPs (GTPase Activating Proteins, белки-активаторы ГТФазной активности) ускоряют гидролиз ГТФ, ускоряя инактивацию G-белков. Особенно важна функция GAPs для малых G-белков, так как альфа-субъединицы гетеротримерных G-белков часто сами обладают достаточной ГТФ-азной активностью. К GAP-белкам относятся белки семейства RGS.
GEFs (Guanine nucleotide Exchange Factors, факторы обмена гуаниловых нуклеотидов), ускоряют обмен ГДФ на ГТФ и таким образом активируют G-белки. Обычно для G-белка GEF-ом служит активированный лигандом рецептор, однако в некоторых случаях белки AGS (Activator of G-protein Signaling, активаторы передачи сигнала G-белками) могут активировать G-белок независимо от воздействия на него рецептора.
68-
69-
Дата добавления: 2016-01-05; просмотров: 122; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
