Первичная структура нуклеиновых кислот
Под первичной структурой нуклеиновых кислот понимают порядок, последовательность расположения мононуклеотидов в полинуклеотидной цепи ДНК и РНК. Такая цепь стабилизируется 3',5'-фосфодиэфирными связями. Поскольку молекулярная масса нуклеиновых кислот колеблется в широких пределах (от 2•104 до 1010–1011), установить первичную структуру всех известных РНК и особенно ДНК весьма сложно. Тем не менее во всех нуклеиновых кислотах (точнее, в одноцепочечной нуклеиновой кислоте) имеется один и тот же тип связи – 3',5'-фосфодиэфирная связь между соседними нуклеотидами. Эту общую основу структуры можно представить следующим образом:
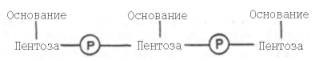
Установлено, что в образовании межнуклеотидной связи участвуют гидроксильные группы в 3'- и 5'-положениях остатков углевода.
К настоящему времени удалось определить первичную структуру почти всех тРНК, ряда молекул 5S рРНК, 16S рРНК E.coli, вирусных РНК, в состав которых входят сотни и тысячи нуклеотидных остатков. Ниже приводится примерная схема последовательности нуклеотидов в молекуле РНК. Все клеточные РНК в основном состоят из одноцепочечной по-линуклеотидной цепи:
5'-Г–У–Г–Ц–А–А–...–У–Ц–Г–Ц–Ц–А–3'
Полинуклеотидная цепь молекулы РНК имеет на одном конце почти всегда свободный монофосфорный эфир, который принято обозначать как 5'-конец; на противоположном конце цепи такой фосфат отсутствует, а содержится нуклеотид со свободными 2'- и 3'-гидроксильными группами. Если подвергнуть щелочному гидролизу молекулу РНК, то в качестве концевого нуклеотида будут обнаружены ЦМФ со свободным фосфатом у 5'-конца и свободный аденозин в виде свободного нуклеозида у 3'-конца полинуклеотидной цепи.
|
|
|
В выяснении первичной структуры РНК решающую роль сыграли методы ступенчатого гидролиза, осуществленного в основном экзонуклеа-зами и заключающегося в последовательном отщеплении по одному мононуклеотиду с одного конца молекулы нуклеиновой кислоты. Ниже представлена первичная структура первой РНК, имеющей 77 нуклеотидов, для которой была расшифрована нуклеотидная последовательность в 1965 г. Р. Холли и сотр., а именно аланиновой тРНК:
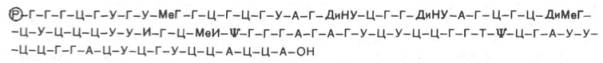
В этой структуре Р – остаток фосфата, ψ – псевдоУМФ, МеГ – метилгуа-нин, ДиНУ – дигидроурацил, ДиМеГ – диметилгуанин, МеИ – метилинозин.
Следует особо указать на две существенные особенности первичной структуры всех тРНК. Первая из них заключается в том, что 5'-концом всегда является гуаниловая (редко цитидиловая) кислота, несущая свободный остаток фосфата у С-5'. Вторая особенность – наличие на противоположном конце молекулы остатков трех мононуклеотидов с одинаковой последовательностью – ЦЦА, причем остаток адениловой кислоты содержит свободную 3'-ОН-группу.
|
|
|
Между этими структурами в строго определенной последовательности располагаются все остальные нуклеотидные остатки, среди которых на долю минорных нуклеотидов приходится до 10%. Полинуклеотидная цепь разных типов тРНК содержит около 75 нуклеотидов.
Матричные (информационные) РНК относятся к наиболее гетерогенному классу нуклеиновых кислот, отличающихся по массе (см. табл. 3.1), структуре, размерам, стабильности и функциям. Основной функцией мРНК является перенос информации от ДНК (точнее, от гена) на белоксинте-зирующую систему клетки. мРНК выполняет роль матрицы и, следовательно, определяет первичную структуру синтезируемого белка (подробнее см. главу 14). мРНК наделены рядом особенностей первичной структуры; в частности, на 5'-конце все они содержат определенную последовательность рибонуклеотидов, получившую название шапочки (кэп). Первым нуклеотидом является 7-метилгуанозинтрифосфат, который присоединяется к 5'-гидроксилу соседнего мононуклеотида, представленного 2'-О-метилпуриновым нуклеотидом. На другом 3'-конце большинства (но не всех) мРНК содержится полиадениловая последовательность (поли-А), насчитывающая от 150 до 200 нуклеотидов.
|
|
|
Роль «кэпирования» и «полиаденилирования» мРНК в белковом синтезе окончательно не выяснена. Предполагают, что кэп необходим для специфического узнавания в процессе трансляции, в то время как поли-А отводится роль фактора стабилизации всей молекулы мРНК.
В последние годы расшифрована первичная структура не только низкомолекулярных 5S рРНК разных бактерий и 5,8S рРНК клеток животных, но и высокомолекулярных 16S и 18S рРНК, насчитывающих до 1200–1500 нуклеотидных звеньев. Более того, уже выяснены нуклеотидные последовательности 23S рРНК E.coli и 25S рРНК дрожжевой клетки, а также первичные структуры высокомолекулярных (28S) рРНК клеток эукариот, насчитывающих около 4700 нуклеотидов.
В настоящее время проводятся исследования первичных структур различных молекул ДНК. Около 15 лет назад была полностью расшифрована нуклеотидная последовательность митохондриальной ДНК человека (16569 пар нуклеотидов). Известны полные нуклеотидные последовательности ДНК ряда вирусов и плазмид. Совсем недавно завершено определение нуклеотидных последовательностей геномов двух прокариотических организмов (Haemophilus influenzae и Mycoplasma genitalum) и появились сообщения о расшифровке генома первого эукариотического организма – дрожжей. Близки к завершению аналогичные исследования генома E.coli и генома нематоды Caenorhabditis elegans. Исследователи активно работают над полной расшифровкой генома человека.
|
|
|
Результаты секвенирования (определение нуклеотидной последовательности) разных молекул ДНК накапливаются в виде компьютерных банков данных, которые уже доступны для пользователей международных компьютерных сетей (например, «Internet»). Ниже представлены три варианта схемы нуклеотидной последовательности ДНК:
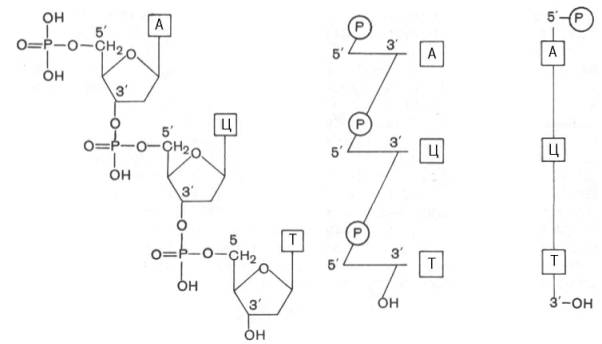
В последнее время о первичной структуре ДНК (точнее, отдельных ее фрагментов) судят по ряду косвенных данных, например, по степени сплоченности нуклеотидных звеньев в молекуле ДНК (определение сводится в конечном счете к выяснению числа и структуры отдельных фракций нуклеотидов, так называемых изоплитов), также по кинетике реассоциации ДНК (метод позволяет выяснить наличие в молекуле повторяющихся последовательностей нуклеотидов). О первичной структуре ДНК судят, кроме того, по распределению минорных оснований (имеются данные о существовании подобной закономерности) и обнаружению в ДНК и определению последовательности палиндромов («обратно бегущие» последовательности, или перевертыши), которые обнаруживаются главным образом в местах рестрикции (см. главу 13). Большие надежды в определении первичной структуры ДНК исследователи возлагают на физические, химические (синтез генов), генетические и другие методы, а также на методы выделения некоторых генов (или их фрагментов) из природных источников и синтеза генов на мРНК при участии фермента обратной транскриптазы. Для установления первичной структуры ДНК недавно предложен экспресс-метод, включающий применение двух ДНК-полимераз (из E.coli и из бактериофага Т4). Однако во всех этих случаях определяется структура небольшого участка ДНК, поэтому полная расшифровка первичной структуры ДНК генома человека ждет своего решения.
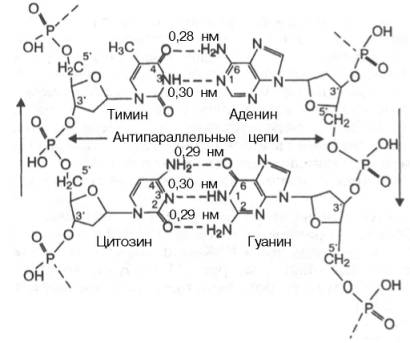
В соответствии с моделью Дж. Уотсона и Ф. Крика, предложенной в 1953 г. на основании ряда аналитических данных, а также рентгеноструктурного анализа молекула ДНК состоит из двух цепей, образуя правовращающую спираль, в которую обе полинуклеотидные цепи закручены вокруг одной и той же оси. Удерживаются цепи благодаря водородным связям, образующимся между их азотистыми основаниями (рис. 3.1). Обе цепи поли-нуклеотидов в биспиральной молекуле ДНК имеют строго определенное пространственное расположение, при котором азотистые основания находятся внутри, а фосфорильные и углеводные компоненты – снаружи.
Детальный анализ всевозможных вариантов образования водородных связей между основаниями показал, что в биспиральной молекуле ДНК основания уложены парами: пурин из одной цепи и пиримидин из другой в соответствии с правилами Чаргаффа. Поскольку ориентация оснований на плоскости не является, очевидно, произвольной, и основания в поли-нуклеотидах представлены в лактамной форме, наиболее вероятными были признаны пары аденин–тимин и гуанин–цитозин. Этот способ спаривания получил в дальнейшем экспериментальное подтверждение. Избирательность взаимодействия пар А–Т и Г–Ц принято выражать термином «комплементарность», а соответствующие азотистые основания называют комплементарными. Стабильность А–Т оснований обеспечивается двумя водородными связями, а пар Г–Ц – тремя, что в свою очередь определяется особенностями расположения функциональных групп азотистых оснований. Длина водородных связей между основаниями составляет около 0,3 нм. Таким образом, комплементарными оказываются не только отдельные основания, но и дезоксирибонуклеотидные цепи ДНК в целом, способствующие образованию весьма компактной структуры и стабилизации всей молекулы.
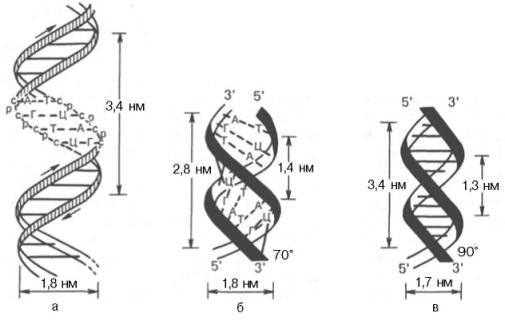
Рис. 3.1. Схематическое изображение двойной спирали ДНК. а - по Уотсону и Крику: с - остаток дезоксирибозы, р - остаток фосфорной кислоты; б - А-фор-ма ДНК; в - В-форма ДНК.
Обе цепи в молекуле ДНК имеют противоположную полярность. Это означает, что межнуклеотидная связь в одной цепи имеет направление 5'–>3', а в другой – 3'–>5'. Подобная направленность цепей имеет важное биологическое значение при репликации и транскрипции молекулы ДНК.
На модели ДНК (см. рис. 3.1) видно, что расстояние между витками (шаг спирали) равно 3,4 нм. На этом участке укладываются 10 нуклеотид-ных остатков, размер одного нуклеотида составляет 0,34 нм; диаметр биспиральной молекулы равен 1,8 нм.
Необходимо указать, что конфигурация двойной спирали ДНК сильно меняется в зависимости от количественного содержания воды и ионной силы окружающей среды. Методами рентгеноструктурного анализа доказано существование по крайней мере 6 форм ДНК, названных А-, В-, С-, D-, Е- и Z-формами. Конфигурация двух из них в простейшей форме представлена на рис. 3.1, б и в. Можно увидеть, что у А-формы наблюдается некоторое смещение пар оснований от оси молекулы к периферии, что отражается на размерах (2,8 нм – длина одного витка, в котором вместо 10 содержится 11 мононуклеотидов; меняется расстояние между нуклеотидами и др.). Если А- и В-формы представляют собой правозакрученную двойную спираль, то Z-форма (зигзагообразная) ДНК имеет левозакрученную конфигурацию, в которой фосфодиэфирный остов располагается зигзагообразно вдоль оси молекулы. Параллельно фосфодиэфирному остову в структуре А- и В-форм ДНК имеются большая и малая бороздки (желобки) – сайты, где присоединяются белки, выполняющие, очевидно, регуляторные функции при экспрессии генов. В настоящее время есть основание считать, что между А- и В-формами ДНК осуществляются взаимные переходы при изменении концентрации соли и степени гидратации. В-форма ДНК больше всего подходит к модели Уотсона и Крика. В этих переходах, которые могут быть вызваны растворителями или белками, очевидно, заключен определенный биологический смысл. Предполагают, что в А-форме ДНК выполняет роль матрицы в процессе транскрипции (синтез РНК на молекуле ДНК), а в В-форме – роль матрицы в процессе репликации (синтез ДНК на молекуле ДНК).
В структуре ДНК, как и в структуре РНК, открыты нуклеотидные последовательности, получившие название «палиндромы», или перевернутые повторы. Они встречаются как внутри одной цепи, так и в двойной спирали. Например, как слово ротатор, которое одинаково читается как справа налево, так и обратно. Подобные обратные повторы могут служить основой для образования структуры шпилек или других вариаций с измененным внутрицепочечным и межцепочечным спариванием и формированием на отдельных участках тройной спирали. Возможно, эти палинд-ромные структуры имеют определенный биологический смысл в регуляции экспрессии отдельных генов, выполняя роль сайтов для ДНК-связывающих белков. Предстоит, однако, приложить немало усилий для установления как точной структуры этих вариаций, так и для определения их функциональной роли.
Менее охарактеризована вторичная структура матричных и рибосомных РНК. Относительно вторичной структуры тРНК наиболее вероятной представляется модель, предложенная Р. Холли, плоское изображение которой напоминает клеверный лист (см. рис. 14.3). В настоящее время, когда известна первичная структура большинства тРНК, последовательность всех или почти всех природных тРНК как будто бы укладывается в эту схему «клеверного листа» (см. главу 14). При сравнении этих структур выявляется ряд закономерностей, несомненно, имеющих определенный биологический смысл. Во всех тРНК есть участки, взаимодействующие с рибосомами, места для связывания с аминокислотами и ферментами, а также специфическая последовательность трех нуклеотидов (триплет), называемая анти-кодоном, которая оказывается комплементарной тринуклеотидной последовательности мРНК (кодону), кодирующей включение в белковую молекулу определенной аминокислоты.
Независимо от типа РНК синтезированный в клетке продукт транскрипции (см. главу 13) всегда представлен единственной цепью, упакованной во вторичную структуру не случайно, а в соответствии с программой ДНК. Поскольку в составе РНК имеются свободные 2'-оксигруппы рибозы, не связанные со стандартным крик-уотсоновским спариванием азотистых оснований, появляются дополнительные возможности образования вторичной и третичной структур, содержащих выпуклости, шпильки, или крестообразные структуры. Особенности структуры тРНК имеют прямое отношение к процессу трансляции, поэтому более подробно они рассмотрены в разделе биосинтеза белка (глава 14).
Выделить нативную молекулу ДНК (рис. 3.2) из большинства источников, в частности хромосом, чрезвычайно трудно из-за высокой чувствительности молекулы ДНК к нуклеазам тканей и гидродинамической деструкции.
Удалось выделить в интактном (неповрежденном) виде только некоторые ДНК вирусов, митохондрий и хлоропластов. Исследования этих молекул при помощи физических (в частности, кристаллографических) и физико-химических методов показали, что двойная спираль ДНК на некоторых участках может подвергаться дальнейшей спирализации с образованием суперспирали или открытой кольцевой формы. Оказалось также, что линейная ДНК может образоваться из кольцевой формы или существовать как таковая в природе. В некоторых вирусах обнаружены, кроме того, одноцепочечные ДНК линейной и кольцевой форм (рис. 3.3).
Образование кольцевой формы молекулы ДНК у бактерий или в митохондриях клеток животных часто вызвано ковалентным соединением их открытых концов. Известно, что суперспиральная (суперскрученная) структура обеспечивает экономную упаковку огромной молекулы ДНК в хромосоме: вместо 8 см длины, которую она могла бы иметь в вытянутой форме, в хромосоме человека молекула ДНК настолько плотно упакована, что ее длина составляет 5 нм. Обычно в ДНК встречаются положительные и отрицательные супервитки, образованные за счет скручивания по часовой (правосторонней) или против часовой стрелки двойной спирали. Образование подобных супервитков катализируется специфическими ферментами, получившими название топоизомераз. Подобные суперспирали соединяются с белками (гистонами), упакованными в бороздках, обеспечивая тем самым стабильность третичной структуры ДНК. Степень суперспираль-ности (наличие супервитков) молекулы ДНК обычно устанавливают по изменению константы седиментации в определенных условиях. Суперспи-рализация ДНК может быть нарушена разрывом в одной из цепей или в обеих цепях двойной спирали под действием ДНКазы или при обработке интеркалирующими соединениями. Под интеркаляцией подразумевают встраивание плоских ароматических колец между стопками пар азотистых оснований ДНК. Интеркаляция может быть вызвана антибиотиками и красителями; в интактных клетках она может быть обусловлена ароматическими кольцами амнокислот, что имеет, очевидно, определенный биологический смысл в проблеме белково-нуклеинового узнавания.
Данные о структуре тРНК свидетельствуют о том, что нативные молекулы тРНК имеют примерно одинаковую третичную структуру, которая отличается от плоской структуры «клеверного листа» большой компактностью за счет складывания различных частей молекулы. Следует указать на существование у ряда вирусов (реовирус, вирус раневых опухолей растений и др.) природных двухцепочечных РНК, обладающих однотипной с ДНК структурой. При физиологических значениях рН среды, ионной силы и температуры создаются условия для образования в одно-цепочечных матричных и рибосомных РНК множества участков с двойной спиралью («шпильки») и дальнейшего формирования комплементарных участков, определяющих в известной степени жесткость их третичной структуры (рис. 3.4). В настоящее время получены доказательства значимости ван-дер-ваальсовых (диполь-дипольных и лондоновских) связей между азотистыми основаниями в стабилизации общей пространственной конфигурации нуклеиновых кислот.
Репликация
РЕПЛИКАЦИЯ (от позднелат. replicatio - повторение) (редупликация), самовоспроизведение нуклеиновых к-т (обычно ДНК, у нек-рых вирусов РНК), обеспечивающее точное копирование генетич. информации и передачу ее от поколения к поколению. При репликации ДНК нуклеотидная последовательность копируется (целиком или частично) в виде комплементарной последовательности (см. Комплементарность) дезоксирибонуклеотидов.
В процессе репликации двойная спираль ДНК, состоящая из двух комплементарных полинуклеотидных цепей, раскручивается на отдельные цепи и одновременно начинается синтез новых полинуклеотидных цепей; при этом исходные цепи ДНК играют роль матриц. Новая цепь, синтезирующаяся на каждой из исходных цепей, идентична др. исходной цепи. Когда процесс завершается, образуются две идентичные двойные спирали, каждая из к-рых состоит из одной старой (исходной) и одной новой цепи (рис. 1). Таким образом от одного поколения к другому передается только одна из двух цепей, составляющих исходную молекулу ДНК,-т. наз. полуконсервативный механизм репликации.
Репликация состоит из большого числа последоват. этапов, к-рые включают узнавание точки началу репликации, расплетание исходного дуплекса (спирали), удержание его цепей в изолированном друг от друга состоянии, инициацию синтеза на них новых дочерних цепей, их рост (элонгацию), закручивание цепей в спираль и терминацию (окончание) синтеза. Все эти этапы репликации, протекающие с высокой скоростью и исключит. точностью, обеспечивает комплекс, состоящий более чем из 20 ферментов и белков,-т. наз. ДНК-репликазная система, или реплисома. Функцион. единица репликации-реплик он, представляющий собой сегмент (участок) хромосомы или внехромосомной ДНК, ограниченный точкой начала, в к-рой инициируется репликация, и точкой окончания, в к-рой репликация останавливается. Скорость репликации контролируется на стадии инициации. Однажды начавшись, репликация продолжается до тех пор, пока весь репликон не будет дуплицирован (удвоен). Частотд инициации определяется взаимод. спец. регуляторных белков с точкой начала репликации. Бактериальные хромосомы содержат один репликон: инициации в единств. точке начала репликации ведет к репликации всего генома. В каждом клеточном цикле репликация инициируется только один раз, Плазмиды и вирусы, являющиеся автономными генетич. элементами, представляют собой отдельные репликоны, способные к многократной инициации в клетке-хозяине. Эукариотич. хромосомы (хромосомы всех организмов, за исключением бактерий и синезеленых водорослей) содержат большое число репликонов, каждый из к-рых также однократно инициируется за один клеточный цикл.
Начиная с точки инициации, репликация осуществляется в ограни-ченной зоне, перемещающейся вдоль исходной спирали ДНК. Эта активная зона репликации (т. наз. репликац. вилка) может двигаться в обоих направлениях. При однонаправленной репликации вдоль ДНК движется одна репликац. вилка. При двунаправленной репликации от точки инициации в противоположных направлениях расходятся две репликац. вилки; скорости их движения могут различаться. При репликации ДНК бактерии и млекопитающих скорость роста дочерней цепи составляет соотв. 500 и 50 нуклеотидов в 1 с; у растений эта величина не превышает 20 нуклеотидов в 1 с. Движение двух вилок в противоположных направлениях создает петлю, к-рая имеет вид "пузыря" или "глаза". Продолжающаяся репликация расширяет "глаз" до тех пор, пока он не включит в себя весь репликон.
В ходе репликации рост цепи осуществляется благодаря взаимод. дезоксирибонуклеозидтрифосфата с 3'-ОН концевым ну-клеотидом уже построенной части ДНК; при этом отщепляется пирофосфат и образуется фосфодиэфирная связь. Рост полинуклеотидной цепи (рис. 2) идет только с ее З'-конца, т. е. в направлении 5': 3' (см. Нуклеиновые кисло-ты). Фермент, катализирующий эту р-цию,-ДНК-полиме-раза (см. Полидезоксирибонуклеотид-синтетазы)-не способен начать матричный синтез на одноцепочечной ДНК, если нет хотя бы олигонуклеотидного биспирального участка (т. наз. затравочного олигонуклеотида) комплементарного матрице; затравочным олигонуклеотидом во мн. случаях является не ДНК, а РНК.
Энергия, затрачиваемая на образование каждой новой фосфодиэфирной связи в цепи ДНК, обеспечивается расщеплением фосфатной связи между a- и b-фосфатными группами нуклеозидтрифосфата.
ДНК-полимераза имеет один центр связывания нуклеозидтрифосфата, общий для всех четырех нуклеотидов. Выбор из среды нуклеотида, основание к-рого комплементарно очередному основанию матрицы, протекает без ошибок, благодаря определяющему влиянию ДНК-матрицы (исходной цепи ДНК). При нек-рых мутационных повреждениях структуры ДНК-полимеразы в ряде случаев происходит включение некомплементарных нуклеотидов.
В процессе репликации формальной ДНК на короткое время с вероятностью 10-4-10-5 возникают редкие таутомерные формы всех 4 азотистых оснований нуклеотидов, к-рые образуют неправильные пары. Высокая точность репликации (вероятность ошибок не превышает 10-9) обусловлена наличием механизмов, осуществляющих коррекцию (репарацию).
Репликац. вилка асимметрична. Из двух синтезируемых дочерних цепей ДНК одна строится непрерывно, а другая-с перерывами. Первую наз. ведущей, или лидирующей, цепью, а вторую-отстающей. Синтез второй цепи идет медленнее; хотя в целом эта цепь строится в направлении 3': 5', каждый из ее фрагментов в отдельности наращивается в направлении 5': 3' (рис. 3). Благодаря такому прерывистому механизму синтеза, репликация обеих антипараллельных цепей осуществляется с участием одного фермента-ДНК-полимеразы, катализирующего наращивание нуклеотидной цепи только в направлении 5': 3'.
В качестве затравок для синтеза фрагментов отстающей цепи служат короткие отрезки РНК, комплементарные матричной цепи ДНК. Эти РНК-затравки (праймеры), состоящие примерно из 10 нуклеотидов, с определенными интервалами синтезируются на матрице отстающей цепи из рибонуклеозидтрифосфатов в направлении 5': 3' с помощью фермента РНК-праймазы. РНК-праймеры затем наращиваются дезоксинуклеотидами с 3'-конца ДНК-поли-меразой, к-рая продолжает наращивание до тех пор, пока строящаяся цепь не достигает РНК-затравки, присоединенной к 5'-концу предыдущего фрагмента. Образующиеся таким образом фрагменты (т. наз. фрагменты Оказаки) отстающей цепи насчитывают у бактерий 1000-2000 дез-оксирибонуклеотидных остатков; в животных клетках их длина не превышает 200 нуклеотидов.
Чтобы обеспечить образование непрерывной цепи ДНК из многих таких фрагментов, в действие вступает особая система репарации ДНК, удаляющая РНК-затравку и заменяющая ее на ДНК. У бактерий РНК-затравка удаляется нуклеотид за нуклеотидом благодаря 5': 3'-экзонуклеазной активности ДНК-полимеразы. При этом каждый отщепленный рибонуклеотидный мономер замещается соответствующим дезоксирибонуклеотидом (в качестве затравки используется З'-конец синтезированного на старой цепи фрагмента). Завершает весь процесс фермент ДНК-лигаза, катализирующий образование фосфодиэфирной связи между группой З'-ОН нового фрагмента ДНК и 5'-фосфатной группой предыдущего фрагмента. Образование этой связи требует затраты энергии, к-рая поставляется в ходе сопряженного гидролиза пирофосфатной связи кофермента-никотинамид-адениндинуклеотида (в бактериальных клетках) или АТФ (в животных клетках и у бактериофагов).
Раскручивание двойной спирали и пространств. разделение цепей осуществляется при помощи неск. спец. белков. Т. наз. геликазы расплетают короткие участки ДНК, находящиеся непосредственно перед репликац. вилкой. На разделение каждой пары оснований расходуется энергия гидролиза двух молекул АТФ до аденозиндифосфата и фосфата. К каждой из разделившихся цепей присоединяется неск. молекул ДНК-связывающих белков, к-рые препятствуют образованию комплементарных пар и обратному воссоединению цепей. Благодаря этому нуклеотидные последовательности цепей ДНК оказываются доступными для репликативной системы. Др. специфич. белки помогают праймазе получить доступ к матрице отстающей цепи. В результате праймаза связывается с ДНК и синтезирует РНК-затравки для фрагментов отстающей цепи. Для формирования новых спира-,лей не требуется ни затрат энергии, ни участия к.-л. "закручивающего" фермента.
В случае кольцевого репликона (напр., у плазмиды) описанный процесс наз. q-репликацией. Т.к. кольцевые молекулы ДНК закручены сами на себя (суперспирализо-ваны), при раскручивании двойной спирали в процессе репликации они должны непрерывно вращаться вокруг собств. оси. При этом возникает торсионное напряжение, к-рое устраняется путем разрыва одной из цепей. Затем оба конца сразу же вновь соединяются друг с другом. Эту ф-цию выполняет фермент ДНК-топоизомераза. Репликация в этом случае обычно происходит в двух направлениях, т.е. существуют две репликац. вилки (рис. 4). После завершения репликации появляются две двухцепочечные молекулы, к-рые сначала связаны друг с другом как звенья одной цепи. При их разделении одно из двух колец временно разрывается.
Альтернативный вариант репликации кольцевого репликона предполагает разрыв в одной из цепей двухспиральной молекулы ДНК. Образовавшийся при этом свободный 3'-конец кова-лентно наращивается, оставаясь связанным с матрицей (второй, неразорванной цепью), а 5'-конец постепенно вытесняется новой полинуклеотидной цепью (рис. 5). Таким образом одна цепь разматывается и непрерывно удлиняется, а репликац. вилка скользит вокруг кольцевой матричной цепи (механизм "катящегося кольца"). По мере роста новой цепи вытесненная цепь с освободившимся 5'-концом становится линейной матрицей для синтеза новой комплементарной цепи. Этот синтез на линейной матрице продолжается до тех пор, пока не образуется дочерняя цепь ДНК, комплементарная одному обороту кольцевой матрицы, т. е. целому репликону. Таким путем с кольцевой матрицы может сходить большое число комплементарных копий. Такой механизм обнаружен у нек-рых вирусов, а также в ряде клеток эукариот.
Еще одна схема репликации предполагает формирование структуры, названной D-петлей. Согласно этому механизму, сначала реплицируется только одна из цепей кольцевого репликона, тогда как вторая цепь, оставаясь интактной, вытесняется, образуя петлю. Репликация второй цепи начинается с др. стартовой точки и только после того, как реплицировалась часть первой цепи. Такой механизм репликации обнаружен, напр., у митохондриальных ДНК.
Репликация РНК (синтез РНК на РНК-матрице) изучена меньше. Она осуществляется только у нек-рых вирусов (напр., у вирусов полиомиелита и бешенства). Фермент, катализирующий этот процесс,-РНК-зависимая РНК-полимераза (его называют также РНК-репликазой или РНК-синтетазой). Известно неск. типов репликации, РНК: 1) вирусы, содержащие матричные РНК, или мРНК [т. наз. (+)РНК], в результате репликации образуют комплементарную ей цепь [(-)РНК], не являющуюся мРНК, к-рая используется как матрица для синтеза (+)РНК; 2) вирусы, содержащие (—)РНК, в результате репликации синтезируют (+)РНК; 3) вирусы, содержащие двухцепочечную РНК [(+)PHK и (—)РНК], в результате асимметрической репликации синтезируют (+)РНК.
Гипотеза о механизме репликации сформулирована в 1953 Дж. Уотсоном и Ф. Криком, к-рые предположили, что две комплементарные цепи ДНК после их разделения могут выполнять ф-ции матриц для образования на них новых цепей ДНК. В 1958 М. Мезельсон и Ф. Сталь экспериментально подтвердили такой механизм репликации.
Транскрипция
ТРАНСКРИПЦИЯ (от лат. transcriptio, букв-переписывание), биосинтез РНК на матрице ДНК; первая стадия реализации генетич. информации, в ходе к-рой нуклеотидная последовательность ДНК считывается в виде нуклеотидной последовательности РНК (см. Генетический код). В основе этого процесса лежит принцип комплементарного спаривания пуриновых и пиримидиновых оснований (см. Компле-ментарность). Транскрипция осуществляется с участием фермента РНК-полимеразы, использующей в качестве субстратов рибонук-леозидтрифосфаты. Кроме того, в транскрипции участвует большое число вспомогат. белков, регулирующих работу РНК-полимеразы.
Транскрипция происходит на участках ДНК, наз. единицами транскрипции или трапскриптонами. В начале и конце транскрилтона расположены специфич. нуклеотидные последовательности -соотв. промотор и терминатор. Существование множества транскриптонов обеспечивает возможность независимого считывания разных генов, их индивидуального включения и выключения. У животных, растений и др. эукариот в состав транскриптона, как правило, входит один ген. Транс-криптоны бактерий обычно наз. оперонами; мн. из них содержат по неск. генов, обычно функционально связанных (напр., кодирующих неск. ферментов, участвующих в синтезе той или иной аминокислоты).
Процесс синтеза РНК можно разделить на четыре основные стадии: 1) связывание РНК-полимеразы с промотором, 2) начало синтеза цепи РНК (инициация), 3) рост цепи РНК (элонгация), 4) завершение синтеза цепи РНК (терминация).
Связывание РНК-полимеразы с промотором включает по крайней мере два этапа. На первом РНК-полимераза образует с промотором закрытый комплекс, в к-ром ДНК сохраняет двухспиральную структуру, а РНК-полимераза еще не способна начать синтез РНК. На втором закрытый комплекс превращается в открытый, в к-ром РНК-полимераза расплетает примерно один виток двойной спирали ДНК в районе стартовой точки-нуклеотида, с к-рого начинается комплементарное копирование матрицы.
При наличии субстратов РНК-полимераза в открытом комплексе осуществляет инициацию. Первый нуклеотид (обычно это аденозин- или гуанозинтрифосфат) входит в состав цепи целиком, а последующие присоединяются к группе 3'-ОН предыдущего нуклеотида с образованием фос-фодиэфирной связи и освобождением пирофосфата (см. Нуклеиновые кислоты). На стадии инициации образующаяся РНК связана с матрицей и ферментом непрочно и может отделиться от комплекса. В этом случае РНК-полимераза, не покидая промотора, снова инициирует РНК (такой синтез коротких рибонуклеотидов наз. абортивным). Стадия инициации завершается, когда цепь РНК достигает критич. длины (от 3 до 9 нуклеотидов на разных промоторах); при этом от РНК-полимеразы отделяется s-субъединица.
Считают, что в процессе элонгации примерно 13 нуклеотидов РНК образуют гибридную спираль с матричной нитью расплетенной ДНК (всего на этой стадии в ДНК расплетено примерно 18 нуклеотидов). По мере движения РНК-полимеразы по матрице впереди нее происходит расплетание, а позади восстановление двойной спирали ДНК. Одновременно происходит вытеснение очередного звена растущей цепи РНК из комплекса с матрицей.
Цепь РНК растет в направлении 5': 3' по мере продвижения РНК-полимеразы по цепи ДНК в направлении от 3'-конца к 5'-концу. Средняя скорость роста цепи РНК у бактерии Escherichia coli (E. coli) составляет 40-45 рибонуклеотидов в секунду. В процессе удлинения цепи РНК фермент движется по ДНК с непостоянной скоростью. В нек-рых участках матрицы происходят длительные задержки в его продвижении, т. наз. паузы (нек-рые стадии транскрипции показаны на рис.).
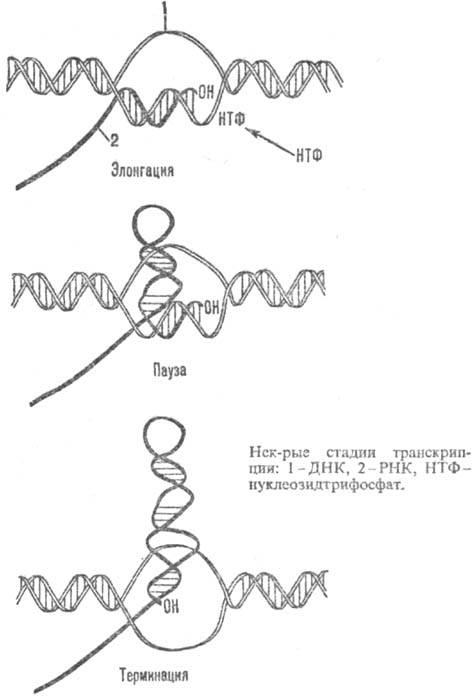
На стадии злонгации в состав транскрибирующего комплекса входит ряд дополнит. белков, от к-рых зависит протекание завершающей стадии транскрипции -терминации. Один из таких белков, кодируемых геном nusA E. coli, занимает в РНК-полимеразе место s-субъединицы. Др. бактериальный фактор терминации r взаимод. с РНК.
Терминация транскрипции, как правило, происходит в строго определенных участках матрицы - терминаторах, в к-рых от матрицы отделяются РНК и РНК-полимераза; последняя, объединившись со свободной s-субъединицей, может вступить в следующий цикл транскрипции. В терминаторах, для узнавания к-рых РНК-полимеразе не требуется фактора р, нуклеотидная последовательность характеризуется двумя особенностями: по ходу транскрипции перед точкой терминации расположен участок, богатый парами dG-dC (дезоксигуанозин-дезоксицити-дин), а затем участок, состоящий из 4-8 расположенных подряд остатков дезоксиадениловой к-ты. Предполагают, что после прохождения РНК-полимеразой участка, богатого dG-dC, в РНК возникает шпилька, к-рая препятствует продвижению фермента и разрушает часть спирали РНК-ДНК транскрибирующего комплекса. Оставшаяся часть гибридной спирали, включающая концевую полиуридиловую последовательность РНК, легко плавится (разрушается) ввиду крайней нестабильности комплементарной пары уридин-дезоксиаденозин, что и приводит к освобождению РНК.
Мн. терминаторы узнаются РНК-полимеразой только с помощью белковых факторов терминации. Из них наиб. изучен фактор r E. coli-олигомерный белок с мол. м. 46 тыс. Фактор r присоединяется к определенным участкам синтезируемой РНК (не имеющим протяженных двухспи-ральных структур) до того, как РНК-полимераза достигает терминатора. Предполагается, что фактор r передвигается вдоль РНК вслед за РНК-полимеразой, используя для этого энергию гидролиза нуклеозидтрифосфатов, и способствует диссоциации гибрида РНК с матричной нитью ДНК.
Скорость транскрипции разл. генов может отличаться в тысячи раз; в столь же больших пределах может изменяться скорость транскрипции одного и того же гена в разных тканях многоклеточного организма или в одной клетке в зависимости от изменяющихся внеш. условий или внутр. программы. На стадии инициации регуляция транскрипции осуществляется благодаря наличию особых белков-регуляторов (см. Регуляторные белки), способных присоединяться к определенным участкам ДНК и тем самым препятствовать или помогать РНК-полимеразе инициировать синтез РНК на промоторе.
У прокариот регуляция транскрипции часто осуществляется на стадии терминации в особых терминаторах (называемых аттенюаторами), расположенных в начале или внутри оперонов.
Существует также обратная транскрипция-синтез ДНК на матрице РНК. Такой синтез осуществляется у ретровирусов (семейство РНК-содержащих вирусов) с участием фермента ревер-тазы (обратная транскриптаза). В ходе обратной транскрипции образуется вначале гибрид РНК-ДНК, к-рый реплицирует под действием ДНК-зависимой ДНК-полимеразы (см. Полиде-зоксирибонуклеотид-синтетазы) с образованием двухцепо-чечной спирали ДНК. Последняя также подвержена репликации и способна включаться в геном инфицированной клетки и служить там матрицей для вирусной РНК. Транскрипция обр., поток генетич. информации у ретровирусов направлен от РНК к ДНК и затем обратно к РНК.
РНК-полимеразу открыли С. Вейс, Ж. Гурвиц и О. Стивене в 1960; ими же установлено ее значение в синтезе РНК. Концепцию транскриптона (оперона) сформулировали Ф. Жакоб и Ж. Моно в 1961. X. Темин и Д. Балтимор в 1970 открыли обратную транскриптазу и механизм синтеза ДНК на РНК-матрице.
Генетический код
ГЕНЕТИЧЕСКИЙ КОД, система "записи" наследств. информации в виде последовательности нуклеотидов в молекулах нуклеиновых к-т. Реализация генетического кода в клетке происходит в два этапа: 1) синтез молекулы матричной, или информационной, РНК (соотв. мРНК, или иРНК) на соответствующем участке ДНК; при этом последовательность нуклеотидов ДНК "переписывается" в нуклеотидную последовательность мРНК (см. Транскрипция); 2)синтез белка, при к-ром последовательность нуклеотидов мРНК переводится в соответствующую последовательность аминокислот (см. Трансляция).
Впервые идея о существовании генетического кода сформулирована А. Дауном и Г. Гамовым в 1952-54, к-рые показали, что последовательность нуклеотидов, однозначно определяющая синтез той или иной аминокислоты, должна содержать не менее трех звеньев. Позднее было доказано, что такая последовательность состоит из трех нуклеотидов, названных кодоном, или триплетом. Т.к. молекулы нуклеиновых к-т, на к-рых происходит синтез мРНК или белка, состоят из остатков только четырех разных нуклеотидов, кодонов, отличающихся между собой, м. б. всего 64.
Все синтезируемые в процессе трансляции белки построены из остатков 20 аминокислот (т. наз. кодируемых). Какой именно кодон ответствен за включение той или иной аминокислоты, можно определить по таблице, в к-рой буквы А, Г, У, Ц обозначают основания, входящие в ну-клеотиды (соотв. аденин, гуанин, урацил, цитозин): в вертикальном ряду слева-в первый нуклеотид кодона, в горизонтальном ряду сверху-во второй, в вертикальном ряду справа-в третий. Трехбуквенные сочетания, напр. фен, сер, лей,-сокращенные назв. аминокислот. Прочерки в таблице означают, что три кодона-УАА, УАГ и УГА в нормальных условиях не кодируют к.-л. аминокислоты. Такие кодоны наз. "бессмысленными", или нонсенс-кодонами. Они являются "сигналами" остановки синтеза полипептидной цепи.
В таблице представлены не все аминокислоты, встречающиеся в белках. В ней нет гидроксипролина и гидроксилизина, содержащихся в коллагене; фосфосерина-компонента всех фосфопротеидов; иодпроизводных тирозина, содержащихся в тиреоглобулине; цистина, к-рый часто встречается в белках, и нек-рых др. аминокислот. Все они-производные др. аминокислот, к-рые кодируются мРНК. Они образуются в результате модификации белков, происходящей после трансляции.
Генетический код специфичен: это означает, что каждый кодон кодирует только одну аминокислоту. Лишь два кодона, кодирующие валин (ГУГ) и метионин (АУГ), способны выполнять дополнит. ф-ции. Если они находятся в начале считываемой области мРНК, к ним присоединяется транспортная РНК (тРНК), несущая формилметионин, к-рый всегда находится в начале строящейся полипептидной цепи, а по завершении синтеза отщепляется целиком или отщепляет формильный остаток, превращаясь в остаток метионина. Т. обр., кодоны ГУГ и АУГ-инициаторы синтеза полипептидной цепи. Если же они не стоят первыми, то не отличаются по ф-циям от др. кодонов.
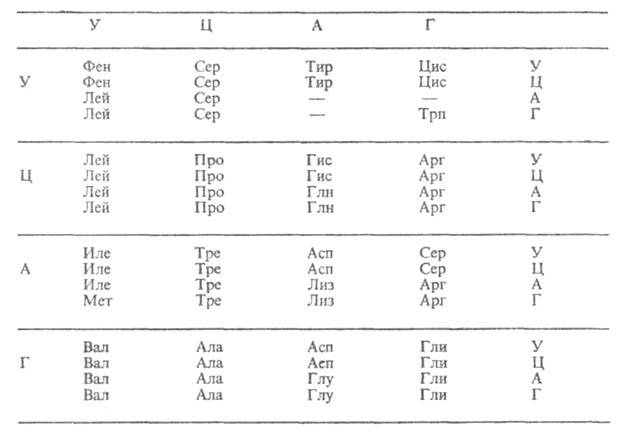
Генетический код называют вырожденным, поскольку 61 кодон кодирует всего 20 аминокислот. Поэтому почти каждой аминокислоте соответствует более чем один кодон. Вырожденность генетического кода неравномерна: для аргинина, серина и лейцина она шестикратна (т.е. для каждой из этих аминокислот имеется по шесть кодонов), тогда как для мн. др. аминокислот (тирозина, гистидина, фенилаланина и др.) лишь двукратна. Две аминокислоты (метионин и триптофан) представлены единств. кодонами. Кодоны-синонимы почти всегда отличаются друг от друга по последнему из трех нуклеотидов, тогда как первые два совпадают. Т. обр., код аминокислоты определяется в осн. первыми двумя "буквами". Вырожденность генетического кода имеет важное значение для повышения устойчивости генетич. информации.
С механизмами трансляции связана еще одна особенность генетического кода: он неперекрывающийся. Кодоны транслируются всегда целиком; для кодирования невозможно использование элементов одного из них в сочетании с элементами соседнего. "Рамкой", ограничивающей транслируемый кодон и перемещающейся скачком сразу на три нуклеотида, служит антикодон тРНК, к-рый представляет собой триплет нуклеотидов, комплементарный одному из кодонов и обусловливающий специфичность к нему. Т. обр., наблюдается линейное соответствие между последовательностью кодирующих триплетов и расположением остатков аминокислот в синтезируемом полипептиде, т.е. код имеет линейный непрерывающийся порядок считывания.
Важнейшее св-во генетического кода-его однонаправленность. Кодоны информативны только в том случае, если они считываются в одном направлении-от первого нуклеотида к последующим.
Генетический код универсален для всех живых существ. Возможны только небольшие видовые изменения, возникшие, вероятно, при эволюции и дифференцировке клеток. Большинство из них связано с вырожденностью кода и проявляется в преимуществ. использовании разных кодонов одной и той же аминокислоты и в различиях в структуре соответствующих тРНК в разных организмах или в разных тканях одного организма.
Представления об общих принципах и осн. св-вах генетического кода были разработаны Ф. Криком в 1957-65. Благодаря работам X. Кораны, X. Маттеи, М. Ниренберга и С. Очоа к 1966 был расшифрован нуклеотидный состав всех кодонов.
Дата добавления: 2016-01-05; просмотров: 187; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
