Образование активных форм кислорода
СВОБОДНЫЕ РАДИКАЛЫ. АКТИВНЫЕ ФОРМЫ КИСЛОРОДА
В последние 10–15 лет проблема патогенеза цереброваскулярных заболеваний обогатилась раскрытием механизма повреждения клеточных структур. Основным фактором повреждения оказался кислород – тот самый кислород, из–за недостатка которого возникает гибель клеток. Выяснилось, что так называемые активные формы кислорода (АФК), имеющие неспаренный электрон, обладают биологическим эффектом, который в зависимости от концентрации АФК может быть регуляторным или токсическим.
Главным источником АФК в клетках являются митохондрии. Обычно примерно 98% всего кислорода, поступающего в клетки, используется для окисления субстратов с образованием АТФ и выделением тепла, и лишь 2% используется в реакциях образования АФК, которое может значительно возрастать при усиленном поступлении кислорода в клетки или нарушении работы электронно–транспортной цепи митохондрий.
АКТИВНЫЕ ФОРМЫ КИСЛОРОДА (АФК)
О2° - супероксидный анион радикал
НО2° – гидропероксидный радикал
НО° – гидроксил-радикал
Н2О2 – пероксид водорода
НОСl – гипохлорная кислота
Н2О2 и НОСl генерируют свободные радикалы в присутствии Fe2+ и О2°:
Н2О2 + Fe2+ → НО° + ОН° + Fe3+ (реакция Фентон)
Н2О2 + О2° → НО° + ОН° + О2 (реакция Хабера-Вайса)
НОСl + О2° → НО° + СIО2
В свою очередь, О2° способен превращаться в НО2° и Н2О2 согласно реакциям:
|
|
|
О2° + Н+ → НО2°
НО2° + НО2° → Н2О2 + О2
Кроме того, к АФК относят окись азота (NO°), образующую с О2° пероксинитрит:
NO° + О2° → ONOO° => ONOOH > НО° + NO2°
Образование активных форм кислорода может происходить:
в процессе переноса электронов в митохондриальной дыхательной цепи;
в реакциях, которые катализируются оксидазами (образуется перекись водорода), в том числе в свободнорадикальных процессах, совершающихся в фагоцитах;
в реакциях микросомального окисления при обезвреживании веществ с участием цитохрома Р-450;
в реакциях самопроизвольного (неферментативного) окисления веществ (гемоглобина, ферредоксинов, адреналина и др.);
в биологических системах с наличием ионов металлов с переменной валентностью и, прежде всего, железа (свободных атомов, так называемых внегемовых)
.
Значительное число АФК при воспалениях образуется в остром периоде нейтрофильными гранулоцитами крови и макрофагами во время "кислородно-метаболического взрыва лейкоцитов".
Поступление в кровь АФК и продуктов ПОЛ способствует выработке и высвобождению провоспалительных цитокинов, медиаторов воспаления, а также медленно реагирующей субстанции анафилаксии и обуславливает резкую активацию системы комплемента по альтернативному пути с высвобождение анафилаксина.
|
|
|
В этот период происходит резкая активация калликреин-кининовой системы, а также нарушается нормальное функционирование систем фибринолиза и гемостаза. Интенсивный выброс цитокинов и медиаторов воспаления макрофагами и иммунокомпетентными клетками, активация эндотелиоцитов и рост их тромбогенного потенциала, а также замедление периферического кровотока на фоне избыточной адренэргической стимуляции вызывают во многих органах выраженное в той или иной степени воспаление, не имеющее биологической цели, т.е. защитно-приспособительного значения, что обуславливает вторичное повреждение тканей и разрушение структурно-функциональных единиц органов.
Процессы свободнорадикального окисления (СРО) с участием АФК при низкой интенсивности относятся к нормальным метаболическим процессам:
индуцируют процессы ПОЛ, необходимые для обновления фосфолипидов и регуляции проницаемости клеточных мембран;
активируют ряд мембранных белков и иммуноглобулинов, а также ферментов, регулирующих переключение метаболических путей и синтез макроэргических соединений в клетке;
|
|
|
окислительное фосфорилирование и клеточное деление;
индуцирование экспрессии групп генов в ядре, ответственных за различные формы защитных реакций клетки;
биосинтез прогестерона, стероидных и тиреоидных гормонов, лейкотриенов, тромбоксана А2, протромбина;
регуляция метаболизма соединительной ткани, стимулирование пролиферации фибробластов, минтез и распад коллагена и триптофана;
участие в метаболизме железа;
участие с помощью цитохрома Р450, кислорода и АФК в детоксикации липофильных ксенобиотиков;
участие в регуляции сосудистого тонуса путем ингибирования эндогенного оксида азота;
участие в реакциях клеточного и гуморального иммунитета;
реализации микробицидного, цитотоксического и иммунорегуляторного действия гранулоцитов и мононуклеарных фагоцитов, реакции фагоцитоза;
образование хемотаксического фактора, вызывающего активацию и миграцию лейкоцитов в очаг воспаления.
Ведущую роль в повреждающем действии кислорода в отношении молекулярных структур в организме выполняют именно его радикальные производные – свободные радикалы. Свободный радикал (СР) – это молекула, атом или группа атомов, имеющих неспаренный электрон на внешней атомной орбитали, «готовый соединиться с чем и кем угодно» (А.Комфорт).
|
|
|
Присутствие неспаренного электрона наделяет радикал чрезвычайно высокой окислительной способностью и наличием магнитного момента.
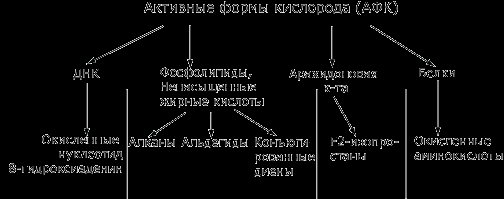
Рис.2 Взаимодействие активных форм кислорода (АФК) с компонентами клеток.
Интенсификация свободнорадикальных процессов, перекисного окисления ПНЖК наблюдается при развитии общего неспецифического адаптационного синдрома (стресса), т. е. практически при большинстве острых заболеваний и состояний, обострении хронических заболеваний, интоксикациях, ожогах, травмах, операциях и т. п.
Целый ряд причин вызывает активацию ПОЛ в тканях:
снижение поступления в организм алиментарных антиоксидантов (АО), таких как: токоферол, аскорбат, биофлавоноиды и др.;
стресс различного генеза, в частности эмоциональный (под влиянием катехоламинов и кортикостероидов в кровь поступает избыток жирных кислот и кислород);
внешние химические прооксиданты (пестициды, лекарственные окислители, алкоголь, продукты смога и т.д.);
физические факторы (повышенный радиоактивный фон, ультрафиолетовое облучение, электромагнитное поле, ультразвук с интенсивностью выше 2 Вт/см);
избыточное и несбалансированное потребление жиров и углеводов на фоне недостаточного их расходования;
гипокинезия с низким уровнем биологического окисления ферментов, т.е. сниженный уровень восстановления пиридиннуклеотидов;
врожденные энзимопатии антиоксидантных ферментов (каталазы, глутатионредуктазы, глутатионпероксидазы, глюкозо-6-фосфат-дегидрогеназы);
падение с возрастом активности антиоксидантных ферментов.
В основе биологической целесообразности этой интенсификации лежит усиление в возникающих экстремальных условиях синтеза эйкозаноидов, обновления мембран, детоксикационных (обезвреживающих) процессов.
Широкое распространение синдрома активации СРР привело к появлению термина «свободнорадикальные болезни», к которым относят более 100 патологий, в частности: мутагенез, злокачественный рост клеток; различные токсикозы; гипотония; гипертония; стресс и расстройства, связанные с ним; авитаминозы, в частности А- и Е-авитаминозы; острые и хронические воспалительные процессы; раны, язвы, травмы; катаракта, увеиты; рассеянный склероз; болезни Паркинсона и Альцгеймера; старение; шизофрения; сахарный диабет; бронхиальная астма и бронхолегочные патологии; артриты, артрозы и системные заболевания суставов; сердечно-сосудистые заболевания, пороки сердца, атеросклероз и артериосклероз; ишемия мозга, дисциркуляторная энцефалопатия и многие другие.
СИСТЕМА АНТИОКСИДАНТНОЙ ЗАЩИТЫ ОРГАНИЗМА
Систему защиты тканей и клеток от токсических метаболитов кислорода и продуктов ПОЛ можно условно разделить на:
физиологическую (механизмы, осуществляющие регуляцию доставки и поступления кислорода к клеткам);
биохимическую (собственно антиоксидантную систему организма, т.е. широкий класс химических соединений, снижающих активность радикальных окислительных процессов).
Физиологический компонент обеспечивает равновесие между интенсивностью транспорта кислорода к клеткам и метаболическими процессами по его выгодной и безопасной утилизации и обеспечивается наличием каскада уровней парциального давления кислорода, понижающегося от артерий к клеткам и субклеточным структурам (в 100 -1000 раз), а также редукцией микроциркуляции в тканях при увеличении парциального давления кислорода в артериальной крови. Происходящий при этом так называемый «гипероксический вазоспазм» обусловлен снятием сосудорасширяющего действия СО2, а также снижению активности NO-синтазы и, соответственно, снижению выработки основного фактора расширения сосудов – оксида азота.
Биохимическая АО система условно делится на специфическую и неспецифическую:
специфическая АО система направлена на разрушение образующихся АФК и продуктов их дальнейших превращений;
неспецифическая - предотвращает условия и возможности утечки электронов и генерации АФК в ходе окислительно-восстановительных реакций (в рамках окислительного фосфорилирования) или в процессе аутоокисления субстратов (микросомальное окисление).
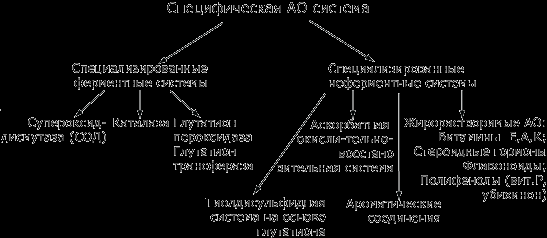
Рис.3. Схема основных составляющих специфической антиоксидантной системы организма.
А. Специфическая АО система включает:
Специализированные ферментные системы;
Неферментные соединения.
1.Специализированные ферментные системы.
1.1. К специфическим АО-энзимам можно отнести супероксиддисмутазу, каталазу, глутатионзависимые пероксидазы и трансферазы.
Эта группа ферментов, локализующихся преимущественно внутриклеточно, обладает способностью разрушать свободные радикалы, а также участвовать в разложении гидроперекисей нерадикальным путем. Энзимы антирадикальной защиты характеризуются высокой избирательностью действия, направленного против определенных радикалов, специфичностью клеточной и органной локализации, а также использованием в качестве стабилизаторов металлов переменной валентности – меди, цинка, марганца, железа и др…
1.1.1. Супероксиддисмутаза (СОД) – ключевой фермент АО защиты; обеспечивает превращение супероксидного анион-радикала в менее активный окислитель – перекись водорода, которая элиминируется каталазой до двух молекул воды и молекулы кислорода. СОД содержит ион меди, ион цинка, ион железа и имидазол гистидина.
Основным местом локализации фермента является цитозоль. СОД обладает высокой термоустойчивостью, устойчивостью к действию протеаз, денатурирующих агентов, широким оптимумом рН каталитической активности. СОД – водорастворимый фермент, поэтому супероксидный радикал, генерируемый в мембране и вызывающий процессы ПОЛ, оказывается для нее малодоступным
1.1.2. Каталаза – обеспечивает расщепление перекиси водорода до 2-х молекул воды и кислорода; из-за большого молекулярного веса практически не проникает через клеточные мембраны.
Данные ферменты обладают слабой активностью по отношению к липидным пероксидам, образующимся в ходе цепных реакций ПОЛ. Разрушение этих продуктов осуществляется с участием ферментной системы глутатиона.
1.1.3. Система ферментов глутатиона.
- селенсодержащая глутатионпероксидаза - локализована в цитозоле и митохондриях;
эффективно разлагает гидрофильные гидроперекиси липидов и перекись водорода;
катализирует реакцию восстановленного глутатиона с гидроперекисями липидов, при этом последние превращаются в жирные оксикислоты;
восстанавливает перекиси белкового и нуклеиновокислотного происхождения.
- глутатионтрансфераза – содержится преимущественно в цитозоле клеток; не взаимодействует с перекисью водорода;
восстанавливает гидрофобные гидропероксиды с большим объемом молекулы: гидроперекиси полиненасыщенных жирных кислот – линоленовой и арахидоновой, а также фосфолипидов;
восстанавливает гидроперекиси мононуклеотидов и ДНК, участвуя в их репарации.
- глутатионредуктаза – позволяет быстро пополнить пул восстановленного глутатиона, тем самым поддерживая нормальную работу глутатионзависимых ферментов
Ферментные АО практически все всегда выполняют свою функцию внутри клетки. Их синтез и внутриклеточное содержание, как и большинства белков, находится под генетическим контролем и интенсифицируется под влиянием ряда внешних воздействий, к которым относятся и фармакологические (введение лекарственных препаратов). Большая молекулярная масса молекул энзимов препятствует их выходу за пределы клеток, одновременно это же и является препятствием для проникновения внутрь клетки и введенным в организм в виде лекарственных препаратов экзогенных ферментов и белков (например, СОД, церебролизин, актовегин и др..). В случае же попадания ферментных АО и белков в кровь (цитолиз клеток, введение извне в виде лекарств), они не могут рассматриваться в качестве ключевых механизмов в антирадикальной и антиперекисной защите крови, так как очень быстро, в течение 5 – 10 минут разрушаются под действием протеаз крови или выводятся в неизмененном виде почками. В результате уровень ферментных АО крови крайне низок и суммарно определяет менее 1% ее антирадикальной и антиперекисной активности.
58 –
Дата добавления: 2016-01-05; просмотров: 204; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
