Оцінювання якості сперми
Запліднюваність самок, що підлягають осіменінню, у значній мірі залежить від якості застосованої сперми. Тому одержану сперму використовують для осіменіння лише після попереднього її оцінювання.
На підставі такого оцінювання сперми можна зробити висновок не лише про при-датність її для осіменіння самок, а й про можливість використання плідника, від якого отримано цю сперму, для відтворення стада. З наявних методів оцінювання якості сперми у виробничих умовах найширше застосування знайшли:
1) візуальне оцінювання сперми за зовнішніми ознаками;
2) мікроскопічне оцінювання густини сперми та рухливості сперміїв; 3) визначення концентрації сперміїв.
Інші методи (біохімічні, бактеріологічні і т. п.) використовуються у наукових до-слідженнях або у випадку необхідності.
Візуальне оцінювання сперми за зовнішніми ознаками (загальне, санітарне чи окомірне оцінювання).
Одержану від плідника сперму, у першу чергу, оцінюють за кольором, запахом, консистенцією та об’ємом еякуляту.
Колір сперми – характерний для кожного виду тварин і залежить, головним чи-ном, від концентрації у ній сперміїв. Сперма барана – біла з жовтуватим відтінком; бугая – молокоподібна, інколи жовтувата; у жеребця та кнура – сірувато-біла, нагадує колір сильно розрідженого молока. Червонуватий або ж буро-червоний колір сперми
Сперма. Фізіологія та біохімія сперми
|
|
|
вказує на домішки крові, які можуть зустрічатись при частих садках чи крововиливах у статевій системі. Зеленуватий колір може бути ознакою домішок гною, а жовтува-тий – сечі. Сіруватий або голубуватий відтінок сперми є також ознакою дуже низької у ній концентрації сперміїв (олігоспермія).
Запах сперми. Нормальна сперма не має запаху, хоча у барана вона може мати за-пах жиропоту, у бугая – свіжо видоєного молока. При наявності запальних гнійних процесів у сім’яниках чи додаткових статевих залозах сперма може набувати гниль-ного запаху, а при попаданні у сперму сечі вона пахне аміаком.
Консистенція сперми залежить від ступеня розрідження її секретами додаткових статевих залоз. Сперма барана, звичайно, густа, сметаноподібна; бугая – вершкопо-дібна; жеребця – водяниста, часто з домішками слизу; кнура – водяниста, з драглисто-клейкими зернами.
Поява у спермі пластівців свідчить про запальні процеси у додаткових статевих за-лозах, частіше всього – міхурцевих. Домішки калу, бруду і т. п. зустрічаються при анти-санітарних умовах утримання плідників та недотриманні правил одержання сперми.
Таблиця 9 Характеристика сперми свійських тварин за зовнішніми ознаками
|
|
|
| Вид тварини | Об’єм еякуляту, мл | Колір | Запах | Консистенція |
| Баран | 1 (0,5–4) | Білий з жовтуватим відтінком | Без запаху або запах жиропоту | Густа сметаноподібна |
| Бугай | 4 (2–15) | Молочно-білий, іноді жовтуватий | Без запаху або запах свіжовидоєного молока | вершкоподібна |
| Кнур | 150–1000 | Сірувато-білий | водяниста з драглисто-клейкими зернами | |
| Жеребець | 40–600 (до–600) | водяниста з домішками слизу |
Об’єм еякуляту – кількість сперми, виділеної плідником за одну садку. Він за-лежить від ступеня розрідження густої маси сперміїв секретами додаткових статевих залоз. Для вимірювання об’єму еякуляту користуються чистими, сухими, теплими градуйованими циліндрами, мензурками, піпетками, колбами для змішування, граду-йованими спермоприймачами. Об’єм еякуляту у кнура та жеребця вимірюють після фільтрації – для відокремлення густих секретів цибулинно-сечівникових залоз.
Мікроскопічне оцінювання сперми за густиною та рухливістю сперміїв. Під густиною сперми розуміють насичення її статевими клітинами. Цей показник, як і
|
|
|
 Розділ 4
Розділ 4
Г
С
Р
1 2
Рис. 28. Оцінювання густини сперми бугая (1) та кнура (2):
Г – густа сперма, С – середня, Р – рідка.
рухливість сперміїв, має пряме відношення до запліднюваності самок. Визначення густини сперми і рухливості сперміїв проводять око-мірно в роздавленій краплі за допомогою мі-кроскопа при збільшенні у 180–300 разів при температурі 38–40 ºС.
Оцінювання сперми за густиною. Застосо-вується лише при дослідженні нерозрідженої сперми. При цьому розрізняють: густу, серед-ню та рідку сперму (див. рис. 28).
Густа сперма (позначають буквою Г) – все поле зору мікроскопа заповнене густою масою сперміїв і між ними майже не видно вільних проміжків; спермії рухаються суцільноюмасою, розрізнити рух окремих сперміїв неможливо.
Середня сперма (С) – між сперміями до-бре помітні проміжки, у яких може помісти-тися по довжині один спермій, і рух окремих сперміїв добре розрізняється.
Рідка сперма (Р) – у полі зору мікроскопа спостерігаються окремі спермії, віддаль між якими перевищує довжину одного спермія. Відсутність у полі зору сперміїв називається аспермією.
|
|
|
Таблиця 10 Показники густини сперми різних видів тварин
(кількість сперміїв у 1 мл сперми, млрд)
| Види тварин | Густа | Середня | Рідка |
| Баран | понад 2,0 | 1–2,0 | менше 1,0 |
| Бугай | понад 1,0 | 0,5–1,0 | менше 0,5 |
| Кнур | понад 0,21 | 0,11–0,21 | менше 0,11 |
| Жеребець | понад 0,25 | 0,11–0,25 | менше 0,10 |
Для розрідження (розбавлення) можна використовувати сперму барана лише гус-ту, а сперму бугая, жеребця та кнура – густу та середню.
Визначення рухливості (активності) сперміїв.
Під рухливістю сперміїв розуміють здатність їх до прямолінійного поступального руху. Чим менше у спермі таких сперміїв, тим менше шансів на запліднення.
Сперма. Фізіологія та біохімія сперми
 Оцінювання рухливості сперміїв прово-дять у роздавленій краплі одночасно з визна-ченням густини сперми. При цьому визнача-ють “на око” лише процент сперміїв з пря-молінійно-поступальним рухом. Оцінювання проводять за десятибальною системою: за
Оцінювання рухливості сперміїв прово-дять у роздавленій краплі одночасно з визна-ченням густини сперми. При цьому визнача-ють “на око” лише процент сперміїв з пря-молінійно-поступальним рухом. Оцінювання проводять за десятибальною системою: за
кожних 10 % сперміїв з прямолінійно-посту-пальним рухом ставлять один бал; найвищий бал – 10.
У свіжоотриманій густій спермі барана та бугая важко встановити процентне співвідно-шення сперміїв з різними видами руху. У поді-бних випадках керуються такими критеріями: при наявності у спермі активного вихрового руху сперміїв ставлять найвищу оцінку – 10; при дещо сповільненому вихровому русі став-лять бал 9 або 8 і т. д.
Слід мати на увазі, що у окремих еякуля-тах, особливо густих, спермії не встигають ви-йти повністю зі стану анабіозу. У таких випад-ках на предметному склі зміщують дві краплі теплого 2,9 %-го розчину цитрату натрію чи
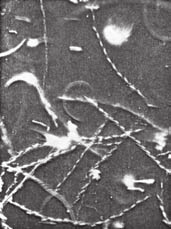
Рис. 29. Фотограма рухливості спер-міїв (видно спермії з поступальним, манежним рухом і мертві).
0,9 %-го розчину натрію хлориду з краплею сперми, накривають накривним скельцем і розглядають під мікроскопом.
Заморожену сперму оцінюють після розморожування.
Рухливість сперміїв у спермі, розфасованій у відкритих гранулах, визначають піс-ля розморожування її у 2,9 %-му розчині натрію цитрату і, не проводячи додаткового розрідження, при оцінюванні сперми, замороженої в облицьованих гранулах, оболон-ка яких зроблена з оптично прозорого полімерного матеріалу. Протирають гранулу стерильною серветкою, затискають її за допомогою спеціального зажиму між двома предметними стеклами, кладуть на столик мікроскопа і досліджують.
Сперму, розфасовану у пайетах (соломинках), оцінюють за рухливістю вибірково, змішавши на предметному склі краплю сперми з краплею 2,9 %-го натрію цитрату і визначивши рухливість сперміїв.
Визначення концентрації сперміїв. Концентрацію сперміїв визначають у кожному еякуляті з тим, щоб знати у скільки разів можна її розріджувати. Для цього існує декіль-ка методів, основними серед яких є підрахунок кількості сперміїв у лічильній камері.
При визначенні концентрації сперміїв в лічильній камері Горяєва, для зручності підрахунку, сперму слід розбавити і позбавити спермії рухливості. З цією метою її розріджують у змішувачі (меланжері) 3 %-ним розчином хлористого натрію (сперму бугая – у 100 разів, барана – 200, кнура та жеребця – у 20 разів), вносять її під накрив-
А
1 2 3 4 5 6 7
Б
1 2 3 4 5 6 7 8
В 2 5
6 7 8 9 10 11
Г
1 2 3 4 5 6 7 8 9
Д
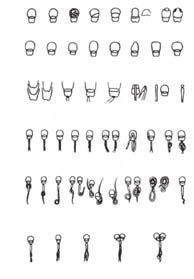
Рис. 30. Патологічні форми сперміїв бугая (за Бретшнейдером):
А – ковпачок голівки: 1 – нормальний, 2 – широкий, 3 – гранульований, 4 – косий, 5 – маленький, 6 – не-прикріплений, 7 – виродковий; Б – форма і величина голівки: 1–3 – нормальна, 4 – вузька, 5 – грушоподібна, 6 – ланцетоподібна, 7 – лопатоподібна, 8 – колбоподіб-на; В – основа голівки і шийка: 1 – нормальна, 2–3 – зву-жена, 4 – вузька, 5 – широка, 6 – симетрична, 7 – неси-метрична, 8 – з надламом, 9 – з перегином, 10 – з роз-ломом, 11 – відсутність голівки; Г – тіло: 1 – нормаль-не, 2 – коротке, 3 – широке, 4 – тонке, 5 – виродкове, 6 – розриви, 7 – перегини, 8 – осьовий тип, 9 – розще-плене; Д – хвостик: 1 – крапелька на шийці, 2 – на тілі, 3 – на хвостику, 4 – при згинах хвостика, 5 – петлеподіб-ний, 6 – у формі завитка, 7 – хвостик навколо голівки, 8 – рудиментарний; Е – виродкові спермії: 1 – одного-ловий двохвостий, 2 – одноголовий трихвостий, 3 – од-ноголовий чотирихвостий, 4 – двоголовий двохвостий,
5 – двоголовий чотирихвостий.
1 2 3 4 5 6 7 8
Е
не скельце камери, поміщають на пред-метний столик мікроскопа і при малому збільшенні у затемненому полі підрахо-вують кількість сперміїв у п’яти великих
 1 2 3 4 5 (80 малих) квадратах, розміщених по діагоналі. Підраховують концентрацію
1 2 3 4 5 (80 малих) квадратах, розміщених по діагоналі. Підраховують концентрацію
за формулою (див. В. А. Яблонський “Практичне акушерство…”, 2002).
Значно точнішим і набагато швидшим є визначення концентрації сперміїв за до-помогою електрофотоколориметра (що базується на врахуванні оптичної щільності сперми) чи швидкісного автоматичного лічильника клітин – целоскопу.
Визначення процента живих і мертвих сперміїв. Якщо змішати сперму з тим чи іншим мікробіологічним барвником, то наявні у ній мертві спермії зафарбуються у колір барвника, а живі залишаться блідими, оскільки їх оболонка непроникна для цих барвників. Цю властивість фарб використано для визначення процента живих і мерт-вих сперміїв. У арсеналі дослідників є цілий ряд методів такого диференціювального фарбування сперміїв. Найчастіше користуються 5 %-им водним розчином еозину за В. А. Морозовим чи еозин-нігрозиновою фарбою за В. А. Яблонським (еозин – 5 г, нігрозин – 3 г, дистильована вода – 100 мл).
На сухе знежирене предметне скло наносять (ближче до одного краю) краплю сперми і поряд краплю фарби. Швидко змішують їх краєм шліфованого предметного скла і, дещо відступивши від краплі, роблять тонкий мазок. Мазок повинен бути на-стільки тонким, щоб міг швидко висохнути на повітрі, у противному випадку живі спермії можуть загинути раніше, ніж висохне мазок.
Після висихання мазка його розглядають під мікроскопом при збільшенні у 400– 600 разів і підраховують окремо кількість живих (незафарбованих) і мертвих спер-
Сперма. Фізіологія та біохімія сперми
міїв (із зафарбованими та напівзафарбованими голівками) та визначають процент мертвих сперміїв.
Визначення процента патологічних форм сперміїв. У спермі плідників завжди є певна кількість ненормальних, патологічних форм сперміїв та різних включень, осо-бливо при порушенні режиму використання плідників і, безумовно, при виникненні тих чи інших хворобливих процесів, у першу чергу у статевій системі. Тому всі плід-ники племпідприємства не рідше одного разу на місяць, повинні піддаватися відпо-відному дослідженню. Кількість патологічних форм сперміїв у їх еякуляті не повинна перевищувати наведених у таблиці 11 показників.
Найчастіше трапляються аномалії хвостової частини спермія, основи його голів-ки та шийки (див. рис. 30). Наприклад, двоголові, двохвостові, карликові, гігантські, спермії з грушоподібною, колоподібною голівкою і т. п. Л. А. Чорномаз виявляв спер-міїв із слабо вираженим перфораторієм, а то й без нього.
Блом запропонував ділити спермії за їх морфологією на три види: нормальні, з первинними патологічними змінами та з вторинними змінами. До первинних змін він відніс зміни величини та форми голівки, тіла і хвостика та їх забарвлення. Це – гігант-ські спермії, карликові, з круглою, грушоподібною або зрізаною голівкою, безголові, двоголові, двохвості і т. п. Такі зміни сперміїв виникають при розладах сперміогенезу у сім’яниках (запальних процесах у них), а також при авітамінозах, порушеннях тер-морегулюючої функції калитки.
До вторинних змін він відніс сперміїв з закрученими та обламаними хвостиками, з відокремленими ковпачками, безхвостих, з проксимальною протоплазматичною кра-плею. Подібні зміни виникають при розладах процесу дозрівання сперміїв у придатку сім’яника, ураженнях придатків сім’яників та сперміовивідних шляхів, патології до-даткових статевих залоз, при порушенні режиму використання плідників (що буває часто), а також способу отримання сперми і послідуючого поводження з нею.
До конкретних причин появи патологічних форм сперміїв відносять також недо-статній розвиток сім’яників, ураження їх патологічними процесами (наприклад, бру-цельозний орхіт та епідидиміт у баранів), тривалі інтервали у використанні плідників (зокрема баранів) чи, навпаки, статеве виснаження плідника при великому наванта-женні, особливо при природному паруванні, нарешті, недотримання технології робо-ти зі спермою, зокрема, порушення ізотонічності середовищ та робочих розчинів, що може викликати закручування хвостиків сперміїв.
З невластивих включень до сперми найчастіше виявляють клітини плоского та перехідного епітелію, клітини сім’яних канальців, форменні елементи крові, гіалінові кульки та амілоїдні тільця, зерна лецитину, кристали сперміну і т. п.
Свіжоодержану сперму, для зручності підрахунку, розріджують 1 %-им розчином хлористого натрію і роблять з неї на предметному склі тоненький мазок, який після висушування та фіксації спиртом зафарбовують азуреозином чи метиленовою синь-кою і, розглядаючи під мікроскопом, підраховують кількість нормальних та патоло-гічних форм.
Розділ 4
Крім згаданого, при мікроскопічному дослідженні сперми можна виявити такі відхилення її якості:
Ø асперматизм (Азм) – відсутність сперми;
Ø олігосперматизм (Озм) – малий об’єм еякуляту; Ø аспермія (А) – відсутність сперміїв у спермі;
Ø олігоспермія (О) – мала кількість сперміїв у еякуляті; Ø некроспермія (Н) – мертві спермії;
Ø тератоспермія (Т) – патологічні спермії.
Визначення виживання сперміїв поза організмом самця. Запліднююча здатність сперміїв тісно пов’язана з їх виживанням, що у свою чергу залежить від їх стійкості до зовнішніх впливів. Тому на племпідприємствах періодично визначають абсолют-ний показник виживання сперміїв кожного плідника. Крім того, цей метод застосову-ють при оцінюванні якості розріджувачів. Існує декілька методів такого тестування. Класичним вважається визначення виживання сперміїв (тривалість збереження рух-ливості сперміїв у годинах) при різних ступенях розрідження (від 2 до 1024) при 37 ºС та при 2–4 ºС до повного відмирання усіх сперміїв.
При цьому беруть 11 чистих сухих стерильних пробірок місткістю 2 мл і в усі з них, окрім першої, вносять по 0,5 мл розріджувача. У першу (порожню) та другу про-бірки вносять по 0,5 мл досліджуваної сперми. Змішують у 2-й пробірці сперму з роз-ріджувачем і переносять з неї 0,5 мл розрідженої сперми у 3-тю пробірку, з неї (після змішування суміші) переносять 0,5 мл у 4-ту пробірку і т. д., щоб отримати серію розріджень: нерозріджена сперма і розріджена у 2, 4, 8, 16, 32, 64, 128, 256, 512, 1024 разів. Зразу ж після розрідження беруть з кожної пробірки краплю сперми, оцінюють у ній рухливість сперміїв під мікроскопомпри 38–40 ºС. Закривають усі пробірки сте-рильними корками і ставлять у холодильник на зберігання при температурі +2–4 ºС.
Через кожних 24 години визначають рухливість сперміїв при 38–40 ºС з кожної пробірки. Повторюють так кожної доби аж до загибелі усіх сперміїв.
На підставі даних записів визначають за спеціальною формулою абсолютний по-казник виживання та відносний показник виживання сперміїв (розріджена сперма у порівнянні з нерозрідженою).
Сперма бугая та барана доброї якості при розрідженні її у 16–32 рази повинна мати абсолютний показник виживання сперміїв не нижче 1400, кнура – не нижче 900, жеребця – не нижче 400.
При оцінюванні виживання сперміїв за спрощеною формулою визначають на-скільки знижується рухливість сперміїв за період зберігання.
Обчислений таким чином показник зниження рухливості сперміїв у балах у се-редньому на добу зберігання є показником виживання. Якщо рухливість сперміїв зни-зилася всередньому за добу більше ніж на 0,6 бала, то виживання сперміїв добре, при зниженні на 0,6–0,9 бала – задовільне, якщо більше 0,91 – виживання погане.
Нарешті, у практичних умовах виживання сперміїв визначають за проміжком часу (у годинах), протягом якого спермії зберігають прямолінійно-поступальний рух при
Сперма. Фізіологія та біохімія сперми
інкубації їх при +38 ºС. Рухливість сперміїв визначають при цьому через кожну годи-ну. Придатною до використання вважають сперму з рухливістю після розморожуван-ня не менше 4-х балів, а після 5-годинного інкубування – не нижче 0,5 бала.
У науковій роботі для оцінювання якості сперми застосовують цілий ряд морфо-логічних, фізіологічних, біохімічних, імунологічних досліджень.
Санітарну оцінку сперми та технологічних процесів, що застосовуються при штучному осіменінні, проводять з використанням методів бактеріології.
Таблиця 11 Мінімальні показники нативної сперми, придатної до використання
| Показники | Види тварин | |||
| Бугай | Баран | Кнур | Жеребець | |
| Об’єм еякуляту, мл | 0,6 | |||
| Колір сперми | білувато-жов-туватий | Білий | молочно-білий, сіруватий | сірувато-білий |
| Запах | свіжого молока | жиропоту | – | – |
| Консистенція | вершкоподібна | сметано-подібна | водяниста з до-мішками клей-ких зерен | водяниста з до-мішками слизу |
| Концентрація спер-міїв, млрд / мл | 0,5 | 1,0 | 0,1 | 0,05 |
| Рухливість сперміїв, бали | ||||
| Виживання у розрі-дженій спермі при 2–5 ºС, відносне, год. абсолютне, год. | ||||
| % патологічних сперміїв, не більше | ||||
| Вміст апатогенних мікроорганізмів у 1 мл, не більше тис. | ||||
| Колі-титр | 0,1 | 0,1 | 0,1 | 0,3 |
| Максимальний % недозрілих сперміїв |
Усі дослідження сперми проводяться з дотриманням чинних стандартів та ін-струкцій щодо штучного осіменіння тварин.
Розділ 4
Проте ні один із застосовуваних у даний час методів не відповідає головній вимозі: Ø дати швидку відповідь про запліднюючу здатність сперміїв;
Ø не бути громіздким;
Ø тісно корелювати з фактичною запліднюваністю самок.
Визначити точно запліднюючу здатність сперміїв, навіть стосовно певної групи самок, що перебувають у контрольованих умовах утримання, догляду та осіменін-ня, наявними клінічними методами важко тому, що на цей показник впливає багато факторів.
Одні автори вважають, що запліднююча здатність сперміїв становить 70–75 % від першого осіменіння, інші доводять, що у клінічно здорових корів при повноцінному статевому циклі вона становить не менше 90 %, лише у значної частини тварин буває рання ембріональна смертність.
У зв’язку з цим у практиці тваринництва запліднюючу здатність сперміїв оціню-ють за кількістю корів, які не прийшли повторно в охоту через 18–22 та 60–90 днів після осіменіння, а також ректальним дослідженням на тільність. Але в таких ви-падках важко віддиференціювати потенціальні здатності самців від запліднюваності самок. Тобто, на плодючість бугаїв нашаровується здатність корів до запліднення.
Дата добавления: 2016-01-04; просмотров: 28; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
