Примеры решения типовых задач. Задача № 1. Определить изменение энтропии в реакции дегазации фосгена аммиаком при температурах 298 К и 600 К согласно уравнению:
Задача № 1. Определить изменение энтропии в реакции дегазации фосгена аммиаком при температурах 298 К и 600 К согласно уравнению:
COCl2(г) + 4NH3(г) = CO(NH2)2(т) + 2NH4Cl(т)
Выяснить, возможен ли самопроизвольный процесс в изолированной системе?
Решение:
1) Рассмотрим случай Т = 298К
Находим значения стандартных энтропий веществ в справочнике:
 = 104,6 Дж/моль . К;
= 104,6 Дж/моль . К; 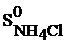 = 95,8 Дж/моль . К
= 95,8 Дж/моль . К
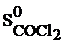 = 283,64 Дж/моль . К;
= 283,64 Дж/моль . К; 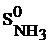 = 192,56 Дж/моль . К
= 192,56 Дж/моль . К
 =
=  + 2
+ 2 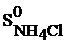 – (
– ( 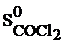 + 4
+ 4 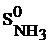 ) =
) =
=104,6 +2 . 95,8 – (283,64 + 4 . 192,56) = –758,06 Дж/моль . К
Произведем расчет при Т = 600 К
Находим средние значения теплоемкостей реагентов 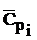 и определяем
и определяем
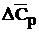 = 63,14 + 2 . 84,1 – (67,5 + 4 . 40,31) = 32,6 Дж/моль . К
= 63,14 + 2 . 84,1 – (67,5 + 4 . 40,31) = 32,6 Дж/моль . К
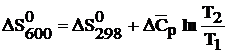 = –758,06 + 32,6
= –758,06 + 32,6 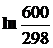 = –735,26 Дж/моль . К
= –735,26 Дж/моль . К
Задача № 2.Азот (0,001 м3) смешан с 0,002 м3 кислорода при 270С и давлении 1,013 . 105 Н / м2. Найти общее изменение энтропии системы.
Решение:
При смешении газы будут диффундировать друг в друга. Межмолекулярным взаимодействием газов можно пренебречь, так как при данных условиях газы можно принять за идеальные.
Поэтому общее изменение энтропии при смешении газов будет равно сумме изменений энтропий каждого газа при его расширении до объема смеси. Так как процесс изотермический, то из уравнения:
DS = nR . 2,3 lg V2/V1;
для каждого газа получаем:
DS (N2)= nR . 2,3 lg V2/V1;
DS (O2)= nR . 2,3 lg V2/V1.
Из уравнения pV = nRT получаем n = pV / RT
n (N2) = 0,001 . 1,013 . 105 / 8,314 . 300 = 0,0405;
n (O2) = 0,002 . 1,013 . 105 / 8,314 . 300 = 0,081;
DS (N2) = 0,0405 . 8,314 . 2,3 lg 0,003 / 0,001 = 0,371 Дж;
|
|
|
DS (O2) = 0,081 . 8,314 . 2,3 lg 0,003 / 0,002 = 0,274 Дж;
DS = 0,371 + 0,274 = 0,645 Дж.
Пример 1. Определить изменение энтропии при превращении 2 г воды в пар при изменении температуры от 0 до 150 °С и давлении в 1,013·105 н/м2, если скрытая удельная теплота парообразования воды ΔН = 2,255 кдж/г, мольная теплоемкость пара при постоянном давлении
СР = 30,13 + 11,3 · 10-3 Т дж/моль·град.
СР жидкой воды = 75,30 дж/моль·град.
Считать приближенно теплоемкость воды постоянной.
Решение. Данный процесс состоит из трех стадий:
1). Нагревания жидкой воды от 0 до 100°С,
2). Перехода жидкой воды в пар при 100°С,
3). Нагревания водяного пара от 100 до 150°C.
1. Изменение энтропии в стадии 1 рассчитывается по формуле (III,2), учитывая, что СР = const,
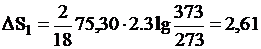 дж/град.
дж/град.
2. Изменение энтропии в стадии 2 определяется по формуле (III,4)
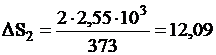 дж/град.
дж/град.
3. Изменение энтропии в стадии 3 рассчитывается по формуле (III,6)
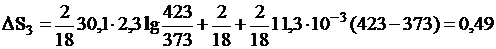 дж/град
дж/град
Общий прирост энтропии составит
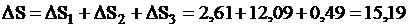 дж/град.
дж/град.
Пример 2. В одном из сосудов емкостью 0,1 м3 находится кислота, в другом емкостью 0,4м3 – азот. В обоих сосудах температура 17°С и давление 1,013·105 н/м2. Найти изменение энтропии при взаимной диффузии газов из одного сосуда в другой при P и N = const. Считать оба газа идеальными.
Решение. Изменение энтропии определяем по формуле (III,8). Число молей каждого газа находим из уравнения Менделеева-Клапейрона
|
|
|
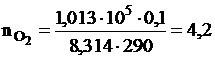 моль,
моль,
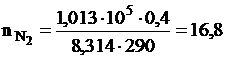 моль,
моль,
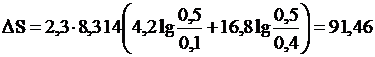 дж/град.
дж/град.
Пример 3. Вычислить изменение энтропии в процессе изотермного расширения 2 моль метана при Р1 = 101,3·105 н/м2 до Р2= 1,013·105 н/м2. Газ считать идеальным.
Решение. По формуле (III,6) при T = const находим
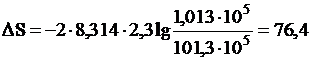 дж/град.
дж/град.
Задача № 3.Определите изменение энтальпии, внутренней энергии и энтропии при переходе 2,7 кг воды, взятой при р1= 1,0133 . 105 Н/м2 и Т1 = 293 К в пар при р2= 0,50665 . 105 Н/м2 и Т2 = 373 К. Принять, что Срж ≈ Сvж = 4,187 . 103 Дж/кг . град. Удельная теплота испарения l = 2260,98 . 103 Дж/кг. Считать пар идеальным газом.
Решение:
Изменение свойства системы не зависит от пути процесса, а определяется только начальным и конечным состоянием системы. Поэтому выбираем любой путь, состоящий из отдельных обратимых стадий, и тогда изменение свойства в данном процессе будет равно сумме изменений свойства в каждой стадии.
Пусть рассматриваемый процесс состоит из следующих обратных стадий:
1) нагрев воды при р1 = 1,0133 . 105 Н/м2 от Т1 = 293 К до Т2 = 373 К;
2) превращение воды в пар при р1 = 1,0133 . 105 Н/м2 и Т2 = 373 К;
3) изотермическое расширение водяного пара при Т2 = 373 К от р1 = 1,0133 Н/м2 до р2 = 0,50665 Н/м2;
|
|
|
∆Н = ∆Н1 + ∆Н2 + ∆Н3;
∆Н1 = m ∫293373 Cpж dT = 2,7 . 4,187 . 103 (373-293) = 904,392 . 103 Дж;
∆Н2 = m . l = 2,7 . 2260,98 . 103 = 6104,646 . 103 Дж;
∆Н3 = 0,
т. к. согласно закону Джоуля, энтальпия и внутренняя энергия идеального газа при постоянной температуре не зависят от давления и объема.
Следовательно,
∆Н = 904,392 . 103 + 6104,646 . 103 = 7009,038 . 103 Дж;
∆U = ∆U1 + ∆U + ∆U3, т. к. Срж ≈ Сvж.
∆U1 = ∆Н1 = 904,392 . 103Дж;
∆U2 = ∆Н2 - р∆V = ∆Н – р(Vп - Vж).
Объемом жидкой фазы пренебрегаем.
∆U2 = ∆Н2 - рVn = ∆Н2 - nRT2 = 6104,646 . 103 – 2,7/18 . 8,314 . 103 . 373 =
= 5639,419 . 10 Дж;
∆U3 = 0;
∆U = 904,392 . 103 + 5639,419 . 103 = 6543,811 . 103 Дж;
∆S = ∆S1 + ∆S2 + ∆S3;
∆S1 = m ò 293373 Cp dT/T = m Cp . 2,303 . lg T2/T1 = 2,7 . 4,187 . 103 . 2,303 .
. lg 373 /273 = 3,525 . 103 Дж/град ;
∆S2 = ∆Н2 /Т2 = 6104,646 . 103 /373 = 16,366 . 103 Дж/град ;
∆S3 = nR lg р1/р2 = 2,7/18 . 8,314 . 103 . 2,303 lg 1,0133 . 105/0,50665 . 105 =
= 0,865 . 103 Дж/град ;
∆S = 3,525 . 103 + 16,366 . 103 + 0,865 . 103 = 20,756 . 103 Дж/град.
Задача № 4. Определите изменение энтропии при смешении одного киломоля аргона, взятого при Т(Ar) = 293 К и р (Ar) = 1,0133 . 105 Н/м2 с двумя киломолями азота, находящимися при р (N2) = 1,0133 . 105 Н/м2 и Т (N2) =323 К. Давление смеси равно рсмеси = 1,0133 . 105 Н/м2. Принять аргон и азот идеальными газами, а теплоемкость каждого газа – величиной, постоянной в указанном интервале температур и равной: СV (N2) = = 20,935 . 103 Дж/кмоль . град., СV (Ar) =12,561 . 103 Дж/кмоль . град.
|
|
|
Решение:
Изменение энтропии ∆S в этом процессе равно изменению энтропии аргона и энтропии азота:
∆S = ∆S (Ar) + ∆S (N2);
Обозначим через р(Ar) и р(N2) парциальные давления компонентов после смешения газов.
Для решения задачи необходимо найти температуру смеси, которая определяется по уравнению:
СV(Ar) . n(Ar) . (Tсм–T(Ar))=СV(N2) . n(N2) . (T(N2)–Tсм)=12,561 . 103(Тсм -293)= = 20,935 . 103 . 2 (323 - Тсм);
Тсм = 316,07;
∆S (Ar) = Cp(Ar) ln Tсм / T(Ar) + R ln p0(Ar)/ p(Ar);
∆S (N2) = 2 (Cp(N2) ln Tсм / T(N2) + R ln p0(N2)/ p(N2));
Cp = Cv + R.
Парциальное давление каждого газа определяем по закону Дальтона:
p(Ar) = p . N(Ar) = 1,0133 . 105 . 0,333 = 0,3374 . 105 Н/м2,
p(N2) = p – p(Ar) = (1,0133 – 0,3374) . 105 = 0,6579 . 105 Н/м2,
∆S(Ar) =20,876 . 103 . 2,303 lg 316,07/293+8,314 . 103 . 2,303lg 3 =
= 10,761 . 103 Дж/град ;
∆S(N2) = (29,250 . 103 . 2,303 lg 316,07/ 323 + 8,314 . 103 . 2,303 lg 3/2 ) . 2 =
= 5,598 . 103 Дж/град ;
∆S = (10,761 + 5,598) . 103 = 16,359 . 103 Дж/град.
Задача № 5. Найдите ∆F и ∆G для одного киломоля бензола при следующем изотермическом процессе:
C6H6 (ж, р1 = 1,0133 . 105 Н/м2) = С6Н6 (г, р2 = 0,9120 . 105 Н/м2).
Нормальная температура кипения Тнтк = 353,3 К.
Решение:
Представим себе, что процесс идет в две стадии:
1) C6H6 (ж, р1 = 1,0133 . 105 Н/м2) = С6Н6 (г, р1 = 1,0133 . 105 Н/м2);
2) C6H6 (г, р1 = 1,0133 . 105 Н/м2) = С6Н6 (г, р2 = 0,9120 . 105Н/м2),
т. к. ∆G не зависит от пути процесса, то ∆G = ∆G1 + ∆G2; dG = Vdp – SdT.
В первой стадии и Т, и р не изменяются, следовательно ∆G1 = 0. Во второй стадии Т не изменяется, следовательно, dG = Vdp. Если принять, что пары бензола – идеальный газ, то, осуществив замену V = RT/ p, получим:
∆G2 = òG1G2 dG = òp1p2 RT dp/p = RT ln p2/p1 = 8,314 . 103 . 2,303 . 353,3 .
. lg 0,912 . 105 / 1,0133 . 105 = - 309,86 . 103 Дж.
Соответственно ∆F = ∆F1 + ∆F2; dF = -pdV – SdT.
В первой стадии Т и р постоянны (Т, р = const ). Т. к. Vп >> Vж, то
∆F1 = - òV п V ж pdV = p∆V/V = - p(Vп + Vж) = -pVп = - RT =
= - 8,314 . 103 . 353,3 = - 2937,69 . 103 Дж/кмоль.
∆F2 = - òV 1 V 2 RT dln V = - RT ln V2/ V1
T = const V2/ V1 = p2/ p1
∆F2 = - RT ln V2/ V1 = RT ln p2/ p1 = 8,314 . 103 . 353,3 . 2,303 lg 0,912 .
. 105 / 1,0133 . 105 = - 309,86 . 103 Дж/кмоль.
∆F = - 2937,69 . 103 – 309,86 . 103 = - 3247,55 . 103 Дж/кмоль.
Задача № 6.Определите ∆H, ∆U, ∆F, ∆G и ∆S при стандартных условиях для реакции:
С2Н2 + 2 Н2О (ж) = СН3СООН (ж) + Н2.
Необходимые данные возьмите из справочника.
Решение:
Сведем справочные данные в таблицу:
| Вещество | ∆H 298, Дж/кмоль | ∆G 298, Дж/кмоль | ∆S 298, Дж/кмоль .град |
| C2H2 (г) Н2О (ж) СН3СООН (ж) Н2 | 226,910 . 106 -286,043 . 106 -487,367 . 106 0 | 209,350 . 106 -237,361 . 106 -392,741 . 106 0 | 200,963 . 103 69,990 . 103 159,943 . 103 130,680 . 103 |
∆H 298 = å (∆H 298)образ. прод. реак. - å (∆H 298)образ. исх. веществ =
= [ (- 487,367) – (- 2 . 286,043 + 226,910) ] . 106 =
= 142,191 . 106 Дж/кмоль
∆U 298 = ∆H 298 - p∆V = ∆H 298 - ∆nRT
При расчете ∆n учитываются стехиометрические коэффициенты только газообразных веществ.
∆n = n (Н2) – n (С2Н2) = 1 - 1=0.
Следовательно, ∆U 298 = ∆H 298.
∆G 298 = ∑ ∆G 298 образ. прод. реак. - ∑ ∆G 298 образ. исх. веществ =  [ (- 392,741) –
[ (- 392,741) –
- (- 2 . 237,361+ 209,350) ] . 106 = - 127,369 . 106 Дж/кмоль.
∆ F 298 = ∆G 298 - p∆V.
Как было доказано, в данной реакции p∆V = 0, следовательно:
∆G 298 = ∆ F 298.
∆S 298 = ∑ ∆ S 298 прод. реак. - ∑ ∆ S 298 исх. веществ = [ ( 130,680 + 159,943) –
- ( 200,963 + 2 . 69,990) ] . 103 = - 50,023 . 103 Дж/кмоль . град.
Задача № 7.Один килограмм воды, взятой при 00С, переведен в состояние перегретого пара с температурой 200 0С и давлением 1,013 . 105 Н/м2. Вычислить изменение энтропии этого перехода, если удельная теплота испарения воды при 1000С равна 2257 Дж/г, удельная теплоемкость воды равна 4,187 Дж/г . град, а удельная теплоемкость водяного пара при давлении в 1,013 . 105 Н/м2 равна 1,968 Дж/г . град.
Решение:
Общее изменение энтропии будет складываться из трех составляющих:
DS1 – изменение энтропии при нагревании воды до Т кипения.
DS2 – изменение энтропии при переходе воды из жидкого состояния в парообразное.
DS3 – изменение энтропии при нагревании сухого пара от 100 до 2000С, то есть DS = DS1 + DS2 + DS3; DS1 = nCp . 2,3 lg T2 / T1,
если предположить, что система подчиняется законам идеальных газов и что объем воды при нагревании не изменяется. Мольная теплоемкость Ср равна удельной теплоемкости, умноженной на массу одного моля:
Ср = 4,187 . 18 = 75,4 Дж / моль град; n = 1000 / 18 = 55,6 моль;
DS1 = 55,6 . 75,4 . 2,3 lg 373 / 273 = 1305,5 Дж.
DS1 находим из уравнения: DS1 = DН / Т. Мольная теплота испарения равна:
DН исп. = 2256,7 . 18 = 40620 Дж / моль;
DS2 = DН исп./ Т = 55,6 . 40620 / 373 = 6055 Дж.
При нагревании сухого пара от 100 до 2000С при постоянном давлении изменение энтропии равно: DS3 = nCp . 2,3 lg T2 / T1,
Мольная теплоемкость пара:
Ср = 1,968 . 18 = 35,42 Дж / моль;
DS3 = 55,6 . 35,42 . 2,3 lg 473 / 373 = 464,3 Дж;
DS = 1303,5 + 6055 + 464,3 = 7824,8 Дж.
Задача № 7.Определите изменение энтальпии и внутренней энергии при нагревании азото–водородной смеси, состоящей из одного киломоля N2 и трех киломолей H2 от Т1 = 2980 до Т2 = 5000, если Cp (H2) = 29,176 . 103 – 0,8380 . T + 2,0131 . 10- 3 T2; Cp (N2) = 27,3159 . 103 – 5,2337 . T – 0.004187 . 10- 3 T2.
Решение:
DН = DН (N2) + DН (H2) = ∫500298 Cp (N2) dT + 3 ∫500298 Cp (H2) dT =
= ∫500298 (Cp (N2) + 3 Cp (H2))dT = ∫500298 [3 (29,176 . 103 – 0,8380 . Т +
+ 2,0131 . 10- 3 Т2) + (27,315 . 103 – 5,2337 Т – 0,004187 . 10- 3 Т2) dT] =
= 114,8439 . 103 (500 - 298) – 3,87385 (5002 - 2982) + 2,0145 (5003 –
- 2983) . 10- 3 = 23852,88 . 103 Дж;
DU = U2 – U1; U1 = H1 – p1V1; U2 = H2 – p2V2; pV = nRT;
DU = DН – p2V2 + p1V1 = DН – 4 RT2 + 4 RT1 = 23852,88 . 103 – 4 . 8,315 .103
(500 - 298) = 17134,36 . 103 Дж.
Дата добавления: 2018-02-15; просмотров: 7346; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
