ЗАВИСИМОСТЬ ТЕПЛОВОГО ЭФФЕКТА ХИМИЧЕСКОЙ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ. ТЕПЛОЕМКОСТЬ. УРАВНЕНИЕ КИРХГОФФА
Для расчета тепловых эффектов необходимо знать изменение теплоемкости в результате химического процесса, а так же зависимость теплоемкости от температуры.
Чтобы рассчитывать тепловые эффекты при разных температурах, пользуются законом Кирхгоффа.
Теплоемкость – это количество тепла, которое нужно подвести к одному молю вещества, чтобы повысить его температуру на один градус.
Различают теплоемкость при постоянном объеме: сV = 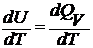 и постоянном давлении: cp =
и постоянном давлении: cp = 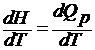 .
.
Для идеальных газов связь этих величин выражается уравнением Майера: cp – cv = R.
Различают среднюю теплоемкость системы, относящуюся к изменению температуры на некоторую конечную величину и равную отношению количества сообщенной теплоты к соответствующему изменению температуры: 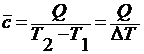 и истинную теплоемкость С, соответствующую беско-
и истинную теплоемкость С, соответствующую беско-
нечно малому изменению температуры: C = 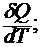 C =
C = 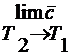 .
.
Рассмотрим соотношения между изменением теплоемкости системы при реакции и зависимостью теплового эффекта реакции от температуры:
1) Dcp = 0. Если теплоемкости исходных и конечных веществ одина
ковы, то Dcp = 0. В этом случае 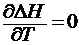 , т.е. тепловой эффект не изменяется с температурой (рис. 1.2.1)
, т.е. тепловой эффект не изменяется с температурой (рис. 1.2.1)
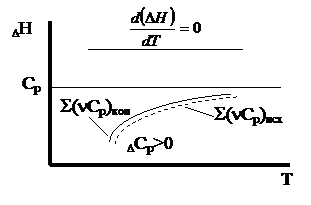 |
Рис. 1.2.1 Тепловой эффект реакции, при которой теплоемкости исходных и конечных веществ одинаковы.
2) Dcp = const: a)если Dcp > 0, т.е. (ånicpi)кон > (ånjcpj)исх, то 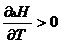 , т.е. с ростом температуры тепловой эффект возрастает (рис.1.2.2);
, т.е. с ростом температуры тепловой эффект возрастает (рис.1.2.2);
|
|
|
б) если Dcp < 0, т.е. (ånicpi)кон < (ånjcpj)исх, то 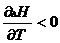 , т.е. с ростом
, т.е. с ростом
температуры тепловой эффект убывает (рис.1.2.3).
 |
3)  Если теплоемкости исходных и конечных веществ неодинаково изменяются с температурой (рис.1.2.4 и 1.2.5).
Если теплоемкости исходных и конечных веществ неодинаково изменяются с температурой (рис.1.2.4 и 1.2.5).
Рассмотрим закон Кирхгоффа в дифференциальной форме.
Запишем изменения энтальпии в изобарном и внутренней энергии в изохорном процессах:
∆Н = Н2 – Н1 (1.2.1)
∆U = U2 – U1 (1.2.2)
Продифференцируем уравнения (1.2.1) и (1.2.2) по температуре:
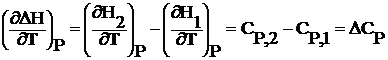 (1.2.3)
(1.2.3)
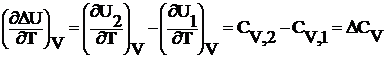 (1.2.4)
(1.2.4)
Уравнения (12.3) и (1.2.4) можно представить в несколько измененном виде:
|
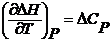
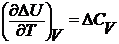
где 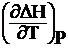 и
и 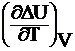 – температурные коэффициенты теплового эффекта изобарного и изохорного процессов.
– температурные коэффициенты теплового эффекта изобарного и изохорного процессов.
(1.2.5) – уравнения Киргхофа в дифференциальной форме.
При постоянном давлении дифференциальная форма уравнения Кирхгофа имеет следующий вид:
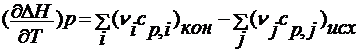 = Dсp,
= Dсp,
где cp – теплоемкость веществ при постоянном давлении.
Закон Кирхгоффаформулируется следующим образом: температурный коэффициент теплового эффекта процесса равен изменению теплоемкости системы, происходящему в результате этого процесса.
|
|
|
Закон Кирхгоффа в дифференциальной форме позволяет определить лишь изменение теплового эффекта с изменением температуры, а не величину самого теплового эффекта.
Чтобы найти значения теплового эффекта в зависимости от температуры, необходимо проинтегрировать уравнения (1.2.5).
Рассмотрим два случая.
Первый: ∆СР = const и ∆СV = const.
|
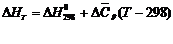
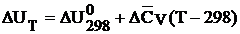
где 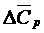 и
и 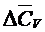 - средние теплоемкости, которые можно рассчитывать по уравнению:
- средние теплоемкости, которые можно рассчитывать по уравнению:
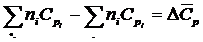
Второй: ∆СР ¹ const, ∆СV ¹ const.
|
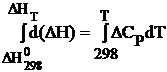
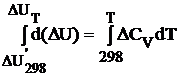
т.е., 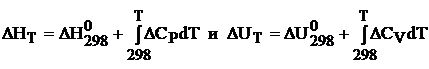 (1.2.8)
(1.2.8)
Уравнения (1.2.8) называют интегральными уравнениями Кирхгофа.
Решение данных уравнений может рассматриваться в условиях
При помощи уравнений (1.2.6) и (1.2.8) можно рассчитать тепловой эффект реакции при любой температуре, зная тепловой эффект реакции в стандартных условиях, который определяют по теплотам образования или сгорания.
Более точные результаты получаются, если использовать в расчетах интерполяционные уравнения:
DCp = Da + DbT + 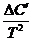 - для неорганических веществ;
- для неорганических веществ;
DCp = Da + DbT + DcT2 + DdT3 - для органических веществ.
Если теплоемкость DCp зависит от температуры согласно ряду:
DCp = Da + DbT + DcT2 + DdT3 + 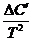
После интегрирования находим:
|
|
|
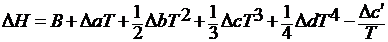
где B – постоянная интегрирования, которая определяется обычно по значению теплового эффекта при стандартных условиях.
Следует отметить, что последнее интерполяционное уравнение справедливо только в том интервале температур, для которого опытным путем найдены коэффициенты в уравнении для теплоемкостей. При исследовании температурной зависимости тепловых эффектов реакций чаще используется уравнение (28), так как большинство химических процессов протекает при постоянном давлении.
Контрольные вопросы
1. Что называется теплоемкостью системы?
2. Что представляют собой истинная и средняя теплоемкости? Как они связаны между собой?
3. Является ли теплоемкость функцией состояния?
4. Какие значения может принимать теплоемкость в изотермическом, изохорном, изобарном и адиабатическом процессах?
5. Напишите выражения для теплоемкостей сp и сv через термодинамические функции.
6. Какова связь сp и сv для вещества, находящегося в конденсированном состоянии?
7. Как связаны между собой при постоянном давлении теплоемкости жидкости и пара?
8. Приведите уравнения, описывающие зависимость теплоемкости от температуры в интервале от 0 К до Т > Ткип.
|
|
|
9. Докажите, что закон Кирхгофа является следствием первого закона термодинамики. При каких условиях тепловой эффект реакции не зависит от температуры? Каков физический смысл величины DH0 в выражении:
DHT = DH0298 + 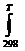 DCpdT.
DCpdT.
10. Как на основании стандартных теплот образования соединений из простых веществ и уравнений зависимости теплоемкости от температуры для исходных веществ и продуктов реакции определить постоянную интегрирования уравнения Кирхгофа для данной химической реакции и дать для этой реакции уравнение зависимости теплового эффекта от температуры? Укажите, в каком температурном интервале можно пользоваться уравнением.
11. Запишите температурные ряды теплоемкости для неорганических и органических веществ. Используя справочные данные, приведите температурные ряды теплоемкостей для NH3(г) и С2H6 (г).
12. Выведите уравнение Кирхгофа методом аналитических функций и методом круговых процессов.
13. Проанализируйте уравнение Киргоффа в дифференциальной форме при условии, что:
1) Dcp = 0;
2) Dcp = const (Dcp > 0, Dcp < 0 );
3) Dcp = f (T).
Изобразите указанные зависимости графически.
14. Проанализируйте следующие графики:
 |
15. Как на основании стандартных теплот образования соединений из простых веществ и уравнений зависимости теплоемкости от температуры для исходных веществ и продуктов реакции определить постоянную интегрирования уравнения Кирхгофа для данной химической реакции и дать для этой реакции уравнение зависимости теплового эффекта от температуры? Укажите, в каком температурном интервале можно пользоваться уравнением.
16. Выведите аналитическую зависимость теплового эффекта химической реакции от температуры, используя истинные теплоемкости.
17. В каких случаях расчет теплового эффекта химических реакций с помощью закона Гесса и следствий, вытекающих из него, может привести к неточным результатам?
18. Какими эмпирическими уравнениями зависимости теплоемкости от температуры пользуются при выводе интегрального уравнения Кирхгофа? Какова область (p и Т) применения этих эмпирических уравнений?
[11] 19. Напишите уравнения (в дифференциальной форме) зависимости теплового эффекта химической реакции от температуры при постоянном давлении и постоянном объеме.
Дата добавления: 2018-02-15; просмотров: 5728; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
