Примеры решения типовых задач. Задача № 1.Пользуясь стандартными теплотами образования соединений, вычислить тепловой эффект реакции при 25°С:
Задача № 1.Пользуясь стандартными теплотами образования соединений, вычислить тепловой эффект реакции при 25°С:
Fe2O3 (т) + 3CO (г) = 2Fe (т) + 3CO2 (г) + ΔHX
Если теплоты образования веществ следующие:
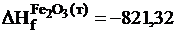 кдж/моль;
кдж/моль;
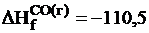 кдж/моль;
кдж/моль;
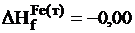 кдж/моль;
кдж/моль; 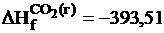 кдж/моль;
кдж/моль;
Решение. Согласно первому следствию из закона Гесса [уравнение (II,6)] искомый тепловой эффект реакции равен
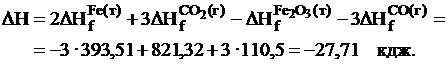
Задача № 2. При полном сгорании метана до углекислого газа и воды выделяется 890,78 Дж/моль. Известно, что при образовании воды из элементов выделяется 286,19 Дж/моль, а при полном сгорании углерода 393,3 Дж/моль. Определите тепловой эффект образования метана из С(графит) и Н2(газ).
Решение:
Составим термохимические уравнения, комбинированием которых получим искомое:
1. СН4(г) + 2О2(г) = СО2(г) + 2Н2О(ж); DН1 = 405,46 кДж/моль
2. Н2(г) + 1/2О2(г) = Н2О(ж); DН2 = –286,19 кДж/моль
3. С(графит) + О2(г) = СО2(г); DН3 = –393,30 кДж/моль
Чтобы получить исходное уравнение, необходимо 1 уравнение умножить на коэффициент (–1),2 умножить на (+2) и все три уравнения сложить. После проведенного комбинирования получим:
СН4(г) + 2О2(г) + 2Н2(г) + О2(г) + С(графит) + О2(г) = –СО2(г) – 2Н2О(ж) + 2Н2О(ж) + СО2(г);
С(графит) + 2Н2(г) = СН4(г)
DНх = –DН1 + 2DН2 + DН3 = 890,78 – 2 . 286,19 – 393,30 = –74,89 кДж/моль
Реакция является экзотермической, так знак теплового эффекта отрицательный. Теплота выделяется в окружающую среду.
Задача № 3. Пользуясь стандартными теплотами сгорания соединений, вычислить тепловой эффект реакции при 25°С:
|
|
|
C2H5OH (ж) + CH3COOH (ж) = CH3COOC2H5 (ж) + H2O (ж)
если теплоты сгорания веществ следующие:
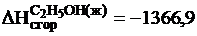 кдж/моль;
кдж/моль;
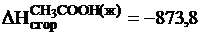 кдж/моль;
кдж/моль;
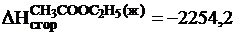 кдж/моль;
кдж/моль;
Решение. Согласно второму следствию закона Гесса искомый тепловой эффект реакции равен:
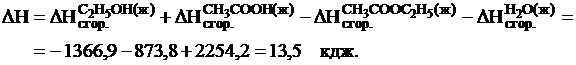
Задача № 4. Определить тепловой эффект реакции, протекающей в растворе 25°С, если реагирующие вещества находятся в виде ионов:
3Fe(NO3)2aq + 4HNO3aq = 3Fe(NO3)3aq + NO (г) + 2H2O (ж)
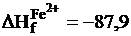 кдж/г-ион;
кдж/г-ион;
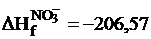 кдж/г-ион;
кдж/г-ион;
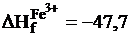 кдж/г-ион;
кдж/г-ион; 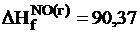 кдж/г-ион;
кдж/г-ион;
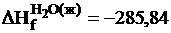 кдж/г-ион;
кдж/г-ион;
Решение. В ионном виде данное уравнение примет вид:
3Fe2+aq + 10NO-3aq + 4H+aq = 3Fe3+aq + 9NO (г) + 2H2O (ж)
Согласно первому следствию закона Гесса:
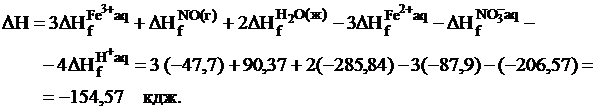
Задача № 2.Вычислить по энергиям химических связей стандартную теплоту образования этилового эфира при 25°С в жидком состоянии, если 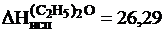 кдж/моль. Полученное значение теплоты образования сравнить с табличным значением
кдж/моль. Полученное значение теплоты образования сравнить с табличным значением 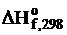 - 273,20 кдж/моль и рассчитать расхождение между табличной и вычисленной величинами.
- 273,20 кдж/моль и рассчитать расхождение между табличной и вычисленной величинами.
Решение. Составляем уравнение реакции образования этилового эфира из простейших веществ:
4С(граф) + 5H2 (г) + ½ O2 (г) = (C2H5)2O (ж) + ΔHx
Теплота возгонки углерода 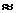 523 кдж/г·атом;
523 кдж/г·атом;
εН-Н = 431,9 кдж/моль: εО=О = 493,8 кдж/моль;
εС-Н = 357,98 кдж/моль; εС-С = 262,30 кдж/моль;
|
|
|
εС-О = 357,98 кдж/моль.
Используем следствие из закона Гесса:
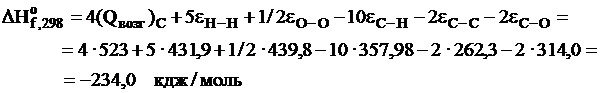
Полученное значение 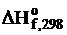 относится к газообразному этиловому эфиру;
относится к газообразному этиловому эфиру; 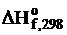 жидкого этилового эфира равно
жидкого этилового эфира равно
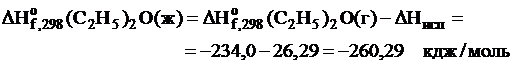
Рассчитываем расхождение между табличной и вычисленной величинами:
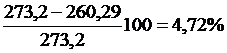 .
.
Задача № 3.Определите тепловой эффект реакции, протекающей по уравнению:
СН3СООН (ж) + С2Н5ОН (ж) = СН3СООС2Н5 (ж) + Н2О (ж)
D Н 0298 - 873,79 - 1366,91 - 2254,21
Решение: Согласно уравнению:
DН298 = (DН 0298 (СН3СООН) + DН 0298 (С2Н5ОН)) – (DН 0298 (СН3СООС2Н5) + DН 0298 (Н2О)) = (- 873,79 – 1366,91) – (- 2254,21) = 13,51 кДж/моль.
Задача № 4. Определите теплоту образования синильной кислоты (газ), если теплота сгорания ее равна 666,97 кДж/моль.
Решение:
При решении воспользуемся следствием из закона Гесса:
HCN(г) + 5/4О2 = 1/2Н2О(ж) + CО2 + 1/2N2; DН0х.р. = 666,9 кДж/моль
DН0х.р. = 1/2DН0f , 298(Н2О(ж)) + DН0f,298 (CО2) – DН0f, 298 (HCN(г)),
DН0f (HCN(г)) = 1/2DН0f (Н2О(ж)) – DН0f (CО2) – DН0х.р.
По справочнику находим:
DН0f ,298(Н2О(ж)) = –285,83 кДж/моль;
DН0f ,298(CО2) = – 393,51 кДж/моль;
DН0f ,298HCN(г)) = 1/2(–285,83) + 666,97 = 130,55 кДж/моль
Задача № 5. Используя значения теплот образованиявеществ, вычислить при Т=298 К и постоянных давлении и объеме тепловые эффекты гетерогенной реакции:
СаО(тв) + СО2(г)= СаСО3(тв)
|
|
|
Привести термодинамическую и термохимическую запись уравнения химической реакции.
Решение:
Выпишем из справочника величины стандартных теплот образования всех веществ, участвующих в реакции и представим их в виде таблицы.
| Теплоты образования, кДж/моль | Вещество | ||
| СаСО3(тв) | СаО(тв) | СО2 (г) | |
| D Н0f, 298 | -1210,1 | -634,1 | -393,1 |
Согласно закону Гесса:
DН0298(х.р.) = DН0 f, 298 (СаСО3) – ( DН0 f,298 (СаО) + DН0 f,298 (СО2) = (1210,1) –
- [ (-634,1) + (-393,1) ] = -182,9 кДж
D п = 0-1 = -1
DН0298 (х.р.) = DН0f,298 - D пRT = -182,9 + 8,314 * 10-3 * 298 = -180,422 кДж
Термодинамическая запись уравнения химической реакции:
СаО(тв) + СО2(г) = СаСО3(тв) ; DН0298 = -182,9 кДж
Термохимическая запись уравнения химической реакции:
СаО(тв) + СО2(г) = СаСО3(тв) + 182,9 кДж.
Задача № 6. Определить тепловой эффект химической реакции этерификации щавелевой кислоты метиловым спиртом, протекающей по уравнению:
2 СН3ОН + (СООН)2 (ж) = (СООСН3)2 (ж) + 2 Н2О(ж)
по теплотам сгорания.
Решение:
Выпишем из справочника величины стандартных теплот сгорания всех веществ, участвующих в реакции.
| Теплоты сгорания, кДж/моль | Вещество | ||
| (СООН)2 (ж) | СН3ОН(ж) | (СООСН3) 2 (ж) | |
| D Н0298, сгор. | - 251,88 | - 726,60 | - 1676,18 |
Согласно закону Гесса имеем:
DН0298 х.р. = [ ( -251,88) + 2 . (-726,60)] - [ (-1676,18) ] = 28,9 кДж
|
|
|
Дата добавления: 2018-02-15; просмотров: 18906; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
