Примеры решения типовых задач. Задача № 1.Приведите к нормальным условиям газ (вычислите объем V, который занимает данное количество газа при 273К и 1,0133
Задача № 1.Приведите к нормальным условиям газ (вычислите объем V, который занимает данное количество газа при 273К и 1,0133 . 105 Па), если при 373 К и 1,333 . 103 Па его объем равен 3 . 10-2 м3.
Решение: По уравнению (1) определяем объем газа:
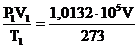 ,
,
V = 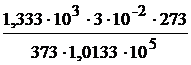 = 2,89 . 10-4 м3.
= 2,89 . 10-4 м3.
Задача № 2.Вычислите парциальные объемы водяного пара, азота и кислорода и парциальные давления азота и кислорода во влажном воздухе. Общий объем смеси 2 . 10-3 м3, общее давление 1,0133 . 105 Па, парциальное давление паров воды 1,233 . 104 Па. Объемный состав воздуха 21% О2 и 79% N2.
Решение: Вычисляем парциальный объем паров воды Vн2о по уравнению (5):
Vн2о Р = VPн2о,
Vн2о = 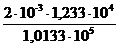 = 2,4 . 10-4 м3.
= 2,4 . 10-4 м3.
Вычисляем парциальные объемы О2 и N2:
Vо2 + Vн2о = V - Vн2о = 0,002 – 0,00024 = 1,76 . 10-3 м3,
Vо2 / VN2 = 0,21 / 0,79.
Отсюда
Vо2 = 1,76 . 10-3 . 0,21 = 0,37 . 10-3 м3;
VN2 = 1,76 . 10-3 . 0,79 = 1,39 . 10-3 м3.
Вычисляем парциальное давление О2 по уравнениям (3), (5):
Ро2 = Рхо2
хо2 = Vо2 / V = 0,369 / 2 = 0,184,
Ро2 = 1,0133 . 105 . 0,184 = 1,866 . 104 Па,
а так как Р = Ро2 + РN2 + Рн2о, то
РN2 = 1,0133 . 105 – 1,866 . 104 – 1,233 . 104 = 7,033 . 104 Па.
Задача № 3. Насколько энтальпия отличается от внутренней энергии в реакции гидрирования этилена:
C2H4(г) + Н2(г) = С2Н6(г) при 250С?
Находим 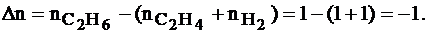
∆H – ∆U = ∆ nRT = –1 × 8,314 × 298 » –2478 Дж/моль.
Задача № 4.Чему равна работа при изотермическом (Т = 308 К) расширении от р1= 5,0665 . 105 Н/м2 до р2 = 1,0133 . 105 Н/м2
смеси, состоящей из 48 кг О2 и 2 кмолей N2 ?
Решение:
W = ånRT ln (p1/p2) = 3,5 . 2,303 . 8,314 . 103 . 308ln 5,0665/1,0133 . 105 =
= 14429,5 . 103 Дж
Задача № 5.Один моль водяных паров обратимо и изотермически сконденсировали в жидкость при 1000 С. Рассчитайте работу, теплоту, изменение внутренней энергии и энтальпии в этом процессе. Удельная теплота испарения воды при 1000 С равна 2260 Дж· г-1.
|
|
|
Решение:
В процессе Н2O(г) 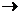 Н2O(ж) произошло обраимое сжатие газа при постоянном давлении p = 1 атм от объема V1 =
Н2O(ж) произошло обраимое сжатие газа при постоянном давлении p = 1 атм от объема V1 = 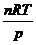 = 0,082 ∙373 = 30,6 л до объема одного моля жидкой воды V2 = 0,018 л. Работа сжатия при постоянном давлении равна:
= 0,082 ∙373 = 30,6 л до объема одного моля жидкой воды V2 = 0,018 л. Работа сжатия при постоянном давлении равна:
W = p (V2 – V1) = - pV1 = - 101,3 кПа ·30,6 л = -3100 Дж
При испарении одного моля воды затрачивается теплота 2260 Дж∙г-1· 18 г = 40700 Дж, поэтому при конденсации одного моля воды эта теплота выделяется в окружающую среду:
Q = - 40700 Дж.
Изменение внутренней энергии рассчитывается по первому закону:
ΔU = Q – W = -40700 – (-3100) = - 37600 Дж,
а изменение энтальпии – через изменение внутренней энергии:
∆H = ΔU + ∆(pV) = ΔU + pΔV = ΔU + W = Q = -40700 Дж
Изменение энтальпии равно теплоте, т.к. процесс происходит при постоянном давлении.
Задача № 6. На какую величину при Т =298 К отличается тепловой эффект сгорания нафталина при постоянном давлении Qp от теплового эффекта при постоянном объеме Qv согласно реакции:
 C10Н8(тв) + 12 О2 = 10 СО2 + 4 Н2О(ж) + Qp ?
C10Н8(тв) + 12 О2 = 10 СО2 + 4 Н2О(ж) + Qp ?

 Решение:
Решение:
Qp – Qv = nRT,
|
|
|
где п – число киломолей продуктов реакции минус число киломолей исходных веществ в газообразном состоянии.
 D п = 10-12 = -2;
D п = 10-12 = -2;
Qp – Qv = -2 . 8,314 . 103 . 298 = - 4955,7 . 103 Дж/кмоль
Задачи для самостоятельного решения
1. Два идеальных газа – одно- и двухатомный адиабатически расширяются. Для какого из этих газов работа расширения будет больше, если число молей обоих газов одинаково и одинаково понижение температуры?
2. 15 г кислорода находятся при 273 К и давлении 1,0133 . 105 Н/м2. Рассчитайте теплоту изотермического расширения азота до объема 12 м3.
3. 100 г азота находятся при температуре 298 К и давлении 1,0133 . 105 Н/м2. Рассчитайте теплоту изотермического процесса, в котором давление увеличивается в 1,5 раза.
4. Температура аммиака в результате адиабатического расширения понизилась с 300 К до 270 К. Чему равно конечное давление, если начальное было равно 1,0133 . 105 Н/ м2. CpNH3 = 35,65 Дж/моль . К.
5. Десять грамм азота, взятого при 280 К, сжимаются адиабатически от 8 . 10-3 до 5 . 10-3 м3. Определить конечную температуру и затраченную работу, если сv = 5/2 R.
6. 5 л идеального одноатомного газа, взятого при нормальных условиях, нагреваются до 600 К при постоянном объеме. Каково конечное давление и количество затраченного тепла?
|
|
|
7. В калориметре смешаны 0,05 кг льда при 273 К и воды, взятой при 323 К. Определить конечную температуру, если удельная теплота плавления льда равна 334,7 кДж/кг . К.
8. Определить количество тепла, которое нужно сообщить двум молям аргона, чтобы повысить его температуру от 293 К до 373 К, если давление газа во время процесса остается постоянным (3,0399 . 105 Н/м2). Подсчитать также, какая часть тепла при этом расходуется на изменение внутренней энергии газа и какая часть на совершение работы расширения, на сколько литров увеличится объем газа.
9. Рассчитайте изменение энтальпии азота, если при давлении 1.0133 . 105 Н/м2 и температуре 298 К его объем увеличится от 1 м3 до 10 м3.
10. Пользуясь данными справочника, рассчитайте изменение энтальпии при конденсации одного моля воды при 298 К.
11. Рассмотрите связь DU и DH для следующих реакций:
· 2H2(г) + O2 (г) = 2 H2O(г)
· N2 (г) + О2 (г) = 2 NO(г)
· C(графит) + О2 (г) = CO2( г)
· 2 CuS(кр) + 3 O2(г) = 2СuO(тв) + 2 SO2(г)
· 4NO( г) + 6 H2O (ж) = 4 NH3(г) + O2(г)
12. Рассчитайте (в Дж/моль) разницу между значениями DU и DH для реакции: CH3COOC2H5(ж) + H2O (ж) = CH3COOH (ж) + C2H5OH (ж) , протекающей при 298 К. Как изменится эта разница, если температуру повысить до 500 К и все реагирующие вещества перевести в газообразное состояние?
13. Энтальпия какого из следующих газообразных веществ – метана или ацетилена – возрастет больше, если одинаковое число молей того и другого вещества нагреть от 296 до 300 К при постоянном давлении?
|
|
|
14. Рассчитайте изменение внутренней энергии при испарении 1 кмоль муравьиной кислоты при 373 К, пользуясь данными справочника.
15. Рассчитайте (Дж) разницу между тепловыми эффектами при постоянных давлении и объеме (Qp - QV) реакции: СH3CHO (г) + Н2 = С2H5OH (ж), протекающей при 298 К. Чему будет равна эта разница, если температуру поднять до 400 К и спирт перевести в газообразное состояние?
16. В каком из следующих четырех процессов работа расширения наибольшая:
a) 1 кмоль СO2 расширяется изотермически при 300 К от 10 до 100 м3;
b) 1 кмоль Н2 расширяется изотермически при 1000 К от 10 до 100 м3;
c) 4 кмоль СO2 расширяются изобарически при нагревании от 300 до 550 К;
d) 2 кмоль H2 расширяются изобарически при нагревании от 300 до 1300 К.
17. Если 2 моль гелия нагреть на 1 0С в закрытом сосуде емкостью 1 м3, то чему будет равна работа этого процесса ?
18. Теплоты испарения D2O и Н2O при 298 K cоответственно 45,41 и 44,00 кДж/моль. Можно ли ожидать, что при некоторой температуре Т
(298< Т< Ткр) теплоты испарения этих веществ станут равными? Аргументируйте ответ.
19. При 300 К газ в идеальном состоянии изотермически и обратимо расширяется от 10-2 до 10 –1 м3. Каково количество поглощенного при этом тепла?
Дата добавления: 2018-02-15; просмотров: 7372; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
