ХИМИЧЕСКОЕ РАВНОВЕСИЕ. ЗАКОН ДЕЙСТВУЮЩИХ МАСС. КОНСТАНТА РАВНОВЕСИЯ. СПОСОБЫ ВЫРАЖЕНИЯ КОНСТАНТ РАВНОВЕСИЯ
Химическое равновесие является частным случаем равновесий, рассматриваемых в термодинамике. Поэтому для него применимы все общие положения, вытекающие из второго закона термодинамики.
Возможность, направление и предел самопроизвольного протекания процессов, перехода энергии или вещества от одной части системы к другой зависят только от соотношения факторов интенсивности. Такими факторами являются температура (критерий перехода теплоты), давление (критерий перехода газа), потенциал заряда (критерий перехода электричества) и т.д.
Критерием самопроизвольного перехода данного компонента из одной фазы в другую является химический потенциал данного компонента, который тоже относится к факторам интенсивности. При умножении его на изменение количества этого компонента дает изменение соответствующего вида энергии.
Большая часть химических реакций обратима. Обратимые реакции– реакции, которые при определенных условиях протекают одновременно в двух направлениях: прямом и обратном.
В 1867 году Гульдбергом и Вааге была дана точная формулировка закона действующих масс: скорость химической реакции пропорциональна действующим массам реагирующих веществ. В ходе реакции концентрации исходных веществ уменьшаются, следовательно, уменьшается и скорость прямой реакции; концентрации продуктов реакции увеличиваются, увеличивается и скорость обратной реакции. Со временем в системе устанавливается химическое равновесие.
|
|
|
Различают два типа равновесия:
- гомогенное равновесие, в котором участвуют только газообразные реагенты;
- гетерогенное равновесие, в котором, наряду с газообразными, принимают участие реагенты в конденсированном состоянии.
Изменение энергии Гиббса или энергии Гельмгольца определяют возможность самопроизвольного и равновесного процессов. Их зависимость от числа молей компонентов характеризуется с помощью химического потенциала.
Химический потенциал –фактор интенсивности физико-химических процессов.
Первый закон термодинамики, устанавливающий взаимосвязь между внутренней энергией, теплотой и работой, справедлив при одном условии – неизменности составляющих систему веществ.
Между тем в ходе любой химической реакции количества реагирующих веществ и продуктов реакции все время изменяются.
С учетом изменения числа молей компонентов, изменение энергии Гиббса в соответствии с фундаментальным уравнением термодинамики имеет вид:
|
|
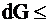 –
– 
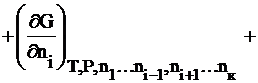
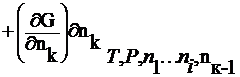 (3.1)
(3.1)
Знак «меньше» относится к самопроизвольному процессу, а знак «равенство» – к равновесному. Частная производная энергии Гиббса по одному из изменяющихся компонентов есть химический потенциал m.
|
|
|
Для i-го компонента химический потенциал равен:
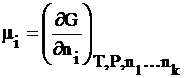 (3.2)
(3.2)
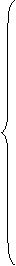 Получим: dG £ –SdT + VdP +
Получим: dG £ –SdT + VdP + 
dF £ –SdT - PdV + 
dU £ TdS – PdV + 
dH £ TdS +VdP + 
Помимо энергии Гиббса химический потенциал можно выразить через другие характеристические функции при неизменности соответствующих параметров:
mi = 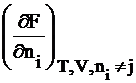 (3.3)
(3.3)
mi = 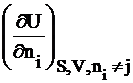 (3.4)
(3.4)
mi = 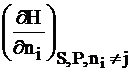 (3.5)
(3.5)
Химический потенциал – частная производная одной из характеристических функций (DG, DF, DН, DU), чаще энергии Гиббса, по изменению числа молей одного компонента при неизменном числе молей остальных компонентов и неизменности соответствующих параметров состояния.
Химический потенциал для идеального газа можно определить по уравнению:
mi = m0i + RTlnPi,
где m0i – cтандартный химический потенциал;
Pi – парциальное давление газа.
Для идеального раствора:
mi = m0i + RTlnCi,
где Сi – концентрация.
|
|
|
Для реального раствора:
mi = m0i + RTlnаi,
где аi – активность.
Рассмотрим основные черты химического равновесия.
Состояние химического равновесия определяется двумя признаками:
1) если система находится в состоянии равновесия, то состав ее с течением времени при постоянных внешних условиях не изменяется;
2) если система, находящаяся в равновесии, будет выведена из этого состояния вследствие внешних воздействий, то с прекращением их действия она возвратится к прежнему состоянию.
Устойчивое равновесное состояние характеризуется:
1) неизменностью состояния системы при сохранении внешних условий;
2) подвижностью равновесия (самопроизвольным восстановлением равновесия после прекращения воздействия);
3) динамическим характером равновесия;
4) различием в достижении равновесного состояния (самопроизвольный и несамопроизвольный процессы);
5) минимальным значением энергии Гиббса (или энергии Гельмгольца).
Химическое равновесие численно выражается константой равновесия. Обратимся к уравнению обратимых химических реакций:
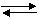 аА + вВ сС + dD,
аА + вВ сС + dD,
где а, в, с, d – стехиометрические коэффициенты.
Условием химического равновесия является равенство:
|
|
|
 = 0 (3.6)
= 0 (3.6)
Применительно к рассматриваемой реакции:
 = сmС + dmD – (amA + вmВ) = 0,
= сmС + dmD – (amA + вmВ) = 0,
где mА, mВ, mС, mD – химические потенциалы исходных веществ и продуктов реакции.
Для каждого химического потенциала можно записать:
mА = mА0 + RTlnPА,
Подставив каждое из значений химического потенциала в уравнение (6), получим:
с(mС0 + RTlnPС)+ d(mD0 + RTlnPD)– a(mA0 + RTlnPА) –
– в(mВ0 + RTlnPВ) = 0
Химические потенциалы в стандартных условиях mA0, mВ0, mD0, mС0, а также стехиометрические коэффициенты являются постоянными величинами. После группировки постоянных величин получаем:
(сmС0 + dmD0 – вmВ0 – аmA0) + RT(сlnPC + dlnPD – вlnPB – alnPA) = 0
или: 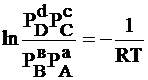 (сmС0 + dmD0 – вmВ0 – аmA0)
(сmС0 + dmD0 – вmВ0 – аmA0)
Правая часть полученного равенства при данной температуре является постоянной величиной. Обозначим ее через Кр. Тогда уравнение упростится:
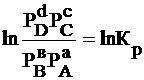
Равенство логарифмов означает и равенство их чисел:
 ,
,
где Кр – константа химического равновесия;
Рi – парциальные давления компонентов смеси.
Если количества реагирующих веществ выразить через равновесные концентрации, то константа равновесия будет выглядеть так:

Последние два уравнения выражают в различной форме закон действующих масс.
Константа равновесия – отношение произведения равновесных концентраций (или парциальных давлений) продуктов реакции к произведению концентраций (парциальных давлений) исходных веществ, взятых в степенях, равных их стехиометрическим коэффициентам, и в условиях равновесия (DG = 0 или DF = 0) постоянно.
Для реальных газов константы равновесия выражаются через фугитивности, а для реальных растворов – через активности.
Для реальных газов вместо давления вводят величину, называемую фугитивность (летучесть) f.
Фугитивность – это такое давление реального газа, при котором газ ведет себя как идеальный и является величиной, которую необходимо подставить в выражение для химического потенциала идеального газа, чтобы получить значение химического потенциала реального газа.
Фугитивность имеет размерность давления и связана с давлением реального газа соотношением:
f = g . P,
где g – безразмерный коэффициент фугитивности, зависящий от Р и Т. При f ® Р свойства реальных газов приближаются к свойствам идеальных, а g ® 1.
Химический потенциал i-го компонента в газовой среде реального газа записывается:
mi = m0i + RTlnfi
Для перехода от идеальных растворов к реальным введено понятие активность:
а = g . С,
где g – коэффициент активности.
Активность – это такая концентрация, при использовании которой реальные растворы приобретают термодинамические свойства идеальных растворов и является величиной, которую следует подставить в выражение для химического потенциала компонента в идеальном растворе, чтобы получить действительное выражение химического потенциала реального раствора.. Активность имеет размерность концентрации.
Химический потенциал можно выразить через активность:
mi = m0i + RTlnаi = m0i + RTlnсi + RTlngi
Таким образом, понятия фугитивности и активности позволяют использовать представления и математический аппарат химической термодинамики для определения химического равновесия и констант равновесия реальных систем.
Взаимосвязь Кр и Кс. С учетом уравнения PV = DnRT парциальное давление 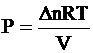 ; С =
; С = 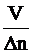 – молярная концентрация, Р = СRT.
– молярная концентрация, Р = СRT.
Подставив последнее выражение в формулу для константы равновесия, получим:
Кр = Кс(RT)Dn
Взаимосвязь между Кр, Кх и Кс устанавливается с помощью закона Дальтона и уравнения состояния идеального газа:
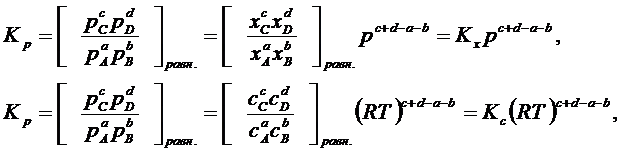
Дата добавления: 2018-02-15; просмотров: 2253; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
