Взаимодействие солей между собой
Опыт2 К раствору сульфата натрия добавьте раствор хлорида бария
В пробирке наблюдаете _______________________________________________________________
Уравнения реакций в молекулярном и ионном виде
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Опыт3 К раствору хлорида натрия добавьте нитрат серебра.
В пробирке наблюдаете _______________________________________________________________
Уравнения реакций в молекулярном и ионном виде
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Опыт4 К раствору фосфата калия добавьте нитрат серебра.
В пробирке наблюдаете _______________________________________________________________
Уравнения реакций в молекулярном и ионном виде
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Взаимодействие солей с металлами
Опыт №5
В пробирку с раствором сульфата меди (ІІ) опустите железную скрепку
В пробирке наблюдаете _______________________________________________________________
Уравнения реакций в молекулярном и ионном виде
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
|
|
|
Сделайте вывод по лабораторной работе.
Лабораторная работа 8
Тема : Обратимость химических реакций
Цель: Изучить признаки необратимых реакций, научиться определять необратимые химические реакции.
Оборудование: штатив для пробирок, пробирки.
Реактивы : растворы карбоната калия, сульфата натрия, хлорида натрия, серной кислоты , азотной кислоты, хлорида бария, сульфата меди (II), хлорида цинка, сульфата алюминия. гидроксид калия, сульфата железа (II)
Ход работы:
Инструктаж по ТБ
Выполнение работы.
Задание 1 Необратимость ионных реакций а) образование малорастворимых веществ.
В 3 пробирки добавьте по одному мл следующих растворов: № 1 -сульфата меди (II), № 2 - хлорида цинка, № 3 - сульфата алюминия. Добавьте к ним растворы: в первую - гидроксид калия, во вторую - карбонат натрия, в третью - хлорид бария. Запишите наблюдения (цвет и характер осадка).
Пробирка №1 Наблюдения:______________________________________________________________
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
|
|
|
Пробирка №2 Наблюдения:______________________________________________________________
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Пробирка №3 Наблюдения:______________________________________________________________
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
б) реакции с образованием газов. В пробирку налейте 1 мл раствора карбоната натрия, Добавьте к ней раствор азотной кислотыВ пробирке наблюдаете ______________________
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
в) реакции, идущие с образованием малодиссоциирующих веществ. В пробирку добавьте 1 мл сульфата железа (II) и немного гидроксида калия. Запишите наблюдения. В пробирке наблюдаете __________________
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
|
|
|
Прилейте в пробирку азотной кислоты до растворения осадка. В пробирке наблюдаете ____________
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Задание 2 Между какими из перечисленных веществ: сульфат меди (II) ,гидроксид калия , сульфат натрия , серная кислота ,хлорид натрия возможны в водных растворах необратимые химические реакции
Пробирка №1 Наблюдения:______________________________________________________________
---------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Пробирка №2 Наблюдения:______________________________________________________________
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Лабораторная работа 9
Тема : Получение, собирание и распознавание газов.
|
|
|
Цель: Научиться опытным путем получать, собирать и распознавать различные газы.
Оборудование: пробирки, штатив, газоотводные трубки, лучинка, спиртовка, спички, пробки.
Реактивы : железо, соляная кислота, известняк, известковая вода, пероксид водорода, оксид марганца (IV ), растворы сульфата аммония, гидроксида калия, лакмус.
Ход работы:
Инструктаж по ТБ
Выполнение работы.
Получение углекислого газа
В пробирку внесем 1-2 кусочка мела и добавим 1мл.соляной кислоты.
В полученный газ опустим зажженную лучину.
Наблюдаете _____________________________________
Уравнение реакции в молекулярном и ионном виде:
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Выделяющийся газ пропустите через известковую воду.
Наблюдаете _____________________________________
----------------------------------------------------------------------------------------------------------------------------------------------
Получение кислорода
В пробирку нальем 1-2 мл. Н2О2 добавим немного оксид марганца (IV ) .
В полученный газ опустим зажженную лучину
.Наблюдаете _____________________________________
----------------------------------------------------------------------------------------------------------------------------------------------
Получение водорода
В пробирку положите железную скрепку и добавьте раствор соляной кислоты.
Наблюдаете _____________________________________
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Получение аммиака.
2-3 капли раствора соли аммония вносят в пробирку, осторожно, не касаясь стенок пробирки, добавляют 3-4 капли раствора KOH, закрывают пробирку ватным тампоном и кладут сверху полоску универсальной индикаторной бумаги, смоченную дистиллированной водой.
Наблюдаете _____________________________________
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Сделайте вывод по лабораторной работе.
Лабораторная работа 10
Тема : Решение экспериментальных задач
Цель: Закрепление знаний о химических свойствах и способах получения неорганических соединений..
Оборудование: штатив для пробирок, пробирки.
Реактивы : растворы нитрата алюминия , гидроксида калия , азотной кислоты
хлорида железа (ІІІ) , родонита калия , гексоцианоферрата-(ІІ) калия K4 [Fe (CN) 6]
Инструктаж по ТБ
Выполнение работы.
Задание 1 Получите гидроксид алюминия и докажите его амфотерность.
1 . К раствору сульфата алюминия добавьте раствор гидроксида калия . Наблюдаете ____________________
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Докажем, что гидроксид алюминия - амфотерный гидроксид. Разделим осадок на 2 части.
К 1 части осадка добавьте раствор азотной кислоты . Наблюдаете _____________________________________
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Ко второй части осадка добавьте раствор щелочи . Наблюдаете _____________________________________
----------------------------------------------------------------------------------------------------------------------------------
Задание 2
Как осуществить превращения:
хлорид железа (ІІІ) → гидроксид железа (ІІІ) → нитрат железа (ІІІ) → роданид железа (ІІІ)
А) К раствору железа (ІІІ) добавьте раствор гидроксида калия. Наблюдаете ____________________________
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Б) К гидроксиду железа (ІІІ) добавьте раствор азотной кислоты. Наблюдаете ____________________________
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
В пробирку добавьте раствор родовита калия KSCN. Наблюдаете ____________________________________
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Лабораторная работа № 11
Тема: «Изготовление моделей молекул углеводородов»”.
Цель работы: Научиться составлять модели молекул органических веществ.Научиться записывать структурные формулы углеводородов и назвать их по международной номенклатуре.
Оборудование : Набор шаростержневых моделей молекул, пластилин разных цветов, спички, таблица “Предельные углеводороды”, периодическая таблица
Ход работы.
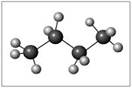 Задание №1. Составьте модели молекул: а) бутана,
Задание №1. Составьте модели молекул: а) бутана,
структурная формула_______________________________________
молекулярная масса _________________________________________
б) циклопропана.
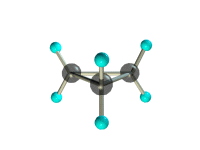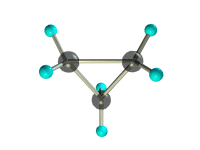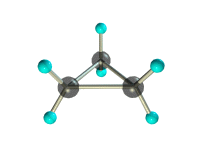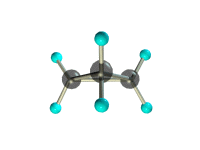 структурная формула_______________________________________
структурная формула_______________________________________
молекулярная масса _________________________________________
Задание №2. Назовите вещества:
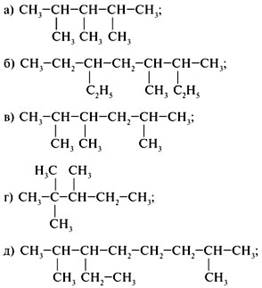
Задание №3. Составьте структурные формулы веществ:
а) 4-метилоктан напишите структурные формулы 3 его изомеров;
б) 3,3 – диметилгептан напишите структурные формулы 2 его изомеров;
Задание №4. Решите задачи:
Задача 1 Определить массовую долю углерода и водорода в метане.
Задача 2. Сажа применяется для производства резины. Определить сколько г сажи (С) можно получить при разложении 22 г пропана?
Лабораторная работа №12,13
Тема: Природные источники углеводородов. Ознакомление с коллекцией образцов нефти и продуктов её переработкиОзнакомление с коллекцией каучуков и образцами изделий из резины.
Цели работы : обобщить и систематизировать знания об углеводородах; ознакомиться с образцами нефти, с коллекцией каучуков и образцами изделий из резины, уметь самостоятельно работать с новыми источниками информации
Оборудование: коллекции: «Нефть и продукты ее переработки», коллекция каучуков и образцами изделий из резины.
Ход работы :
Выполнение работы:
Задание № 1. Ознакомление с различными видами природных источников углеводородов.
Заполните таблицу
| ПИУ | Природный и попутный газы | Нефть | Уголь |
| 1. Агрегатное состояние и состав | |||
| 2. Запасы | |||
| 3. Переработка | |||
| 4. Применение |
Задание № 2. Ознакомление с коллекцией «Нефть и продукты ее переработки»
1. Рассмотрите выданную вам коллекцию. Заполните таблицу № 2.
| Продукты НЕФТЕПЕРЕРАБОТКИ | Свойства (агр. сост., цвет, особенности) | Применение |
| 1. Газ | ||
| 2. Бензин | ||
| 3. Лигроин | ||
| 4. Керосин | ||
| 5. Мазут | ||
| 6. Гудрон |
Задание №3. Вам предлагается коллекция каучуков. Заполните таблицу
Важнейшие виды каучуков и их применение
| Название | Исходные вещества (мономеры) | Химическая формула полимера | Важнейшие свойства и применение | |||
| Бутадиеновый каучук | СН2 = СН — СН— СН2 1,3-бутадиен |
| ||||
| Диви-ниловый каучук | СН2 = СН — СН = СН2 1,3-бутадиен | 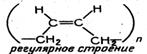
| ||||
| Изоп-реновый каучук | СН2 = С— СН = СН2 | СН3 2-метил-1,3-бутадиен | 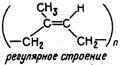
| ||||
| Хлоро преновый каучук | СН2 = С — СН = СН2 | Cl 2-хлор-1,3-бутадиен | 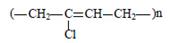
| ||||
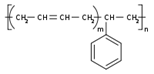
| Бутадиен-стирольный каучук | СН2 = СН— СН = СН2
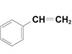 1,3-бутадиен
стирол 1,3-бутадиен
стирол
| 
|
Лабораторная робота № 14
ТЕМА: Свойства уксусной кислоты
Дата добавления: 2020-04-25; просмотров: 106; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!