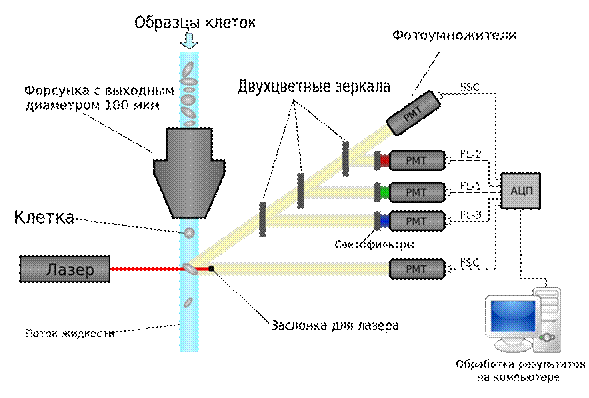
Преимущества проточной цитометрии
● быстрый анализ (до 30 000 событий в секунду);
анализ большого количества клеток (до 106–108 клеток в образце);
● количественное измерение интенсивности флуоресценции;
● получение данных для каждой конкретной клетки;
● одновременный анализ разных процессов;
разделение популяций, а значит, возможность анализировать происходящее только в минорной популяции, не проводя для этого дополнительных операций для ее выделения или концентрирования;
● удобная работа с данными — аккуратная статистическая обработка, качественная визуализация.
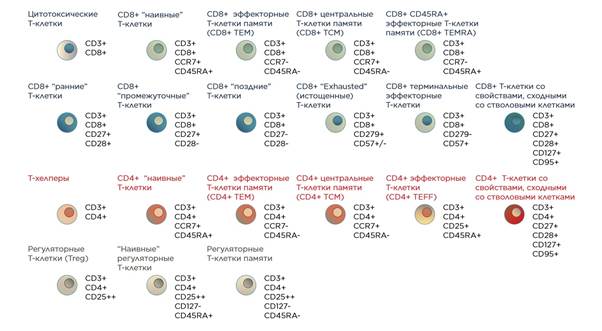
Субпопуляции Т-клеток периферической крови и поверхностные антигены, применяемые для их выявления. ⬆️
21) Иммуноферментный анализ, принцип метода, возможности использования.


22) Цепная полимеразная реакция. Принцип метода, возможности применения.
● Метод иммуно-ПЦР является комбинацией ИФА и ПЦР. Первый из них используется в том случае, если в клинической диагностике необходимо обнаружить гормоны, антитела, белки или токсины. Благодаря доступности антител различной специфичности этот метод позволяет обнаруживать широкий диапазон антигенов. Однако чувствительность ИФА сравнительно невысока. С другой стороны, широко применяемый метод ПЦР служит для обнаружения очень малых количеств ДНК. Теоретически даже одной копии обнаруживаемой ДНК в исследуемом образце достаточно, чтобы диагностировать вирусные и бактериальные заболевания либо наследственные болезни. Идея иммуно-ПЦР заключается в том, чтобы по-прежнему обнаруживать разнообразные антигены специфичными антителами, но положительный сигнал об этом обнаружении получать не при помощи фермента, как в ИФА, а при помощи ДНК-метки, как в ПЦР[4].
|
|
|
Реакция антитела с антигеномПравить
На первой стадии иммуно-ПЦР проводят иммунохимическую реакцию между анализируемым соединением в образце и антителом. По аналогии с ИФА её реализуют в различных вариантах. В прямом варианте (рис. 1, А) образец, содержащий определяемый антиген, наносят на поверхность планшета, а затем антиген определяют непосредственно специфичным антителом, меченным ДНК. Если специфичное антитело с ДНК-меткой недоступно, то его определяют вторичным (антивидовым) антителом, связанным с ДНК. Такой формат называется непрямым (рис. 1, Б). Для определения антигена в матрицах (сыворотка крови, плазма) используют «сэндвич» (рис. 1, В). Для этого на поверхности планшета предварительно иммобилизуют связывающие антитела, которые связывают антиген при нанесении образца в лунку. Возможен также и непрямой вариант сэндвича (рис. 2, Г)[5][6].
|
|
|

Рис. 1. Форматы анализа: А — прямой; Б — непрямой; В — прямой сэндвич; Г — непрямой сэндвич
Для определения низкомолекулярных веществ используют конкурентный формат. В этом случае детектирующее меченое антитело взаимодействует не только с антигеном в анализируемом образце, но и с антигеном, иммобилизованном на твёрдой фазе. Чем больше антигена в образце, тем больше комплексов антиген — антитело образуется в растворе. Следовательно, меньше антител связывается с твёрдой фазой, и анализ даёт более низкий сигнал[5].
В некоторых случаях для детекции антигенов можно использовать не антитела, а аптамеры. Например, РНК-аптамер R18 специфично связывается с кроличьим IgG. Такая модификация называется иммуно-аптамерной ПЦР[7].
Амплификация ДНК-меткиПравить
На второй стадии, когда антиген связан с конъюгатом антитела и ДНК-метки, проводят полимеразную цепную реакцию, в результате которой количество ДНК в смеси экспоненциально возрастает. В первых экспериментах продукты амплификации анализировали электрофорезом в агарозном геле, однако для этого приходилось переносить реакционные смеси в гель, а результаты получались качественными или полуколичественными. В качестве альтернативы электрофорезу была предложена ПЦР в реальном времени(ПЦР-РВ): этот метод позволяет установить не только наличие ДНК-метки, но и её количество. При проведении ПЦР-РВ в смесь добавляют интеркалирующий краситель (например, SYBR Green I) или зонд TaqMan — и количество ДНК определяют по интенсивности флуоресценции. Проводить стадию амплификации можно как в той же пробирке, что и иммунохимическую реакцию, а можно переносить ДНК-метку в другую пробирку. Во втором случае её нужно предварительно отщепить при помощи рестриктаз или нагреванием до 95—100 °С. При этом отмечается, что анализ в одной пробирке существенно менее чувствителен[7][8].
Теоретически для получения положительного сигнала достаточно, чтобы в реакционной смеси оказалась одна копия ДНК-метки. В действительности чувствительность метода снижается за счёт стадий, основанных на взаимодействии антигена с антителом. Полагают, что предел обнаружения иммунохимических методов в целом составляет около 1000 молекул аналита в 100 мкл смеси. Методики иммуно-ПЦР, описанные во многих публикациях, показывают чувствительность
|
|
|
●
●
, близкую к этому пределу обнаружения и даже ниже. Если принять, что типичный белок весит 50—100 кДа, то пересчёт предела обнаружения иммуно-ПЦР даст массу порядка пикограмма аналита. Этой чувствительности достаточно для обнаружения многих биомаркеров, присутствующих в организме в низкой концентрации[9].
|
|
|
●
●
Белки опухолейПравить
Самыми распространёнными антигенами для иммуно-ПЦР являются маркерные белки, имеющие отношение к опухолям и присутствующие на ранних стадиях их развития в очень низкой концентрации. Наиболее важны среди них раково-эмбриональный антиген (РЭА) и простатический специфический антиген(ПСА). В одном из исследований метод иммуно-ПЦР оказался примерно в 1000 раз более чувствительным к РЭА, чем ИФА[32], а позже чувствительность к РЭА была доведена до 13 фг/мл, что в 1500 раз превышает чувствительность клинических методов[33].
ПСА послужил аналитом для испытания трёх форматов иммуно-ПЦР, из которых наиболее чувствительным оказался формат с использованием ковалентного конъюгата антитела и ДНК (предел обнаружения составил 48·105 молекул)[34]. Система на основе магнитных наночастиц позволила определить 0,1 пМ ПСА, что в 1000 раз чувствительнее, чем ИФА[35].
Белки вирусовПравить
Иммуно-ПЦР применяют для определения вирусных белков, поскольку на ранних стадиях в организме присутствует очень малое число вирионов, и определить их можно только высокочувствительными методами. Одним из популярных антигенов этого типа является маркер вируса гепатита B HBsAg: работа нескольких групп позволила снизить предел обнаружения этого антигена методом иммуно-ПЦР до 15 фг на реакцию, а преимущество в чувствительности перед ИФА составило 2000 раз[36]. Кроме того, иммуно-ПЦР позволяет детектировать 10 нг HBcAg — другого белка, связанного с наличием в организме вируса гепатита B[37].
Антиген p24 является компонентом капсида вируса ВИЧ-1 и помогает выявить этот вирус на ранних стадиях. При помощи иммуно-ПЦР в разных опытах удалось обнаружить 1000 и 4600 молекул этого антигена[38]. Вирус Хантаан обычно обнаруживают методами иммуноанализа по нуклеокапсидному белку. Иммуно-ПЦР с использованием фагового дисплея позволила детектировать 10 пг/мл этого белка, а при использовании золотых наночастиц чувствительность повысилась до 10 фг/мл, что на семь порядков лучше, чем в случае ИФА[39]. В анализах на вирус птичьего гриппа H5N1 иммуно-ПЦР также превосходит ИФА и ПЦР в реальном времени в 1000 и 100 раз соответственно[40][41].
Также при помощи иммуно-ПЦР определяют аденовирусы, причём этот метод имеет преимущество перед ПЦР, поскольку для ПЦР необходимо выделить ДНК из образца, а в методе иммуно-ПЦР очистка от посторонних компонентов происходит на стадиях промывок. Чувствительность иммуно-ПЦР к ротавирусам, согласно литературным данным, совпадает с чувствительностью ПЦР. Также метод иммуно-ПЦР полезен для определения норовирусов[42].
Бактерии и токсиныПравить
Иммуно-ПЦР также используется для выявления патогенных микроорганизмов. Так, например, золотистый стафилококкможно определить по его многим ферментам, белкам и токсинам, прежде всего по белку А и энтеротоксину типа B. Первый из них удалось определить методом иммуно-ПЦР в концентрации 1·10−17 г/мл, а для второго были разработаны системы, позволяющие определять его как в чистых культурах, так и в образцах пищи[43][44]. Описан метод детектирования бактерии Borrelia burgdorferi — возбудителя болезни Лайма — по специфическим антителам IgG и IgM против этой бактерии[45][46].
Описаны также примеры определения бактериальных, растительных и микотоксинов. Например, ботулотоксин в деионизованной воде удалось определить в концентрации около 12 молекул/мл (0,02 фг/мл). В другом эксперименте анатоксин А определили при концентрации 90 пг/мл. Также токсины определяли в молоке (3,75 пг/мл для ботулинического токсина типа А, 750 пг/мл для ботулинического анатоксина типа В, 0,1 пг/мл для шига-токсина типа 2). Рицин в пищевых продуктах обнаруживали при концентрации 10-100 пг/мл. Опубликованы также данные по определению афлатоксина и полихлорированных бифенилов[47].
Метаболические белки и белки иммунной системыПравить
Диагностика некоторых болезней и нарушений основана на обнаружении не внешних антигенов, а компонентов самого организма, например ферментов, низкомолекулярных соединений и ионов. В некоторых случ
●
●
● аях для этих целей применим метод иммуно-ПЦР. Так, фактор некроза опухоли удалось обнаружить в концентрации до 1 фг/мл (в 50 тыс. раз чувствительнее, чем ИФА). Щелочную фосфатазу детектировали специфичным антителом IgG в количестве 10−11 U[48].
Некоторые антигены связаны с развитием генетических нарушений и болезней нервной системы. Высокая чувствительность иммуно-ПЦР позволяет определять очень низкие концентрации прионов в трудных для получения образцах тканей мозга и спинномозговой жидкости. Предложена методика, дающая возможность определить методом иммуно-ПЦР одновременно три основных белка, связанных с нервной системой: приона, нейрон-специфической енолазы и глиального фибриллярного кислого белка[48].
Важными маркерами нарушений нервной системы являются тау-белки: дефектные тау-белки (фосфорилированные по эпитопам либо изоформы этих белков) плохо стабилизируют микротрубочки, из-за чего возникают патологии. Иммуно-ПЦР позволяет определять дефектные изоформы тау-белков в концентрации 2-10 пг/мл. Бета-амилоид, один из инициаторов болезни Альцгеймера, удалось детектировать в концентрации 2 амоль/л[48].
Болезнь Фабри связана с дефектами в гене альфа-галактозидазы A. Обычно этот белок определяют методом ИФА, но иммуно-ПЦР даёт 25-кратное увеличение чувствительности[49].
Дата добавления: 2019-07-15; просмотров: 213; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
