Адсорбция как поверхностное явление
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ Московский государственный университет технологий и управления (образован в 1953 году)
Кафедра органической, физической и коллоидной химии
Дистанционное
Обучение
Хим.орг. – 5.22.2701.очн.плн. Хим.орг. – 5.22.2701.вчр.плн. Хим.орг. – 5.22.2701.зчн.скр. Хим.орг. – 5.22.2701.зчн.плн.
Хим.орг. – 5.22.2703.очн.плн. Хим.орг. – 5.22.2703.вчр.плн. Хим.орг. – 5.22.2703.зчн.скр. Хим.орг. – 5.22.2703.зчн.плн.
Хим.орг. – 5.22.2704.очн.плн. Хим.орг. – 5.22.2704.вчр.плн. Хим.орг. – 5.22.2704.зчн.скр. Хим.орг. – 5.22.2704.зчн.плн.
Хим.орг. – 5.22.2705.очн.плн. Хим.орг. – 5.22.2705.вчр.плн. Хим.орг. – 5.22.2705.зчн.скр .Хим.орг. – 5.22.2705.зчн.плн.
Хим.орг. – 5.22.2707.очн.плн. Хим.орг. – 5.22.2707.вчр.плн. Хим.орг. – 5.22.2707.зчн.скр. Хим.орг. – 5.22.2707.зчн.плн.
Хим.орг. – 5.22.2708.очн.плн. Хим.орг. – 5.22.2708.вчр.плн. Хим.орг. – 5.22.2708.зчн.скр. Хим.орг. – 5.22.2708.зчн.плн.
Хим.орг. – 5.22.2710.очн.плн. Хим.орг. – 5.22.2710.вчр.плн. Хим.орг. – 5.22.2710.зчн.скр. Хим.орг. – 5.22.2710.зчн.плн.
Хим.орг. – 5.22.2712.очн.плн. Хим.орг. – 5.22.2712.вчр.плн. Хим.орг. – 5.22.2712.зчн.скр. Хим.орг. – 5.22.2712.зчн.плн.
Хим.орг. – 5.22.0135.очн.плн. Хим.орг. – 5.22.0135.вчр.плн. Хим.орг. – 5.22.0135.зчн.скр. Хим.орг. – 5.22.0135.зчн.плн.
А.Д.ЗИМОН, А.М. ЕВТУШЕНКО,
И.Г. КРАШЕНИННИКОВА
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
КОЛЛОИДНАЯ ХИМИЯ
Раздел первый
Часть II
Учебно-практическое пособие для студентов технологических
Специальностей всех форм
|
|
|
Обучения

Www.msta . ru
Москва - 2004 4135
УДК: 541.18
© Зимон А.Д., , Евтушенко А.М., Крашенинникова И.Г. Учебно-практическое пособие – М., МГУТУ, 2004.
Вторая часть, первого раздела, учебного пособия, по коллоидной химии является логическим продолжением систематического изложения курса, начатого в первой части первого раздела - классификация пищевых дисперсных систем и поверхностные явления. В связи с этим нумерация глав дается в последовательности, учитывающей нумерацию предшествующей первой части, первого раздела пособия. Материал изложен с учетом особенностей многочисленных дисперсных систем, встречающихся в различных отраслях промышленного и сельскохозяйственного производства и в природных явлениях.
Пособие предназначено для студентов технологических специальностей 2, 3,4 курса всех форм обучения.
Авторы: Зимон Анатолий Давыдович, Евтушенко Анатолий Михайлович,
Крашенинникова Ирина Геннадьевна.
Рецензенты: Профессор, д.х.н. «Синтез полимеров» МГАТХТ ми. М.В. Ломоносова Прокопов Н.И.
Доцент, к.х.н. каф. «Органической и биологической химии» МГАВМиБ им. К.И. Скрябина Царькова М.С.
|
|
|
Редактор: Свешникова Н.И.
© Московский государственный университет технологий и управления, 2004
109004, Москва, Земляной вал, 73.
СОДЕРЖАНИЕ стр.
Раздел первый…………………………………………………………………………...4
Часть II 4
Г л а в а 4. 4
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ АДСОРБЦИИ.. 4
4.1. Адсорбция как поверхностное явление. 4
4.2. Фундаментальное уравнение адсорбции Гиббса. 6
4.3. Причины и механизм адсорбции. 9
4.4. Уравнения Генри, Фрейндлиха, Ленгмюра. 13
Г л а в а 5. 17
АДСОРБЦИЯ НА ГРАНИЦЕ ЖИДКОСТЬ — ГАЗ. 17
5.1. Особенности адсорбции на границе жидкости с газовой средой. 18
5.2. Адсорбция ПАВ. 20
5.3. Зависимость адсорбции от концентрации адсорбтива. 21
5.4. Предельная адсорбция. 22
5.5. Гидрофобные взаимодействия. 25
5.6. Методы определения поверхностного натяжения. 27
Г л а в а 6. 29
АДСОРБЦИЯ НА ТВЕРДЫХ ПОВЕРХНОСТЯХ.. 29
6.1. Особенности адсорбции на поверхности твердых тел. 30
6.2 Адсорбция газов. 32
6.3. Адсорбция жидкости. 35
6.4. Адсорбция ионов. 38
6.5. Ионообменная адсорбция. 40
6.6. Применение адсорбционных процессов. 43
Г л а в а 7. 46
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ И.. 46
ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ. 46
|
|
|
7.1. Поверхностная энергия и заряд поверхности. 46
7.2. Двойной электрический слой. 48
7.3. Электрокинетические явления. 52
7.4. Электрофоретическая подвижность. 56
ТЕСТЫ ДЛЯ САМОСТОЯТЕЛЬНОЙ ПРОРАБОТКИ.. 59
ОТВЕТЫ НА ТЕСТЫ ДЛЯ САМОСТОЯТЕЛЬНОЙ ПРОРАБОТКИ.. 62
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ. 62
СПИСОК ЛИТЕРАТУРЫ.. 64
Раздел первый
Часть II
Г л а в а 4
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ АДСОРБЦИИ
Адсорбция — очень распространенное явление, которое широко используется при очистке, разделении и концентрировании жидких и газовых сред. Для того чтобы разобраться в различных видах и особенностях адсорбционных процессов, следует рассмотреть их общие закономерности. Основополагающим в теории адсорбции является фундаментальное уравнение Гиббса, связывающее адсорбцию с изменением поверхностной энергии.
Адсорбция как поверхностное явление
Адсорбцией называют концентрирование* (сгущение) веществ на поверхности раздела фаз. Вещество, которое адсорбирует другое вещество, называют адсорбентом (рис. 4.1). Название адсорбируемого вещества зависит от его положения по отношению к адсорбенту. Если вещество находится в объеме и может адсорбироваться (его химический потенциал равен μiV, а концентрация с), то его называют адсорбтивом. Это же вещество в адсорбированном состоянии (его химический потенциал уже становится равным μiВ, а концентрация — сВ) будет называться адсорбатом. Иными словами, для обозначения положения адсорбируемого вещества используют термины адсорбтив (до адсорбции) и адсорбат (после адсорбции).
|
|
|
Молекулы (атомы, ионы, радикалы) адсорбата соприкасаются с поверхностью адсорбента и удерживаются на его поверхности. Поэтому концентрация молекул на поверхности становится больше, чем в объеме соприкасающейся с ней жидкости или газа (см. рис. 4.1). Часть молекул с поверхности может перейти обратно в объем. Процесс, обратный адсорбции, называют десорбцией.
В зависимости от агрегатного состояния адсорбента и адсорбтива различают адсорбцию на границе твердого тела и газа (Т—Г), жидкости и газа (Ж—Г) и твердого тела и жидкости (Т—Ж).
|
|
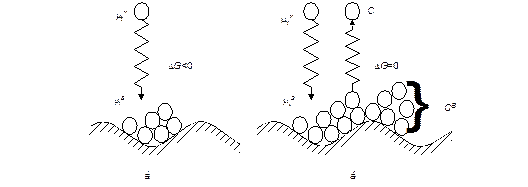
Рис. 4. 1 Схема процесса адсорбции: а — начальный момент (μtV> μtB, Δμ < 0);
б — состояние равновесия (μtV= μtB, Δμ = 0)
Рассмотрим в качестве примеров некоторые адсорбционные процессы.
Активированный уголь обладает значительной пористостью и повышенной адсорбционной способностью, хорошо адсорбирует летучие вещества. Входящие в состав молока жиры и белки адсорбируются на границе раздела водная среда – воздух и снижают поверхностное натяжение воды с 73 до 45—60 мДж/м2. Очистку растительных масел от красящих веществ, так называемый процесс отбеливания, осуществляют с помощью бентонитовых глин, выполняющих роль адсорбента. На основе адсорбции проводят очистку и осветление жидкости.
Адсорбция газов на угле происходит на границе Т—Г, жиров и белков — на границе Ж—Г, а красящих веществ на бентоните — по границе раздела двух конденсированных тел Т—Ж. Причем в первом случае адсорбируются молекулы газа или паров на твердой поверхности, а во втором и в третьем случаях в качестве адсорбата выступает растворенное в жидкости вещество. В ходе всех этих процессов происходит концентрирование веществ на поверхности раздела фаз.
Адсорбцию выражают в абсолютных и избыточных величинах. Абсолютная адсорбция (А) – это количество адсорбата на единице поверхности адсорбента. Она равна концентрации адсорбата в поверхностном слое сВ (см. рис. 4.1,б), умноженной на толщину этою слоя h:
А = сВh. (4.1)
Избыток адсорбата в поверхностном слое по сравнению с его первоначальным количеством в этом слое характеризует избыточную, или так называемую гиббсовскую адсорбцию (Г). Она показывает, насколько увеличилась концентрация адсорбата в результате адсорбции:
Г = А – c ∙h = Г – N, (4.2)
где с – равновесная концентрация адсорбтива в объеме; N – количество адсорбата в адсорбционном слое, когда его концентрация на поверхности соответствует концентрации в объемной фазе.
Когда концентрация адсорбата на поверхности адсорбента значительно превышает его концентрацию в объеме, т.е. cВ >> с, то величиной N можно пренебречь и считать, что
Г = А. (4.3)
В случае адсорбции на границе раздела жидкость – газ и адсорбции на твердых гладких поверхностях величины Г и А определяют относительно единицы площади границы раздела фаз, т.е. размерность Г и А будет моль/м2.
Для твердого и особенно пористого порошкообразного адсорбента, имеющего значительную поверхность раздела фаз, адсорбцию выражают по отношению к единице массы адсорбента, т.е. в этом случае величины Г и А имеют размерность моль/кг.
Таким образом, величина адсорбции для i-го компонента
Гi/ = ni /B моль/м2 или Гi//= ni /m моль/кг, (4.4)
где ni – избыточное число молей адсорбата i-го компонента на поверхности по сравнению с его содержанием в объеме; В – площадь поверхности раздела фаз, м2; m – масса пористого порошкообразного адсорбента, кг.
В случае адсорбции одного компонента уравнения (4.4) упрощаются:
Г/ = n/B, или Г// = n/m. (4.5)
У дисперсных систем в связи с раздробленностью резко увеличивается удельная поверхность [см. формулы (1.1)—(1.7)], что приводит (по сравнению с адсорбцией на нераздробленных твердых телах, особенно в тех случаях, когда они имеют плоскую поверхность) к значительному увеличению количества адсорбата.
Дата добавления: 2018-11-24; просмотров: 709; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
