Поверхностная энергия и заряд поверхности
Возникновение на границе электрических зарядов характерно прежде всего для золей и суспензий*, дисперсная фаза которых формируется из твердых частиц. Поэтому условия образования заряженных поверхностей мы рассмотрим применительно к этим дисперсным системам.
Поверхность частиц дисперсной фазы обычно неоднородная, имеет кривизну и отличается от плоскости. Для простоты изложения при объяснении электрокинетических явлений будем представлять поверхность раздела фаз в виде плоскости, а ее проекцию — прямой линией.
На поверхности твердого тела, соприкасающегося с жидкостью, может возникнуть избыток заряда определенного знака и формироваться потенциалобразующий слой ионов (рис. 7.1.). Возникновение этого слоя происходит в результате следующих процессов: адсорбции ионов, способных достраивать кристаллическую решетку (см. рис. 6.5), диссоциации поверхностных групп молекул, перехода ионов из одной фазы в другую (с твердой поверхности в раствор или наоборот) при установлении электрохимического равновесия.
Рассмотрим более подробно два последних процесса.
Силанольные группы в воде способны диссоциировать — в результате поверхность приобретает отрицательный заряд. Покажем это на примере гидроксида кремния:
≡ SiOH → ≡SiO– + H+.
Для амфотерных группировок диссоциация происходит в зависимости от рН среды. Так, гидроксид алюминия диссоцирует следующим образом:
|
|
|
— в кислой среде =Al—OH + H+ → =Al+ + H2O,
— в щелочной среде =Al—OH + ОH— → =Al—О— + H2O.
В первом случае поверхность заряжается положительно, а во втором — отрицательно. Глина почв, содержащая гидроксид алюминия, заряжается преимущественно отрицательно.
При погружении металла в раствор электролита, содержащего ионы этого металла, устанавливается электрохимическое равновесие. Если химический потенциал ионов металла μм больше химического потенциала этих же ионов в растворе μр то ионы переходят из металла в раствор, и поверхность металла заряжается отрицательно. И наоборот, при помещении медной пластинки в раствор CuSО4 с достаточно малой концентрацией Cu2+ (μр > μм) металлическая поверхность заряжается положительно. Фосфат железа, сульфат меди, диатомит, каолин, бентонит будут заряжаться отрицательно даже в кислой среде. А такие вещества, как гидроксид железа и целлюлоза, будут заряжаются положительно.
Возникновение зарядов на твердом теле приводит к тому, что на границе раздела фаз возникает электрический потенциал, обозначаемый через j (рис.7.1).
Если φ-потенциал определяется исключительно активностью ионов в растворе, т.е. твердое тело выполняет роль электрода относительно этих ионов, то для выражения φ-потенциала можно воспользоваться уравнением Нернста
|
|
|
 φ = (7.1)
φ = (7.1)
где F — число Фарадея; z — заряд иона; ап, ар — активность ионов у поверхности и в растворе.
Электрический заряд возникает на поверхности твердого тела самопроизвольно вследствие изменения поверхностной энергии, которая определяется условием (2.1). Все величины, входящие в уравнение (2.1), за исключением φdq, мы уже рассматривали в предыдущих главах. Величина φdq определяет изменение поверхностной энергии, вызванное зарядом поверхности.
Для изобарно-изотермического процесса в отсутствие физико-химических взаимодействий, когда dТ = 0, dp = 0 и dni = 0, из (2.1) получим
dG ≤ σdB + φdq. (7.2)
В условиях равновесия, когда dG = 0,
σdB + φdq = 0. (7.3)
Для однородной функции (7.3) в соответствии с теоремой Эйлера (см. параграф 4.2) можно записать
 |
σB + φq = 0. (7.4)
 |
Продифференцируем уравнение (7.4):
σdB + Bdσ + φdq + qdφ = 0. (7.5)
|
|
|
Если из уравнения (7.5) вычтем уравнение (7.3), получим
Bdσ + qdφ = 0.
или
q/B = — dσ/dφ. (7.6)
Левая часть уравнения (7.6) — это заряд единицы поверхности раздела фаз, т.е. qB = q/B.
Тогда из уравнения (7.6) можно выразить удельный заряд (плотность заряда) поверхности qB:
qB = - (∂σ/∂φ)T,p,ni. (7.7)
Условие (7.7) связывает поверхностное натяжение (удельную свободную поверхностную энергию) с параметрами, характеризующими удельный заряд поверхности qB и электрический потенциал φ. Заряд поверхности, который возникает самопроизвольно, вызван стремлением к уменьшению поверхностного натяжения. Это уменьшение есть частная производная (∂σ/∂φ)T,p,ni.
Таким образом, возникновение заряда на поверхности тела, граничащего с жидкостью, относится к одному из видов поверхностных явлений (см. рис. 2.4).
Двойной электрический слой
Возникновение потенциалобразующего слоя влияет на ионы, находящиеся в жидкости. К твердой поверхности из жидкой среды притягиваются ионы, знак которых противоположен знаку потенциалобразующего слоя, их называют противоионами. Возникает двойной электрический слой (ДЭС), его следует рассматривать как своеобразный конденсатор, внутренняя обкладка которого с потенциалом φ формируется из потенциалообразующего слоя ионов 1, а внешняя — из противоионов 2 (рис. 7.1).
|
|
|
Согласно теории Штерна, которую можно рассматривать как основу современного представления о структуре ДЭС (см. рис. 7.1), противоионы находятся в двух положениях: одна их часть образует адсорбционный слой (2, рис. 7.1) (иногда его называют плотным слоем, или слоем Гельмгольца). Адсорбционный слой противоионов формируется в результате электростатического взаимодействия с ионами потенциалобразующего слоя и специфической адсорбции; в этом слое фиксировано положение ионов. Другая часть противоионов находится в диффузном слое (3, рис. 7.1). В отличие от адсорбционного слоя противоионы диффузного слоя не закреплены; в результате теплового движения молекул среды и взаимного отталкивания они способны перемещаться в пределах диффузного слоя в глубь жидкости, т.е. из области большей в область меньшей концентрации.
Диэлектрическая проницаемость адсорбционного слоя существенно меньше диэлектрической проницаемости раствора, так как помимо противоионов в него входят ориентированные полярные молекулы среды.
С учетом сказанного выше плотность заряда в адсорбционном слое можно представить при помощи следующей формулы:
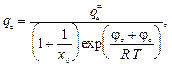 (7.7, a)
(7.7, a)
где — предельная плотность поверхностного заряда противоионов в адсорбционном слое; x0 — мольная доля противоионов в растворе; φэ и φс — потенциалы электростатической и специфической адсорбции соответственно.
Поверхностная плотность заряда на границе между адсорбционным и диффузным слоями
qa = — ρдδ, (7.7, б)
т.е. поверхностная плотность заряда qa равна произведению объемной плотности заряда диффузного слоя ρд на его толщину δ, взятому с обратным знаком.
Плотность заряда противоионов равна сумме поверхностной плотности заряда адсорбционного qa и диффузного qд слоев ДЭС, т.е.
q = qa +qд. (7.7, в)
Согласно уравнению (7.7, а) qa в области малых концентраций пропорциональна концентрации х0 в первой степени, при этом qa уменьшается быстрее qд, т.е. в ДЭС преобладает диффузная область. При больших концентрациях электролита qд значительно снижается, и все противоионы преимущественно сосредоточиваются в адсорбционном слое.
Толщина адсорбционного слоя δ определяется размерами противоионов; обычно она незначительна и не превышает 1 нм. В диффузном слое противоионы движутся хаотически, их положение изменяется. По этой причине толщина диффузного слоя будет некоторой приведенной величиной λ. Она определяется из предположения, что емкость ДЭС эквивалентна емкости плоского конденсатора с расстоянием между пластинами, равным λ. За толщину диффузного слоя принимают расстояние, соответствующее снижению φд-потенциала в е раз, т.е. в 2,718 раза. В зависимости от концентрации электролитов в дисперсионной среде толщина диффузного слоя может простираться в глубь дисперсионной среды на расстояние значительно большее, чем диаметр ионов.
С учетом структуры и толщины адсорбционного и диффузного слоев и по аналогии с плоским конденсатором можно определить емкость ДЭС:
С = СаСд/(Са+Сд) = εаε(d + l), (7.8)
где Са и Сд — емкости адсорбционной и диффузионной областей, εа и ε —диэлектрические проницаемости адсорбционного слоя и жидкости; d — толщина адсорбционного слоя; λ — толщина диффузного слоя.
При значительной разности между емкостями слоев полная емкость равна емкости слоя, который имеет меньшее значение. В разбавленных растворах, когда Са >> Сд, в знаменателе уравнения (7.8) можно пренебречь величинами Сд или δ, так как δ << λ. В связи с этим С ≈ Сд.
ДЭС может возникнуть на частицах, находящихся в полярной среде, и в отсутствие электролитов, вследствие ориентации диполей (более полярных по сравнению с неполярной средой примесей), а также частичной поверхностной диссоциации полярных частиц, если в жидкой среде присутствуют хотя бы следы воды.
На рис. 7.1 и 7.2, а представлена структура ДЭС в случае плоской поверхности. У сферических частиц (см. рис.7.2, б) ионы потенциалобразующего 1 и адсорбци
онного 2 слоев копируют форму частиц. Толщина адсорбционного слоя δ в случае плоской поверхности простирается от поверхности твердого тела до линии АА. Относительное перемещение заряженных частиц и жидкости происходит не по границе твердого тела с жидкостью, а за пределами этой границы по границе скольжения.
При движении частиц дисперсной фазы часть жидкости, находящаяся на поверхности твердого тела до границы скольжения, увлекается частицами и перемещается вместе с ними. В случае движения дисперсионной среды эта часть жидкости остается на поверхности твердого тела и является неподвижной.
Поверхность, разделяющая адсорбционный и диффузный слои противоионов, и граница скольжения могут совпадать, а могут и не совпадать. Как правило, граница скольжения находится на несколько большем расстоянии от поверхности твердого тела, чем адсорбционный слой. Ограничимся тем случаем, когда граница между адсорбционным и диффузным слоем совпадает с границей скольжения. По границе скольжения происходит взаимное перемещение дисперсной фазы и дисперсионной среды.
 |
Потенциал на границе скольжения (линия АА, рис.7.2 и 7.3) называют электрокинетическим, или дзета-потенциалом и обозначают через ζ.
 |
Потенциал φ ДЭС снижается по мере удаления от поверхности твердого тела. Причем в адсорбционном, наиболее плотном слое ДЭС наблюдается линейное снижение потенциала. Нарушение линейной зависимости происходит на границе скольжения (линия АА), а в диффузном слое снижение потенциала происходит по экспоненциальному закону и не так резко, как в адсорбционном слое.
Точка перегиба на пересечении линии, характеризующей изменение электрического потенциала по мере удаления от твердой поверхности, с границей скольжения определяет величину дзета-потенциала (рис. 7.1—7.4). Дзета-потенциал является важнейшей характеристикой двойного электрического слоя: он определяет возможность и скорость относительного перемещения дисперсной фазы и дисперсионной среды, интенсивность электрокинетических явлений, устойчивость золей и разрушение дисперсных систем электролитами. Значения ζ-потенциала можно достаточно точно измерить, его знак определяется знаком заряда потенциалобразующего слоя: если потенциалобразующий слой формируется из анионов, ζ-потенциал будет отрицательным, если он образуется из катионов — положительным
Изменение ζ-потенциала зависит от свойств среды и наличия в ней противоионов. Добавление в дисперсную фазу одновалентных противоионов приводит к сжатию диффузного слоя и снижению ζ-потенциала. Когда все противоионы будут находиться в адсорбционном слое (прямая 1 на рис. 7.4), происходит полная компенсация потенциалобразующего слоя, и z-потенциал становится равным нулю. Точку, характеризующую подобное состояние ДЭС, когда ζ = 0, называют изоэлектрической точкой (ИЭТ).
Добавление многовалентных катионов, например Fe3+, может привести к адсорбции противоионов в сверхэквивалентных количествах. В этих условиях произойдут перезарядка поверхности (линия 2 на рис. 7.4) и изменение знака ζ-потенциала из отрицательного (см. рис. 7.3) он становится положительным (см. рис. 7.4). В приведенных на рис. 7.3—7.4 схемах потенциалобразующие ионы несут отрицательный заряд. Однако все приведенные выше рассуждения справедливы и для положительно заряженного потенциалобразующего слоя.
Таким образом, значения ζ-потенциала могут быть отрицательными или положительными, а в определенных условиях он становится равным нулю.
Следует подчеркнуть, что мы рассмотрели механизм образования ДЭС простейшей структуры. Фактически структура ДЭС более сложная: она определяется неоднородностью поверхности твердых тел, особенно кристаллов, присутствием оксидной пленки металлов и дигидроксидов неметаллов, распределением зарядов с учетом их дискретности, т.е. неоднородности.
ДЭС и ζ-потенциал как его основная характеристика формируются на твердых поверхностях, окруженных раствором электролитов, а также при образовании мицелл. Мицелла — это электрически нейтральная коллоидная частица, которая в отличие от других коллоидных систем образуется в результате взаимодействия растворенных веществ, например
KI + AgNO3 → AgI + KNO3.
В данном случае дисперсная фаза состоит из молекул AgI. В избытке раствора KI (см. рис. 6.5) на поверхности будут адсорбироваться ионы I–, которые составят потенциалобразующий слой. Катионы К+ формируют адсорбционный и диффузный слои. Условно мицелла записывается следующим образом:
[(mAgI)nI–(n—x)K+]xК+.
Для того чтобы расшифровать эту запись, обратимся к рис. 7.2, б: mAgI — это молекулы AgI, формирующие дисперсную фазу, т.e. то, что на рисунке обозначено буквой Т; nI— —число ионов потенциалобразующего слоя 1, определяющих φ-потенциал; xК+, (n—x)K+] — число ионов K+ в диффузном 3 и адсорбционном 2 слоях соответственно.
Электрокинетические явления
Электрический заряд может возникать на любой твердой поверхности, находящейся в контакте с жидкостью. Значение удельного заряда сравнительно небольшое: например, для глины на границе с водой оно составляет несколько десятков милликулонов, поэтому поверхность куска глины массой 1 кг, равная сотым долям квадратного метра, будет иметь ничтожно малый электрический заряд. Частицы глины общей массой 1 кг реализуют поверхность в миллионы раз большую, чем ее сплошной кусок, что приводит к резкому увеличению заряда поверхности. Появление значительного заряда поверхности является причиной возникновения особых электрокинетических явлений, характерных только для дисперсных систем.
Электрокинетическими называют такие явления, которые возникают при воздействии электрического поля на дисперсные системы и в результате перемещения частиц дисперсной фазы или дисперсионной среды. Несмотря на различие электрокинетических явлений все они связаны с наличием двойного электрического слоя и определяются ζ-потенциалом, который именно поэтому и называют электрокинетическим.
Внешнее электрическое поле вызывает такие электрокинетические явления дисперсных систем, как электрофорез и электроосмос.
Электрофорез — это перемещение под действием электрического поля частиц дисперсной фазы относительно дисперсионной среды. Схема электрофореза показана на рис. 7.5, где частица дисперсной фазы для наглядности дана в увеличенном масштабе. При наложении внешнего электрического поля частицы дисперсной фазы начинают двигаться к электроду, знак заряда которого противоположен знаку ζ-потенциала; направление движения частицы на рисунке показано стрелкой.
Движение частиц при электрофорезе обусловлено притяжением разноименных зарядов. Диффузный слой не препятствует взаимодействию разноименных зарядов. Противоионы в этом слое подвижны, распределяются неравномерно и не в состоянии экранировать действие внешнего электрического поля на частицы дисперсной фазы. Движение частиц происходит по границе скольжения (линия АА на рис. 7.2, б).
В процессе электрофореза нарушается сферическая симметрия диффузного слоя противоионов, и он начинает двигаться в сторону, противоположную движению частиц. Противоположно направленный поток частиц диффузного слоя тормозит движение частиц. Этот эффект называют электрофоретическим торможением (короткая стрелка на рис. 7.5).
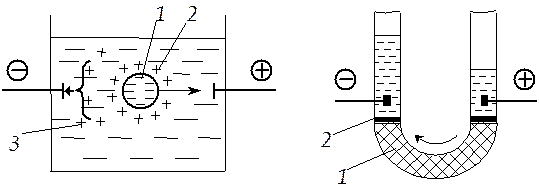
Рис. 7.5. Схема электрофореза:
1–3 — см. рис. 7.1
Рис. 7.6. Схема электроосмоса
1 — дисперсная система;
2 — перегородка
При электрофорезе происходит движение частиц дисперсной фазы в направлении силовых линий электрического поля. Электрофорез используют для получения новых материалов, нанесения покрытий, очистки веществ от примесей и выделения продуктов. В медицине электрофорез применяют для введения лекарственных веществ. На кожу пациента накладывают тампон, смоченный раствором лекарственного препарата, а сверху — электроды, к которым приложен низкий, безопасный для организма потенциал. В ходе этой процедуры частички лекарственного препарата под действием электрического поля переходят в ткани организма человека.
Электроосмосом называют перемещение дисперсионной среды под действием внешнего электрического поля (рис. 7.6). Движение дисперсионной среды обусловлено притяжением разноименных зарядов. Оно происходит зачастую в капиллярах и в каналах пористых тел. Когда ζ-потенциал отрицательный, то положительно заряженные противоионы диффузного слоя притягиваются к отрицательному электроду (см. рис. 7.5). Противоионы увлекают за собой жидкость, составляющую дисперсионную среду. В результате этого происходит движение жидкости, причем перемещение жидкой дисперсионной среды относительно частиц дисперсной фазы, как и в случае электрофореза, происходит по границе скольжения.
Электроосмос используют, например, для обезвоживания древесины и других пористых материалов: строительных, грунта, продуктов питания, сырья для пищевой промышленности и др. Влажную массу помещают между электродами, а вода в зависимости от структуры ДЭС движется к одному из них и собирается в специальной емкости.
Для осуществления электрофореза или электроосмоса необходимо внешнее электрическое поле, т.е. движение частиц при электрофорезе или среды при электроосмосе является следствием воздействия этого поля.
Для потенциала седиментации и потенциала течения первичным является движение дисперсной фазы или дисперсионной среды, а вторичным — возникновение электрического потенциала.
Потенциал седиментации возникает при седиментации (оседании) частиц дисперсной фазы за счет избыточного заряда частиц, определяемого ζ-потенциалом.
 Схема возникновения потенциала седиментации показана на рис. 7.7. Частицы дисперсной фазы оседают под действием гравитации. Процесс оседания частиц называют седиментацией (см. параграф 10.2). При оседании частиц дисперсионная среда практически остается неподвижной. Частицы движутся совместно с потенциалобразующим слоем ионов и адсорбционным слоем противоионов. Их перемещение относительно жидкой дисперсионной среды происходит по границе скольжения.
Схема возникновения потенциала седиментации показана на рис. 7.7. Частицы дисперсной фазы оседают под действием гравитации. Процесс оседания частиц называют седиментацией (см. параграф 10.2). При оседании частиц дисперсионная среда практически остается неподвижной. Частицы движутся совместно с потенциалобразующим слоем ионов и адсорбционным слоем противоионов. Их перемещение относительно жидкой дисперсионной среды происходит по границе скольжения.
 Потенциал седиментации обратен электрофорезу. И в том и другом случае происходит движение частиц. Но при электрофорезе перемещение происходит в результате взаимодействия электрического поля с избыточным зарядом частиц, а при потенциале седиментации в процессе оседания частиц возникает разность потенциалов (см. рис. 7.7).
Потенциал седиментации обратен электрофорезу. И в том и другом случае происходит движение частиц. Но при электрофорезе перемещение происходит в результате взаимодействия электрического поля с избыточным зарядом частиц, а при потенциале седиментации в процессе оседания частиц возникает разность потенциалов (см. рис. 7.7).
Потенциал течения возникает при перемещении жидкой дисперсионной среды. Схематически потенциал течения показан на рис. 7.8. Жидкость движется под влиянием внешнего воздействия: насоса, давления воздуха или какого-либо другого источника. При движении жидкости увлекаются противоионы диффузного слоя, имеющие в нашем примере положительный знак (см. рис. 7.3). В этом случае, как и в других электрокинетических явлениях, перемещение жидкой дисперсионной среды относительно твердой дисперсной фазы происходит по границе скольжения и приводит к появлению разности потенциалов.
Потенциал течения обратен электроосмосу — в обоих случаях происходит движение дисперсионной среды: для потенциала течения — в результате внешнего воздействия, а для электроосмоса — под действием электрического поля.
Электрокинетические явления зависят от формы и материала частиц, структуры ДЭС, энергетической и геометрической неоднородности поверхности твердых тел, наличия в жидкости примесей, условий приложений электрического поля, конструкции электродов и других факторов. Следует отметить, что явление электрофореза характерно главным образом для коллоидных растворов (золей), т.е. для систем, у которых размеры частиц дисперсной фазы не превышают 0,1 мкм. Электроосмос и потенциал течения могут наблюдаться не только в отношении коллоидных растворов, которые являются высокодисперсными системами, но и в отношении средне- и грубодисперсных систем. Потенциал седиментации проявляется для седиментационно-неустойчивых систем, т.е. средне- и грубодисперсных.

Рис. 7.8. Схема потенциала течения: 1 — дисперсная система;
2 — перегородка
Электрофорез и электроосмос используют в производственных целях в ряде отраслей промышленности (табл. 7.1).
Т а б л и ц а 7.1
Применение электрофореза и электроосмоcа
| Наименование | Цель применения |
| Электрофорез Электроосмос | Нанесение покрытий; разделение и извлечение компонентов коллоидного раствора, масляных эмульсий и белков; очистка глины; извлечение мелких частиц из раствора, не поддающегося фильтрации Удаление избыточной влаги из капиллярно-пористых тел; дубление кожи; очистка дисперсионной среды коллоидных растворов, а также воды, глицерина, сахарных сиропов, желатина и др., в электрокинетических датчиках, преобразователях, усилителях и др. приборах |
В пищевой промышленности, например, электрофорез применяют для очистки хлопкового масла. Напряженность внешнего электрического поля для его осуществления должна составлять —6,1∙10–7 В/м. Знак «минус» показывает, что частицы загрязнений несут положительный заряд. Электроосмос используют для обезвоживания пищевых масс. Так, согласно существующей технологии скорость движения воды в сахаросодержащих коллоидных растворах составляет около 0,03 м/с.
Дата добавления: 2018-11-24; просмотров: 1127; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
