ОПЫТ 4. РЕАКЦИЯ НА ИОН АММОНИЯ.
МОДУЛЬ 2
Тема №7Элементы Va группы.
ВОПРОСЫ ДЛЯ САМОСТОЯТЕЛЬНОЙ ПОДГОТОВКИ К ТЕМЕ:
1. Дайте общую характеристику Vaгруппе элементов.
2. Дайте общую характеристику N, P.
2.1. Открытие;
2.2. Распространение в природе;
2.3. Методы получения;
2.4. Физические и химические свойства;
2.5. Применение.
3. Составьте схемы свойств соединений N, P.
ВОПРОСЫ ДЛЯ САМОСТОЯТЕЛЬНОЙ ПОДГОТОВКИ К ЛАБОРАТОРНОЙ РАБОТЕ:
1. Техника безопасности при работе с соединениями Vа группы.
2. Исходя из методических указаний к лабораторной работе, составить список приборов и реактивов.
ЛАБОРАТОРНАЯ РАБОТА «ПОЛУЧЕНИЕ И СВОЙСТВА СОЕДИНЕНИЙ УГЛЕРОДА И КРЕМНИЯ»
ОПЫТ 1. ПОЛУЧЕНИЕ АЗОТА И ЕГО СВОЙСТВА.
Положить в пробирку 2г. измельченного нитрита натрия и прилить 4-5мл. насыщенного раствора хлорида аммония. Закрыть пробиркупробкой с газоотводной трубкой, закрепить в штативе и осторожно нагреть. Через 1-2 мин. после начала реакции собрать выделяющийся газ в цилиндр (широкую пробирку) над водой. После наполнения цилиндра газом закрыть его стеклянной пластинкой и вынуть из
ванны. Написать уравнение реакции разложения нитрита аммония.
…………………………………………………………………………………………………………………………………………………….
Объяснить, почему вместо NH4NO2 можно пользоваться смесью солей NaNO2 и NH4Cl.
…………………………………………………………………………………………………………………………………………………….
|
|
|
Охарактеризовать физические свойства азота.
…………………………………………………………………………………………………………………………………………………….
В цилиндр (пробирку) с азотом внести горящую лучинку или влить известковой воды и взболтать. Изменяется ли известковая вода?
…………………………………………………………………………………………………………………………………………………….
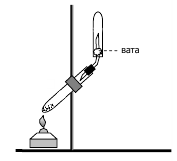 ОПЫТ 2. ПОЛУЧЕНИЕ АММИАКА.
ОПЫТ 2. ПОЛУЧЕНИЕ АММИАКА.
Собрать прибор для получения аммиака.
Хлорид аммония и гашеную известь в приблизительно равных объемах тщательно перемешать в фарфоровой чашке. Происходит ли образование аммиака при этих условиях?
………………………………………………………………………………………………………
Полученную смесь всыпать в пробирку (до половины), которую затем закрыть пробкой с газоотводной трубкой и закрепить в штативе так, чтобы дно ее было несколько выше отверстия. Не сильно нагревать смесь и собирать выделяющийся аммиак в пробирку. Почему ее надо повернуть вверх дном?
…………………………………………………………………………………………………………………………………………………….
Через несколько минут, когда пробирка наполнится аммиаком (как в этом убедится?), осторожно снять ее с трубки, не переворачивая, закрыть сухой пробкой и сохранить для следующего опыта.
|
|
|
ОПЫТ 3. СВОЙСТВА АММИАКА.
Растворение аммиака в воде.
Пробирку с аммиаком, полученным в предыдущем опыте, опустить отверстием вниз в ванну с водой, под водой открыть пробку и слегка покачать пробиркой. Что наблюдаете?
…………………………………………………………………………………………………………………………………………………….
Когда вода перестанет подниматься, закрыть пробирку под водой и вынуть ее из ванны. Испытать раствор индикаторной бумажкой. Объяснить наблюдаемые явления.
…………………………………………………………………………………………………………………………………………………….
Написать уравнение реакции.
…………………………………………………………………………………………………………………………………………………….
Часть полученного раствора нагреть до кипения. Изменяется ли интенсивность запаха?
…………………………………………………………………………………………………………………………………………………….
Прокипятив раствор 2-3 мин. испытать его реакцию индикаторной бумажкой. Отметить ее цвет. Написать уравнение реакции.
…………………………………………………………………………………………………………………………………………………….
Какие равновесия устанавливаются в водном растворе аммиака?
|
|
|
…………………………………………………………………………………………………………………………………………………….
Как смещаются эти равновесия при нагревании раствора?
…………………………………………………………………………………………………………………………………………………….
Дать объяснение.
…………………………………………………………………………………………………………………………………………………….
Взаимодействие аммиака с хлороводородом.
Один цилиндр наполнить аммиаком (см. опыт №3), второй – хлороводородом и закрыть пробками. Соединить их отверстиями так, чтобы цилиндр с аммиаком был сверху. Вынуть пробки и несколько раз перевернуть цилиндры (зачем?). Что наблюдаете?
…………………………………………………………………………………………………………………………………………………….
Написать уравнение реакции.
…………………………………………………………………………………………………………………………………………………….
Горение аммиака.
В одну пробирку налить 2-3 мл.концентрированного раствора аммиака и закрыть ее пробкой с газоотводной трубкой. В другую пробирку поместить немого смеси бертолетовой соли с прокаленным оксидом марганца (IV). Пробирки расположить так, чтобы конец газоотводной трубки находился над отверстием второй пробирки. Нагревать смесь КClO3 и МnO2. Когда начнет выделяться кислород (как это обнаружить?), слабо нагреть раствор аммиака. Выделяющийся аммиак поджечь у конца газоотводной трубки. Отметить цвет его пламени.
|
|
|
…………………………………………………………………………………………………………………………………………………….
Написать уравнение реакции и схему перехода электронов.
…………………………………………………………………………………………………………………………………………………….
ОПЫТ 4. РЕАКЦИЯ НА ИОН АММОНИЯ.
В пробирку налить немного раствора соли аммония, например NH4Cl, прибавить 1-2 мл.раствора NаОН и нагреть. Поднести к отверстию пробирки, не касаясь ее стенок, смоченную водой индикаторную бумажку. Как изменился ее цвет?
…………………………………………………………………………………………………………………………………………………….
Написать уравнения реакции.
…………………………………………………………………………………………………………………………………………………….
Так как из всех газов аммиак образует щелочь, то изменение цвета индикаторной бумажки в парах указывает, что в растворе присутствует ион NН4+ . В том случае, когда объем выделяющегося аммиака довольно большой, его можно обнаружить по запаху.
Дата добавления: 2018-05-31; просмотров: 665; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
