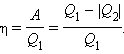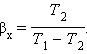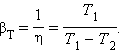Тепловые двигатели. Цикл Карно
Лекция №12
Основы термодинамики
Термодинамика изучает различные состояния термодинамических систем, процессы перехода их из одного состояния в другое, оперируя термодинамическими, макропараметрами системы, не рассматривая корпускулярное строение вещества (термодинамический метод).
Состояние системы определяется значениями параметров состояния.
Для газа основными параметрами состояния являются P,V,T.
Имеет смысл говорить о равновесных состояниях термодинамических систем, это такие состояния, при которых любая часть системы имеет одно и тоже значение макропараметра. 
Состояние системы на PV-диаграмме можем изобразить точкой с координатами (P1V1) или (P2V2).
Термодинамический процесс – переход системы их одного состояния в другое.
Процесс сопровождается изменением какого-то параметра, то есть нарушением равновесия.
Однако, если процесс протекает бесконечно медленно, то есть отклонения от равновесия бесконечно мало, можно считать процесс равновесным, то есть проходящим через цепочку равновесных состояний.
Внутренняя энергия системы.
Внутренняя энергия – функция состояния системы (U), то есть в данном состоянии система обладает определенной внутренней энергией, определяемой величиной параметров состояния и не зависит от того, как она оказалась в этом состоянии.
Изменение внутренней энергии при переходе системы из одного состояния в другое равно разности внутренних энергий в этих состояниях, не зависимо от пути перехода. (Как работа консервативных сил).
Первый закон термодинамики.
Если два тела с разной температурой привести в соприкосновение, то в результате теплопередачи теплота (Q) от одного тела будет передаваться другому телу до тех пор пока система тел не достигнет равновесия, то есть Т=const.
Теплота – количество внутренней энергии, передаваемой одним телом другому в процессе теплопередачи.
I закон термодинамики - закон сохранения энергии в тепловых процессах (баланс энергии).
Количество тепла, сообщенная системе идет на приращение ее внутренней энергии (на нагрев) и на работу, совершаемую системой.

где А – работа, совершаемая системой.
Внутреннюю энергию системы можно изменять, подводя к ней теплоту и совершая над ней работу.
1 кал = 4,18 Дж. 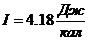 – механический эквивалент тепла.
– механический эквивалент тепла.
Работа газов.
Невесомый поршень в цилиндре с площадью поперечного сечения F перемещается вниз на ∆h (газ сжимается). Работа внешней силы F равна:
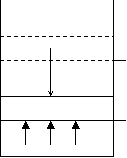 |
S 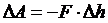
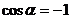
F=pS
dA = -pS ∆h=-pdV
Работа, совершаемая газом, равна
dA=pdV или

∆h
|
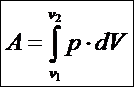
На PV-диаграмме работа, совершаемая газом, равна площади под линией процесса.
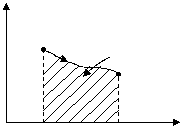 р
р
1 
2
V1 V2
I закон в дифференциальной форме

Из предыдущей лекции
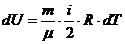
Из уравнения состояния идеального газа
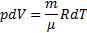
Тогда

Теплоемкость
Теплоемкость тела равна количеству тепла, которое надо сообщить телу, чтобы повысить его температуру на 1 К.
 -интегральная, суммарная теплоемкость системы
-интегральная, суммарная теплоемкость системы
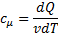
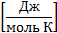 – молярная теплоемкость
– молярная теплоемкость
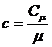
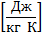 - удельная теплоемкость
- удельная теплоемкость
Изохорный процесс
V=const dA=0 dQ=dU


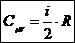 -молярная теплоемкость газа при V=const не зависит от параметров газа.
-молярная теплоемкость газа при V=const не зависит от параметров газа.
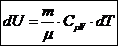
Изобарный процесс
p=const 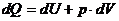
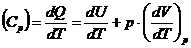
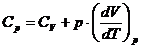
Для одного моля газа
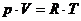
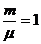
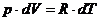

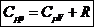
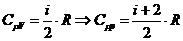
 показатель адиабаты
показатель адиабаты
Адиабатический процесс.
Процесс без теплообмена с окружающей средой 
Первый закон термодинамики
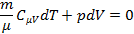
Из уравнения состояния газа
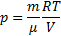
Для одного моля газа

или

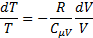
После интегрирования данного уравнения с учетом, что
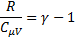
получим

 - уравнение Пуассона для адиабатического процесса.
- уравнение Пуассона для адиабатического процесса.
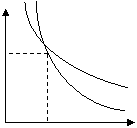 |
p
T=const
Q=0
V
Если система изолированная, т.е. dQ=0 (энергия не подводится и не отводится от системы), то
 - система может совершать работу только за счет уменьшения своей внутренней энергии.
- система может совершать работу только за счет уменьшения своей внутренней энергии.
Следовательно, не возможен вечный двигатель I рода, т. е. устройство, вечно совершающее работу без потребления энергии из вне.
Работа при изопроцессах
1) V=const A=0 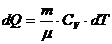
2) p=const 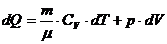
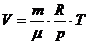
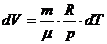
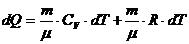

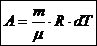
3) T=const dU=0 Q=A
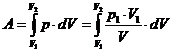

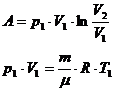

4) Q=0 A=-dU
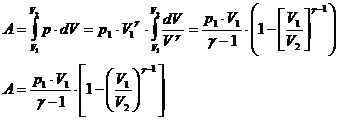
Тепловые двигатели. Цикл Карно
Тепловым двигателем называется устройство, способное превращать полученное количество теплоты в механическую работу. Механическая работа в тепловых двигателях производится в процессе расширения некоторого вещества, которое называется рабочим телом. В качестве рабочего тела обычно используются газообразные вещества (пары бензина, воздух, водяной пар). Рабочее тело получает (или отдает) тепловую энергию в процессе теплообмена с телами, имеющими большой запас внутренней энергии. Эти тела называются тепловыми резервуарами.
Как следует из первого закона термодинамики, полученное газом количество теплоты Q полностью превращается в работу A при изотермическом процессе, при котором внутренняя энергия остается неизменной (ΔU = 0):
| A = Q. |
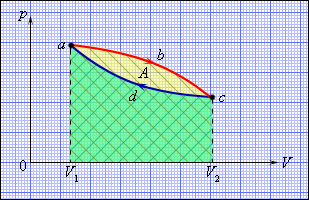
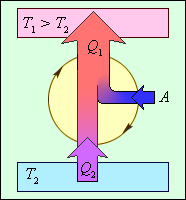
Но такой однократный актпреобразования теплоты в работу не представляет интереса для техники. Реально существующие тепловые двигатели (паровые машины, двигатели внутреннего сгорания и т. д.) работают циклически. Процесс теплопередачи и преобразования полученного количества теплоты в работу периодически повторяется. Для этого рабочее тело должно совершать круговой процесс или термодинамический цикл, при котором периодически восстанавливается исходное состояние. Круговые процессы изображаются на диаграмме (p, V) газообразного рабочего тела с помощью замкнутых кривых (рис. 1.5.9). При расширении газ совершает положительную работу A1, равную площади под кривой abc, при сжатии газ совершает отрицательную работу A2, равную по модулю площади под кривой cda. Полная работа за цикл A = A1 + A2 на диаграмме (p, V) равна площади цикла. Работа A положительна, если цикл обходится по часовой стрелке, и A отрицательна, если цикл обходится в противоположном направлении.
 1
1
|
| Рисунок 1.5.9. Круговой процесс на диаграмме (p, V). abc – кривая расширения, cda – кривая сжатия. Работа A в круговом процессе равна площади фигуры abcd. |
Общее свойство всех круговых процессов состоит в том, что их невозможно провести, приводя рабочее тело в тепловой контакт только с одним тепловым резервуаром. Их нужно, по крайней мере, два. Тепловой резервуар с более высокой температурой называют нагревателем, а с более низкой – холодильником. Совершая круговой процесс, рабочее тело получает от нагревателя некоторое количество теплоты Q1 > 0 и отдает холодильнику количество теплоты Q2 < 0. Полное количество теплоты Q, полученное рабочим телом за цикл, равно
| Q = Q1 + Q2 = Q1 – |Q2|. |
При обходе цикла рабочее тело возвращается в первоначальное состояние, следовательно, изменение его внутренней энергии равно нулю (ΔU = 0). Согласно первому закону термодинамики,
| ΔU = Q – A = 0. |
Отсюда следует:
| A = Q = Q1 – |Q2|. |
Работа A, совершаемая рабочим телом за цикл, равна полученному за цикл количеству теплоты Q. Отношение работы A к количеству теплоты Q1, полученному рабочим телом за цикл от нагревателя, называется коэффициентом полезного действияη тепловой машины:
|
Коэффициент полезного действия указывает, какая часть тепловой энергии, полученной рабочим телом от «горячего» теплового резервуара, превратилась в полезную работу. Остальная часть (1 – η) была «бесполезно» передана холодильнику. Коэффициент полезного действия тепловой машины всегда меньше единицы (η < 1). Энергетическая схема тепловой машины изображена на рис. 1.5.10.
 2
2
|
| Рисунок 1.5.10. Энергетическая схема тепловой машины: 1 – нагреватель; 2 – холодильник; 3 – рабочее тело, совершающее круговой процесс. Q1 > 0, A > 0, Q2 < 0; T1 > T2. |
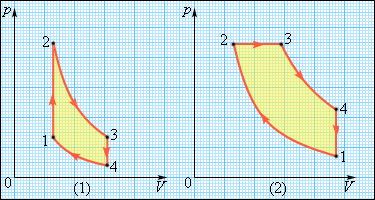
В применяемых в технике двигателях используются различные круговые процессы. На рис. 1.5.11 изображены циклы, используемые в бензиновом карбюраторном двигателе и в дизельном двигателе. В обоих случаях рабочим телом является смесь паров бензина или дизельного топлива с воздухом. Цикл карбюраторного двигателя внутреннего сгорания состоит из двух изохор (1–2, 3–4) и двух адиабат (2–3, 4–1). Дизельный двигатель внутреннего сгорания работает по циклу, состоящему из двух адиабат (1–2, 3–4), одной изобары (2–3) и одной изохоры (4–1). Реальный коэффициент полезного действия у карбюраторного двигателя порядка 30%, у дизельного двигателя – порядка 40 %.
 3
3
|
| Рисунок 1.5.11. Циклы карбюраторного двигателя внутреннего сгорания (1) и дизельного двигателя (2). |
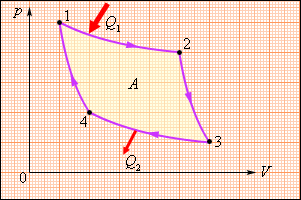
В 1824 году французский инженер С. Карно рассмотрел круговой процесс, состоящий из двух изотерм и двух адиабат. Этот круговой процесс сыграл важную роль в развитии учения о тепловых процессах. Он называется циклом Карно (рис. 1.5.12).
 4
4
|
| Рисунок 1.5.12. Цикл Карно. |
Цикл Карно совершает газ, находящийся в цилиндре под поршнем. На изотермическом участке (1–2) газ приводится в тепловой контакт с горячим тепловым резервуаром (нагревателем), имеющим температуру T1. Газ изотермически расширяется, совершая работу A12, при этом к газу подводится некоторое количество теплоты Q1 = A12. Далее на адиабатическом участке (2–3) газ помещается в адиабатическую оболочку и продолжает расширяться в отсутствие теплообмена. На этом участке газ совершает работу A23 > 0. Температура газа при адиабатическом расширении падает до значения T2. На следующем изотермическом участке (3–4) газ приводится в тепловой контакт с холодным тепловым резервуаром (холодильником) при температуре T2 < T1. Происходит процесс изотермического сжатия. Газ совершает работу A34 < 0 и отдает тепло Q2 < 0, равное произведенной работе A34. Внутренняя энергия газа не изменяется. Наконец, на последнем участке адиабатического сжатия газ вновь помещается в адиабатическую оболочку. При сжатии температура газа повышается до значения T1, газ совершает работу A41 < 0. Полная работа A, совершаемая газом за цикл, равна сумме работ на отдельных участках:
| A = A12 + A23 + A34 + A41. |
На диаграмме (p, V) эта работа равна площади цикла.
Как следует из первого закона термодинамики, работа газа при адиабатическом расширении (или сжатии) равна убыли ΔU его внутренней энергии. Для 1 моля газа
| A = –ΔU = –CV(T2 – T1), |
где T1 и T2 – начальная и конечная температуры газа.
Отсюда следует, что работы, совершенные газом на двух адиабатических участках цикла Карно, одинаковы по модулю и противоположны по знакам
| A23 = –A41. |
По определению, коэффициент полезного действия η цикла Карно есть

|
С. Карно выразил коэффициент полезного действия циклачерез температуры нагревателя T1 и холодильника T2:
|
Цикл Карно замечателен тем, что на всех его участках отсутствует соприкосновение тел с различными температурами. Любое состояние рабочего тела (газа) на цикле является квазиравновесным, то есть бесконечно близким к состоянию теплового равновесия с окружающими телами (тепловыми резервуарами или термостатами). Цикл Карно исключает теплообмен при конечной разности температур рабочего тела и окружающей среды (термостатов), когда тепло может передаваться без совершения работы. Поэтому цикл Карно – наиболее эффективный круговой процесс из всех возможных при заданных температурах нагревателя и холодильника:
|
Любой участок цикла Карно и весь цикл в целом может быть пройден в обоих направлениях. Обход цикла по часовой стрелке соответствует тепловому двигателю, когда полученное рабочим телом тепло частично превращается в полезную работу. Обход против часовой стрелки соответствуетхолодильной машине, когда некоторое количество теплоты отбирается от холодного резервуара и передается горячему резервуару за счет совершения внешней работы. Поэтому идеальное устройство, работающее по циклу Карно, называют обратимой тепловой машиной.
В реальных холодильных машинах используются различные циклические процессы. Все холодильные циклы на диаграмме (p, V) обходятся против часовой стрелки. Энергетическая схема холодильной машины представлена на рис. 1.5.13.
 5
5
|
| Рисунок 1.5.13. Энергетическая схема холодильной машины. Q1 < 0, A < 0, Q2 > 0, T1 > T2. |
Устройство, работающее по холодильному циклу, может иметь двоякое предназначение. Если полезным эффектом является отбор некоторого количества тепла |Q2| от охлаждаемых тел (например, от продуктов в камере холодильника), то такое устройство является обычным холодильником. Эффективность работы холодильника можно охарактеризовать отношением
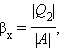
|
то есть эффективность работы холодильника – это количество тепла, отбираемого от охлаждаемых тел на 1 джоуль затраченной работы. При таком определении βx может быть и больше, и меньше единицы. Для обращенного цикла Карно
|
Если полезным эффектом является передача некоторого количества тепла |Q1| нагреваемым телам (например, воздуху в помещении), то такое устройство называется тепловым насосом. Эффективность βТ теплового насоса может быть определена как отношение
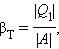
|
то есть количеством теплоты, передаваемым более теплым телам на 1 джоуль затраченной работы. Из первого закона термодинамики следует:
| |Q1| > |A|, |
следовательно, βТ всегда больше единицы. Для обращенного цикла Карно
|
Дата добавления: 2018-05-12; просмотров: 626; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!