Статистический смысл второго закона термодинамики.
1. Вероятность – это основное понятие статистики. Под вероятностью события понимают величину, обратную числу всех возможных равновероятных исходов.
Пример 1. Грани правильного однородного кубика пронумерованы числами от 1 до 6. Вопрос: какова вероятность того, что кубик при случайном падении встанет на грань №1?
Так как кубик может упасть 6 равноценными способами, то вероятность того, что кубик упадет на грань №1, равна 1/6. Такова же вероятность падения кубика и на каждую из остальных граней.
2. Частота выпадения сумм. Рассмотрим более сложный пример с двумя кубиками.
Пример 2. Определить вероятность выпадения той или иной суммы при одновременном бросании двух кубиков.
При падении кубиков могут наблюдаться следующие ситуации (таблица 7).
Таблица 7
| Куб А | Куб В | Сумма S | А | В | S | А | В | S | А | В | S | А | В | S | А | В | S |
                         1 1
| 1 | 2 | 2 | 1 | 3 | 3 | 1 | 4 | 4 | 1 | 5 | 5 | 1 | 6 | 6 | 1 | 7 |
| 1 | 2 | 3 | 2 | 2 | 4 | 3 | 2 | 5 | 4 | 2 | 6 | 5 | 2 | 7 | 6 | 2 | 8 |
| 1 | 3 | 4 | 2 | 3 | 5 | 3 | 3 | 6 | 4 | 3 | 7 | 5 | 3 | 8 | 6 | 3 | 9 |
| 1 | 4 | 5 | 2 | 4 | 6 | 3 | 4 | 7 | 4 | 4 | 8 | 5 | 4 | 9 | 6 | 4 | 10 |
| 1 | 5 | 6 | 2 | 5 | 7 | 3 | 5 | 8 | 4 | 5 | 9 | 5 | 5 | 10 | 6 | 5 | 11 |
| 1 | 6 | 7 | 2 | 6 | 8 | 3 | 6 | 9 | 4 | 6 | 10 | 5 | 6 | 11 | 6 | 6 | 12 |
Число всех возможных ситуаций 36. Вероятность появления любой ситуации 1/36. Но число способов реализации ситуации различно (в таблице 7 одинаковые суммы соединены штриховыми линиями).
|
|
|
| 6 – 5 способов, 7 – 6 способов, 8 – 5 способов, 9 – 4 способа, |
| 10 – 3 способа, 11 – 2 способа, 12 – 1 способ. |
Сумма å = 2 – 1 способ,
3 – 2 способа,
4 – 3 способа,
5 – 4 способа,
Если бросать кубики много раз, то суммы 6, 7, 8 будут выпадать гораздо чаще, чем 2 или 12, т. к. реализуются большим числом способов. Вероятности их появления больше.
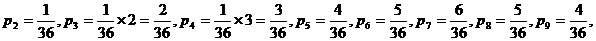
 Суммы 1, 0, 13 и все другие n > 12 и n< 2 вообще не могут выпасть. Вероятность их появления равна нулю.
Суммы 1, 0, 13 и все другие n > 12 и n< 2 вообще не могут выпасть. Вероятность их появления равна нулю.
Отношению числа реализующих данное событие способов к общему числу всех возможных, называется математической вероятностью события. Очевидно, 0 ≤ p ≤ 1.
3. Термодинамическая вероятность события – это число способов его реализации. В примере 2 W1 = 0, W2 = 1, W3 = 2, W7 = 6, W8 = 5, W12 = 1, W13 = 0. Под событием в термодинамике понимается термодинамическое состояние. Если p ≤ 1, то W ≥ 1.
 Пример 3. Пусть в сосуде (рис.34) находится 6 пронумерованных молекул. Разделим сосуд мысленно пополам. Число молекул в любой половине может быть от 0 до 6. Вопрос: каким числом способов реализуется каждое состояние?
Пример 3. Пусть в сосуде (рис.34) находится 6 пронумерованных молекул. Разделим сосуд мысленно пополам. Число молекул в любой половине может быть от 0 до 6. Вопрос: каким числом способов реализуется каждое состояние?
Состояние, когда в левой половине не будет ни одной молекулы может реализоваться одним единственным способом W0= 1. Число ситуаций, когда в левой половине одна молекула, равно 6: W1 = 6. Число ситуаций с двумя молекулами равно числу сочетаний из 6 по 2, то есть 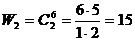 . Аналогично для 3, 4, 5, 6 молекул. Число всех возможных комбинаций
. Аналогично для 3, 4, 5, 6 молекул. Число всех возможных комбинаций
|
|
|
Wå = 
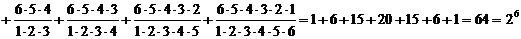 .
.
 Зависимость величины W от числа молекул в одной половине в виде гистограммы на рис. 35.
Зависимость величины W от числа молекул в одной половине в виде гистограммы на рис. 35.
Если число молекул в сосуде N, то число всех возможных ситуаций Wå =2N. (12.1)
Говорят, что термодинамическая вероятность W определяет число микросостояний, реализующих данное макросостояние. В примере 3 вероятность равновесного распределения, когда справа и слева одинаковое число молекул, максимальна, W3 = 20.
4. Второй закон термодинамики в формулировке Больцмана. При большом числе частиц количество способов, которым реализуется равномерное распределение частиц в объеме сосуда, становится подавляюще большим по сравнению с любым другим неравномерным распределением. В ходе непрерывного хаотического движения молекул газ может принимать в принципе любое состояние. Но в подавляющем большинстве случаев мы найдем его в равновесном состоянии, которое реализуется максимальным числом способов и которому соответствует максимальная вероятность W.
Как следует из второго закона термодинамики, изолированная система самопроизвольно переходит в равновесное состояние с максимальной энтропией. Больцман в 1872 г. установил связь между энтропией S и вероятностью W: S = S0 + klnW, (12.2)
|
|
|
где k = 1,38×10-23 Дж|К - постоянная Больцмана, S0 – начальное значение энтропии, W – термодинамическая вероятность. Отсюда, второй закон термодинамики можно сформулировать так: все самопроизвольные процессы в изолированных системах протекают в направлении наиболее вероятного состояния (Л. Больцман, 1872).
Формулировка Больцмана выявляет статистический характер второго закона термодинамики. Статистическое исследование термодинамических систем позволяет установить меру категоричности запрета, налагаемого вторым законом термодинамики.
Пример 4. Найдем вероятность того, что 1 эрг энергии теплового движения молекул перейдет от тела с температурой Т1 = 301К к телу с температурой Т2 = 300К. (1 эрг = 10-7Дж).
Изменение энтропии при равновесном переходе равно
 . (12.3)
. (12.3)
Здесь Q = 10-7 Дж, W2 – термодинамическая вероятность потери теплоты Q нагретым телом Т1, W1 – вероятность потери той же теплоты Q холодным телом Т2. Итак,
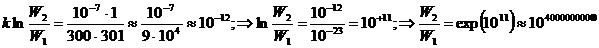 .
.
Если положить W1=1, то W2 =  . На
. На  переходов 1 эрга энергии от горячего тела к холодному приходится лишь один обратный переход. Таким образом, хотя математическая вероятность антиэнтропийного процесса не равна нулю, но она столь ничтожна, что фактически это эквивалентно запрету.
переходов 1 эрга энергии от горячего тела к холодному приходится лишь один обратный переход. Таким образом, хотя математическая вероятность антиэнтропийного процесса не равна нулю, но она столь ничтожна, что фактически это эквивалентно запрету.
|
|
|
5. Энтропия – мера беспорядка. Поскольку тепловая энергия тела обусловлена хаотическим движением молекул, а механическая энергия поступательного движения тела представляет собой энергию упорядоченного движения молекул, то ясно, что процесс превращения тепловой энергии в механическую есть, по сути, процесс превращения беспорядочного движения в упорядоченное. Любой беспорядок может быть реализован огромным числом способов, тогда как порядок реализуется, как правило, одним способом. Поэтому энтропия беспорядочного состояния гораздо больше энтропии упорядоченного состояния, а превращение тепловой энергии в механическую сложнее, чем наоборот. Самопроизвольный переход систем в состояние с максимальной энтропией есть, таким образом, переход в состояние максимально возможного беспорядка. Итак, энтропия есть мера беспорядка системы.
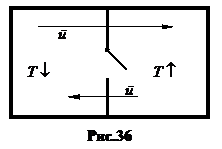
6. Демон Максвелла. Максвелл высказал мысль, что в изолированных системах в принципе возможны процессы с уменьшением энтропии, если иметь устройство, пропускающее быстрые молекулы в одну сторону, а другие в другую (рис. 36). Такое устройство, названное по традиции вслед за Лапласом Демоном, без затрат энергии в правой части сосуда соберет быстрые молекулы, а в левой - медленные. В правой части газ будет нагреваться, в левой – остывать. Теплота будет переходить от холодного тела к горячему.
Парадокс разрешается следующим суждением. Сортирующее устройство должно быть молекулярных размеров, а, значит, будет функционировать случайным образом.
 Кроме того, перед тем, как «принять решение», открывать или не открывать дверцу перед приблизившейся молекулой, Демон должен измерить ее скорость - послать фотон. По изменению частоты отразившегося фотона Демон мог бы оценить скорость движения молекулы. Но импульс фотона
Кроме того, перед тем, как «принять решение», открывать или не открывать дверцу перед приблизившейся молекулой, Демон должен измерить ее скорость - послать фотон. По изменению частоты отразившегося фотона Демон мог бы оценить скорость движения молекулы. Но импульс фотона  соизмерим с импульсом молекулы mv. Поэтому после отражения фотона скорость молекулы изменится и может не соответствовать «решению», принятому Демоном.
соизмерим с импульсом молекулы mv. Поэтому после отражения фотона скорость молекулы изменится и может не соответствовать «решению», принятому Демоном.
Таким образом, как молекулярное сортирующее устройство Демон Максвелла в принципе невозможен.
ГЛАВА 3. Реальные газы
Уравнение Ван-дер-Ваальса
1. Точные и приближенные законы. В физике не много законов, которые выполняются точно. Это законы сохранения энергии, импульса, момента импульса и заряда. Большинство же физических законов являются приближенными. Они справедливы лишь тогда, когда значения величин, входящих в формулы законов, лежат в определенных пределах.
2.  Отступление реальных газов от уравнения Клапейрона – Менделеева. Уравнение Клапейрона – Менделеева приближенно описывает свойства реальных газов. Оно справедливо лишь при достаточно малых давлениях и выполняется тем точнее, чем ближе подходит газ по своим свойствам к идеальному.
Отступление реальных газов от уравнения Клапейрона – Менделеева. Уравнение Клапейрона – Менделеева приближенно описывает свойства реальных газов. Оно справедливо лишь при достаточно малых давлениях и выполняется тем точнее, чем ближе подходит газ по своим свойствам к идеальному.
В таблице 8 представлены опытные значения давления p (левый столбец) и объема V (средний столбец), измеренные для 1 моля азотапри температуре 273 К. В правой колонке вычислены произведения pV. Давление p указано в атмосферах (1 атм. = 101 325 Па), а объем в литрах (1 л = 1×10-3 м3).
Как видно из таблицы 8, произведение pV при больших давлениях не постоянно. Оно растет с увеличением давления p. Реальный газ сжимается меньше, чем это следует из уравнения Клапейрона – Менделеева.
Эти отступления объясняются тем, что молекулы реальных газов, в отличие от частиц идеального газа, имеют собственный объем, который слабо сказывается при малых давлениях. Так при атмосферном давлении среднее расстояние между молекулами примерно в 20 раз больше их диаметра. 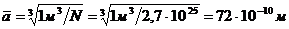 . Диаметр молекул азота, например, d = 3×10-10 м. Отношение ā | d » 72×10-10| 3×10-10 = 24.
. Диаметр молекул азота, например, d = 3×10-10 м. Отношение ā | d » 72×10-10| 3×10-10 = 24.
При давлении в 100 атмосфер среднее расстояние уменьшается примерно в  раз и составляет около 15×10-10 м, что лишь в 5 раз больше диаметра молекулы.
раз и составляет около 15×10-10 м, что лишь в 5 раз больше диаметра молекулы.
Поэтому при больших давлениях вследствие уменьшения расстояния между молекулами роль сил отталкивания и притяжения между молекулами увеличивается настолько, что проявляется не только в момент столкновения, но и между ними.
3. 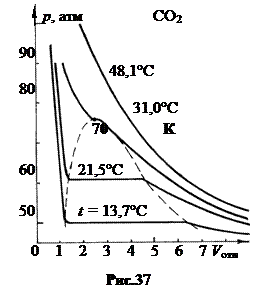

 Изотермы Эндрюса. В 1869 г. ирландский исследователь Томас Эндрюс, изучая изотермическое сжатие углекислого газа СО2 при комнатных и более высоких температурах, обнаружил, что при температурах ниже 31,0°С при достижении определенного давления газ конденсируется и углекислота СО2 переходит в жидкое состояние. При температурах выше 31,0°С углекислота СО2 остается в газообразном состоянии при любых сколь угодно высоких давлениях (рис.37).
Изотермы Эндрюса. В 1869 г. ирландский исследователь Томас Эндрюс, изучая изотермическое сжатие углекислого газа СО2 при комнатных и более высоких температурах, обнаружил, что при температурах ниже 31,0°С при достижении определенного давления газ конденсируется и углекислота СО2 переходит в жидкое состояние. При температурах выше 31,0°С углекислота СО2 остается в газообразном состоянии при любых сколь угодно высоких давлениях (рис.37).
При температурах t = 13,1°С и 21,5°С с уменьшением объема давление растет монотонно, но при некотором его значении оно перестает увеличиваться и остается постоянным пока газ конденсируется в жидкость. После полного перехода углекислоты в жидкое состояние при дальнейшем сжатии жидкости давление растет очень быстро.
Штриховая линия на графике выделяет область, в которой углекислота находится одновременно в двух состояниях – в жидком и газообразном. Говорят, в двухфазном состоянии. Справа и слева от штриховой линии однофазные области. Справа – газообразное состояние СО2, слева – жидкое.
Горизонтальные участки изотерм (изобары) в двухфазной области с повышением температуры Т становятся все короче, и при некоторой температуре Тк, которую Эндрюс назвал критической, изобара вырождается в точку. Для СО2 Тк = 31,0°С (304,2 К). Опыты Эндрюса показали, что при температурах, больших критической, газ невозможно превратить в жидкость простым сжатием.
4. Уравнение Ван-дер-Ваальса для 1 моля. Чтобы уравнение состояния идеальных газов могло удовлетворять реальным газам, нужно ввести в него поправки, учитывающие силы взаимодействия между молекулами. Это сделал в 1873 г. голландский физик Иоханнес Ван-дер-Ваальс, предложивший уравнение состояния реального газа для 1 моля в виде:
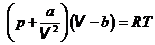 . Уравнение Ван-дер-Ваальса, 1873 (13.1)
. Уравнение Ван-дер-Ваальса, 1873 (13.1)
Здесь a и b – поправки, V - мольный объем V = V| v , измеряется в м3| моль. Член a| V 2 учитывает дополнительное давление в газах, обусловленное взаимным притяжением между молекулами. Член b – поправка на недоступный для молекул объем, она учитывает силы отталкивания между молекулами.
Уравнение Ван-дер-Ваальса получено в предположении, что b<<V и a| V 2<< p, а молекулы газа симметричны и моделируются твердыми упругими шариками. Не очень плотные реальные газы хорошо описываются уравнением Ван-дер-Ваальса количественно, а плотные лишь качественно. Воображаемый газ, точно подчиняющийся уравнению Ван-дер-Ваальса, называется газом Ван-дер-Ваальса и является идеализацией.
5. Уравнение Ван-дер-Ваальса дляnмолей. С увеличением количества вещества в n раз недоступный объем также увеличивается в n раз и становится равным nb. Уравнение Ван-дер-Ваальса для v молей принимает вид: 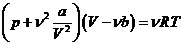 . (13.2)
. (13.2)
 Рассмотрим поправки подробнее.
Рассмотрим поправки подробнее.
а. Поправка b. Чтобы оценить поправку b, полагаем, что при каждом акте столкновения двух шаровых молекул для центра любой из них недоступным является объем 4pd 3| 3 (рис.38), где d - диаметр молекул, d = 2r.
Если в сосуде есть N молекул, то недоступный объем при парных столкновениях увеличивается в N| 2 раз и составляет  . (13.3)
. (13.3)
 Так как ×pd3|6 есть собственный объем шаровой молекулы, то получается, что поправка nb равна учетверенному собственному объему молекул.
Так как ×pd3|6 есть собственный объем шаровой молекулы, то получается, что поправка nb равна учетверенному собственному объему молекул.
б. Поправка a. Член pi = n 2a| V 2называется внутренним или молекулярным давлением. Оно обусловлено силами молекулярного притяжения. В отличие от сил отталкивания, действующих на близких расстояниях, силы молекулярного притяжения дальнодействующие. Вид зависимости молекулярного давления pi от объема V можно установить из следующих рассуждений. Рассмотрим молекулы реального газа вблизи от стенки (рис.39). Если молекула А находится достаточно далеко от стенки и окружена в пределах радиуса Ra действия сил притяжения со всех сторон молекулами газа, то силы притяжения, действующие на нее, со всех сторон одинаковы.
Если молекула В приблизилась к стенке на расстояние меньше Ra, то сила притяжения со стороны молекул газа будет больше, чем со стороны молекул, находящихся между молекулой В и стенкой.
И, наконец, молекула С притягивается только со стороны молекул газа.
В результате молекулы, приближающиеся к стенке, ведут себя подобно телам, брошенным вверх в поле силы тяжести. Их скорость по мере приближения к стенке уменьшается. В результате стенка при ударе молекулы получает меньший импульс, чем тот, который она могла бы получить в начале движения молекулы к стенке.
Внутреннее давление pi можно определить как давление, действующее на газ, но не доходящее до стенки. Оно пропорционально концентрации молекул газа в пристеночном слое и силе притяжения f, действующей на каждую пристеночную молекулу со стороны молекул газа. Очевидно, эта сила так же пропорциональна концентрации  , так что p ~ n× f ~ n2. Но концентрация обратно пропорциональна объему, n = N| V, n ~ 1| V. Так что pi ~ 1| V2, pi = a| V 2= n 2a| V 2.
, так что p ~ n× f ~ n2. Но концентрация обратно пропорциональна объему, n = N| V, n ~ 1| V. Так что pi ~ 1| V2, pi = a| V 2= n 2a| V 2.
6. Межмолекулярное взаимодействие в газах. Может возникнуть вопрос: почему при рассмотрении молекул в пристеночном слое мы пренебрегаем притяжением молекул газа к стенке? Ведь плотность упаковки молекул в стенке больше, чем в газе.
Дело в том, что этот пример с непритягивающейся стенкой использовался лишь как логический метод для выявления роли сил межмолекулярного притяжения. И даже если реальная стенка адсорбирует на своей поверхности часть молекул газа, свойства реального газа, обусловленные силами взаимного притяжения его молекул, не изменятся. Просто прилипание части молекул к стенке приведет к некоторому дополнительному понижению давления из-за уменьшения концентрации свободных молекул.
 Силы, действующие между молекулами, электрические по природе. Между молекулами, сблизившимися на расстояние 10-9 ÷ 10-10 м, действуют как силы притяжения разноименных зарядов Fприт, так и отталкивания одноименных зарядов Fотт.
Силы, действующие между молекулами, электрические по природе. Между молекулами, сблизившимися на расстояние 10-9 ÷ 10-10 м, действуют как силы притяжения разноименных зарядов Fприт, так и отталкивания одноименных зарядов Fотт.
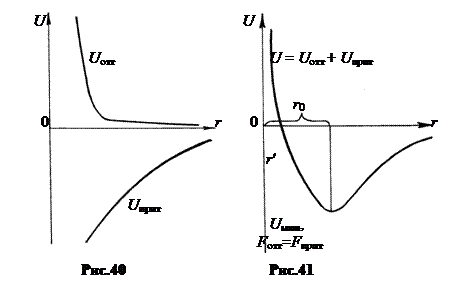
Силы отталкивания изменяются с расстоянием быстрее, чем силы притяжения. Если  - расстояние между центрами двух молекул, то Fотт ~1| rm, где m » 9 ÷ 15, а Fприт ~ 1| rn, где n » 7. Соответственно быстрее изменяется положительная энергия отталкивания Uотт (рис.40). Суммарная энергия U = Uотт + Uприт имеет минимум Uмин при некотором r0 (рис.41). У «несклеивающихся» молекул Uмин очень мала по абсолютной величине. Поэтому кинетической энергии молекул при обычных температурах достаточно, чтобы молекулы разлетелись после столкновения.
- расстояние между центрами двух молекул, то Fотт ~1| rm, где m » 9 ÷ 15, а Fприт ~ 1| rn, где n » 7. Соответственно быстрее изменяется положительная энергия отталкивания Uотт (рис.40). Суммарная энергия U = Uотт + Uприт имеет минимум Uмин при некотором r0 (рис.41). У «несклеивающихся» молекул Uмин очень мала по абсолютной величине. Поэтому кинетической энергии молекул при обычных температурах достаточно, чтобы молекулы разлетелись после столкновения.
Положительная энергия отталкивания образуется за счет кинетической энергии движения. После сближения молекул до некоторого расстояния r < r' они вновь расходятся под влиянием сил отталкивания, так что суммарная кинетическая энергия обеих молекул после столкновения оказывается такой же, как и до столкновения.
Правда, это справедливо лишь при низких температурах газа T ≤ 500°С, когда скорости движения подавляющего числа молекул невелики, так что при их столкновении не нарушается внутренняя структура молекул.
При более высоких температурах начинаются процессы диссоциации и ионизации, сопровождающиеся поглощением энергии.
Дата добавления: 2018-04-15; просмотров: 690; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
