Основное уравнение кинетической теории газов
1. Кинетическая модель идеального газа.С точки зрения молекулярно-кинетической теории абсолютно идеальным является газ, представляющий собой систему из огромного числа материальных точек, то есть бесконечно малых частиц, не взаимодействующих между собой и не сталкивающихся друг с другом.
При таких допущениях частицы идеального газа должны считаться совершенно свободными. Это значит, что движутся они прямолинейно и равномерно от одного соударения со стенкой сосуда до другого. Каждая частица идеального газа ведет себя так, как будто других частиц вокруг нее нет.
Физические законы и следствия, которым идеальные газы подчиняются точно, справедливы с определенной погрешностью и для реальных газов.
2. Основное уравнение кинетической теории газов.Поскольку газ есть система из хаотически движущихся с разными скоростями молекул, то можно предположить, что давление газа на стенки сосуда есть результат множества соударений молекулы со стенками. Поэтому должна быть определенная количественная связь между средними параметрами движения молекул и величиной давления.
Впервые эту связь теоретически установил Рудольф Клаузиус в 1857 году. Рассмотрим два подхода к этой задаче.
а.Скорости молекул газа одинаковы по величине.Предположим сначала, что все молекулы газа одинаковы, каждая имеет массу m, двигаются они хаотично с одинаковыми по величине скоростями u. Направления скоростей равновероятны (гипотеза элементарного беспорядка). Газ находится в замкнутом сосуде.
|
|
|
Выделим часть стенки площадью S, нормальную оси x. Полагаем, что молекулы газа соударяются со стенкой абсолютно упруго.
 Изменение импульса каждой молекулы при ударе
Изменение импульса каждой молекулы при ударе  в проекции на ось OX составляет -2mu cosq = -2mux (рис.19). Здесь ux= u cosq - проекция на ось OX скорости молекулы до соударения, q - угол между вектором скорости
в проекции на ось OX составляет -2mu cosq = -2mux (рис.19). Здесь ux= u cosq - проекция на ось OX скорости молекулы до соударения, q - угол между вектором скорости  и осью OX. Импульс силы со стороны молекулы на стенку
и осью OX. Импульс силы со стороны молекулы на стенку  , (7.1)
, (7.1)
где Δt – продолжительность соударения молекулы со стенкой.
За время dt>>Dt о стенку ударится половина молекул слоя толщиной uxdt, то есть  . (7.2)
. (7.2)
Здесь n – концентрация молекул газа.
Импульс силы со стороны всех z молекул на стенку есть  . Отсюда давление идеального газа, молекулы которого двигаются с одинаковыми по величине скоростями, есть
. Отсюда давление идеального газа, молекулы которого двигаются с одинаковыми по величине скоростями, есть  . (7.3)
. (7.3)
Давление газа пропорционально массе молекул m, их концентрации n и среднему квадрату проекции скорости движения молекул на нормаль к стенке  .
.
б. Скорости молекул газа различны по величине.В действительности скорости молекул газов разные не только по направлению, но и по величине.
Предположим, что газ состоит из нескольких групп молекул. Массы всех молекул одинаковы и равны m, а скорости молекул одинаковы по величине лишь в пределах групп. Пусть в группе 1 – скорости молекул  , в группе 2 – скорости молекул
, в группе 2 – скорости молекул  ,… в группе i скорости молекул
,… в группе i скорости молекул  .
.
|
|
|
Парциальное давление газа каждой группы определится также формулой (7.3):  , где
, где  - концентрация молекул газа в i-той группе.
- концентрация молекул газа в i-той группе.
По закону Дальтона для парциальных давлений суммарное давление газа в целом есть сумма парциальных давлений,  . (7.4)
. (7.4)
Сумму можно представить так:  , где n – концентрация всех молекул газа, а
, где n – концентрация всех молекул газа, а  - средний квадрат проекции скорости всех молекул.
- средний квадрат проекции скорости всех молекул.
Заметим, что число групп молекул в единице объема может достигать 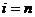 . То есть каждая молекула может иметь отличную от других молекул скорость, так что число групп будет равно числу молекул. Итак,
. То есть каждая молекула может иметь отличную от других молекул скорость, так что число групп будет равно числу молекул. Итак,  . (7.5)
. (7.5)
По сравнению с формулой (7.3) здесь входит средний квадрат проекции скорости.
Перейдем от проекции скорости  к модулю скорости u. Вектор скорости любой молекулы можно представить как сумму составляющих по осям.
к модулю скорости u. Вектор скорости любой молекулы можно представить как сумму составляющих по осям.  , (7.6)
, (7.6)
или  . (7.7)
. (7.7)
|
|
|
Направления скоростей равновероятны. Поэтому средние квадраты для системы с большим числом частиц одинаковы,  . Тогда
. Тогда
 ,
,  . (7.8)
. (7.8)
Подставляем.  .
.
 . Основное уравнение кинетической теории газов (7.9)
. Основное уравнение кинетической теории газов (7.9)
Давление в газах пропорционально концентрации молекул n и их средней кинетической энергии  хаотического поступательного движения.
хаотического поступательного движения.
3. Уравнение Клаузиуса.Формула (7.9) определяет макропараметр давление p как функцию двух микропараметров – концентрации молекул n и их средней кинетической энергии поступательного движения  . Чтобы вычислить какой либо микропараметр, нужно, чтобы в уравнении он был один, а все остальные были бы макропараметрами.
. Чтобы вычислить какой либо микропараметр, нужно, чтобы в уравнении он был один, а все остальные были бы макропараметрами.
Умножим формулу (7.9) на объем V и сравним её с уравнением Клапейрона-Менделеева.  . (7.10)
. (7.10)
Здесь 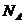 - число Авогадро. Разделив уравнение на ν, получаем
- число Авогадро. Разделив уравнение на ν, получаем  . (7.11)
. (7.11)
Отношение R/NA=k называют постоянной Больцмана. Ввел ее в практику Макс Планк в 1900 году. Это одна из важнейших констант в физике. Ее современное значение (1978 год) k = (1,380622 ± 0,000044)×10-23 Дж/К.
|
|
|
Формула (7.11) определяет среднюю кинетическую энергию поступательного движения одной молекулы идеального газа как функцию температуры газа T. Энергия пропорциональна абсолютной температуре газа.
Энергия молекулы, приходящаяся на 1 K, составляет  =3/2×1,38×10-23 =2,07×10-23 Дж.
=3/2×1,38×10-23 =2,07×10-23 Дж.
Если подставить  =3/2kT в основное уравнение кинетической теории газов, то получаем формулу, из которой можно вычислить концентрацию молекул газа n.
=3/2kT в основное уравнение кинетической теории газов, то получаем формулу, из которой можно вычислить концентрацию молекул газа n.
 . Уравнение Клаузиуса (7.12)
. Уравнение Клаузиуса (7.12)
Вычислим концентрацию молекул воздуха при нормальных условиях.
 . (Иоганн Лошмидт, 1865)
. (Иоганн Лошмидт, 1865)
4. Среднеквадратичная скорость молекул находится из условия:
 . Отсюда
. Отсюда 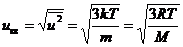 . (7.13)
. (7.13)
Здесь M – молярная масса газа.
Среднеквадратичная скорость  - это скорость, средняя по кинетической энергии молекул. Например, для азота, М = 0,028 кг/моль, при T = 273 K
- это скорость, средняя по кинетической энергии молекул. Например, для азота, М = 0,028 кг/моль, при T = 273 K
 . Для кислорода при той же температуре
. Для кислорода при той же температуре  , для водорода uкв = 1800 м/с, для углекислого газа uкв = 390 м/с. Чем больше молярная масса газа, тем меньше скорость движения его молекул. У хлора М = 0,071 кг/моль, uкв = 270 м/с, у ртути М = 0,200 кг/моль, скорость движения ее атомов в парах uкв = 180 м/с.
, для водорода uкв = 1800 м/с, для углекислого газа uкв = 390 м/с. Чем больше молярная масса газа, тем меньше скорость движения его молекул. У хлора М = 0,071 кг/моль, uкв = 270 м/с, у ртути М = 0,200 кг/моль, скорость движения ее атомов в парах uкв = 180 м/с.
5. Температура T и давление p - статистические величины. Эти понятия применимы лишь к системам с огромным числом молекул, соизмеримым с числом Авогадро NA = 6,022×1023 моль-1
Свойства газа как системы частиц не сводимы к свойствам отдельных молекул. Такая система проявляет новые качества и характеризуется новыми физическими величинами – давлением p и температурой T. Здесь проявляется диалектический закон перехода количества в качество. Свойства газов определяются усредненными параметрами молекул – средней кинетической энергией  , средней скоростью
, средней скоростью  , средним импульсом
, средним импульсом  . Средние величины находятся методами статистики. Раздел физики, методом исследования в котором является статистика, называется статистической физикой.
. Средние величины находятся методами статистики. Раздел физики, методом исследования в котором является статистика, называется статистической физикой.
6. Изменение температуры газа в адиабатных процессах благодаря кинетической модели газа из эмпирического факта превращается в явление с наглядным механизмом.
Когда газ сжимается, его молекулы сталкиваются с приближающейся стенкой сосуда. Если скорость стенки u0, то каждая ударившаяся упруго с ней молекула, двигавшаяся до удара со скоростью u, отскакивает от стенки со скоростью u + 2u0 (См.: Механика, упругий удар шара со стенкой). Кинетическая энергия молекулы увеличивается с  до
до  . Температура газа растет.
. Температура газа растет.
Когда газ расширяется, молекулы ударяются с убегающей стенкой. Скорость молекул уменьшается на величину 2u0, уменьшается соответственно их кинетическая энергия. Температура газа падает.
7. Броуновское движение.В 1827 г. английский ботаник Роберт Броун, наблюдая в усовершенствованный оптический микроскоп с большим увеличением микроорганизмы в воде, обнаружил, что невозможно получить резкое изображение этих микрообъектов. Оказалось, что микрочастицы, взвешенные в жидкости, находятся в состоянии непрерывного дрожания. Факт их реального дрожания подтверждался тем, что царапины и частицы меньших размеров на твердой подложке наблюдались вполне отчетливо. Позднее подобное дрожание, которое стали называть броуновским движением, обнаружили и в газах.
В этом явлении замечательно проявилась молекулярно-кинетическая структура вещества. Микрочастицы размером 0,1 ÷ 10 мкм находятся среди хаотично движущихся молекул жидкости или газа. Размер молекул примерно в 1000 раз меньше. Благодаря случайному распределению ударяющихся о частицу молекул сообщаемый ими импульс с какой-либо стороны оказывается больше. В результате возникает некоторая отличная от нуля равнодействующая сила, перемещающая частицу.
Интенсивность броуновского движения не ослабевает со временем и не зависит от химических свойств среды. Было замечено, что она тем больше, чем выше температура среды и чем меньше ее вязкость.
Теорию броуновского движения в рамках МКТ независимо друг от друга построили Альберт Эйнштейн и Мариан Смолуховский в 1905-906 г.г.
Оказалось, что в результате случайных толчков со стороны молекул броуновская частица дрейфует, удаляясь от исходной точки по закону
 . Формула Эйнштейна-Смолуховского (7.14)
. Формула Эйнштейна-Смолуховского (7.14)
Здесь  - среднеквадратичное удаление частицы от исходного положения, k – постоянная Больцмана, T – абсолютная температура среды, t – продолжительность времени наблюдения, B – подвижность.
- среднеквадратичное удаление частицы от исходного положения, k – постоянная Больцмана, T – абсолютная температура среды, t – продолжительность времени наблюдения, B – подвижность.
У частиц сферической формы B = 1ç6pha, (7.15)
где h – вязкость среды, a – радиус броуновской частицы.
Экспериментально проверили и подтвердили формулу Эйнштейна-Смолуховского Жан Перрен и независимо от него Теодор Сведберг в 1906-908 г.г. Вычисленные по результатам их измерений число Авогадро NA и постоянная Больцмана k совпали со значениями, найденными другим путем.
Перрен работал с частицами эмульсии каучуковых смол в воде (гуммигут) размером около 1 мкм и увеличением микроскопа около 3000 крат. Интервалы времени составляли около 30 с. Соединяя прямыми линиями последовательные положения частиц, он получил ломаную со случайными значениями длин отрезков и их направлений. Расчеты показывают, что в 1 с броуновская частица испытывает до 1014 молекулярных толчков. Поэтому, уменьшение интервала времени вплоть до 10-14 с не превращает ломаную линию в гладкую кривую. Гладкими кривыми является лишь отрезки, на которых броуновская частица движется от одного толчка до другого.
Броуновское движение дает возможность установить тот минимальный объем, в котором вещество еще можно рассматривать как сплошную бесструктурную среду. Дрожание частиц становится заметным, начиная с радиуса частиц a » 10 мкм. Это свидетельствует о том, что начиная с объема a3 » 10-15 м3 вещество уже проявляет свою дискретную структуру.
Поскольку броуновская частица находится в тепловом равновесии с окружающей средой, то ее средняя кинетическая энергия такая же, как и у молекул среды. Поэтому среднеквадратичная скорость частицы (средняя по энергии), взвешенной в газе, находится по формуле  , (7.16)
, (7.16)
где m – масса броуновской частицы.
Дата добавления: 2018-04-15; просмотров: 1012; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
